2. 中国科学院大学,北京 100049;
3. 青海省县镇企业技术组厂站,西宁 810008
2. University of Chinese Academy of Sciences,Beijing 100049;
3. Technology Extension Stations of Township Enterprises of Qinghai Province,Xining 810008
云生毛茛(Ranunculus nephelogenes var. nephelo-genes)为毛茛科(Ranunculaceae)毛茛属(Ranunculus Linn.)多年生草本,生长于海拔2 21 0-4 800 m的高山草甸、沼泽草甸、河滩、湿地等处,在我国主要分布于甘肃、青海、云南、四川、西藏和新疆等省区[1]。同时云生毛茛是祁连山湿地主要的挺水植物之一,在祁连山湿地水土保持和气候调节中占据重要地位。
目前对于云生毛茛的研究较少,仅涉及药用价值、核型、繁育系统等研究。云生毛茛具有轻微毒性,全草可入药,有清热解毒,利尿解表的功效[2],其中所含的毛茛黄酮有抗炎、抗菌、抗肿瘤等药理活性[3, 4];毛茛苷类成分具有显著的抗炎、镇痛和抗心肌肥大等作用[5, 6];开发和利用其药用价值前景广阔。聂谷华[7]报道云生毛茛染色体数目为32,其核型公式2n = 4x = 32 = 16m + 10sm + 6st,核型类型3B;赵志刚等[8-10]的研究认为云生毛茛为兼性无融合生殖,性分配偏向雄性功能的分配,并会随着自交率的增加而降低。
毛茛属中许多类群在形态上存在渐变性变化,有些物种的分类学地位尚不确定。近年来,分子生物学技术被应用于分类学中,Jensen和Hoot[11]基于多个基因片段建立的系统树,把毛茛科分成3个亚科:黄连亚科、扁果草亚科和毛茛亚科。其中毛茛亚科包括7个族,侧金盏花族单列为一族,包括了美化草属、侧金盏花属和金莲花属3个属,并认为侧金盏花族和毛茛族独立进化,而且侧金盏花属和金莲花属的关系较近。Paun等[12]基于ITS、matK、trnK分子片段对毛茛属及其近缘类群的研究表明:毛茛属的核心成员和水毛茛属近缘,向外依次为角果毛茛属、碱毛茛属和鸦拓花属。尚未见利用分子标记技术研究云生毛茛遗传特征的报道。
简单重复序列间扩增(inter simple sequence repeat,ISSR)分子标记技术是以简单序列重复标记(simple sequence repeat,SSR)标记为基础建立的第二代分子标记技术[13],利用基因组中存在的简单重复序列SSR设计引物,在SSR的3′或5′端加锚 1-4 个随机碱基,以此作为3′或5′引物,对两侧具有反向排列的SSR间的基因组片段进行扩增。与SSR相比,ISSR技术具有无需预知研究对象的基因组序列、无需设计专门引物、对DNA模板质量要求较低等优点,广泛适用于不同植物的遗传多样性分析、种质鉴定、基因定位和比较基因组学研究等方向[14-16]。利用ISSR技术对云生毛茛的遗传结构、遗传多样性进行分析,将为研究祁连山湿地药用资源开发与保护提供重要实验依据。本研究以云生毛茛为研究对象,在预实验基础上对影响PCR扩增结果的模板DNA、Mg2+、dNTP、Taq DNA聚合酶及引物5个因子进行优化筛选,以期建立适合于云生毛茛ISSR分子标记的PCR反应体系,为后续深入研究云生毛茛遗传多样性奠定基础。
1 材料与方法 1.1 材料样品于2012年采自青海省祁连山地区,经中国科学院西北高原生物研究所卢学峰研究员鉴定为云生毛茛,每个植株样品采集嫩叶,迅速放入塑料自封袋中,并加入硅胶干燥保存。凭证标本保存于中国科学院西北高原生物研究所青藏高原生物标本馆(采集号2013001-2013002)。
本实验采用由加拿大哥伦比亚大学(UBC)提供的Set#9引物序列[17]作为ISSR扩增引物,由上海生工生物工程技术服务有限公司合成。经初步试验,选用扩增片段清晰、多态性丰富的引物UBC810(5′-GAGAGAGAGAGAGAGAT-3′)作为建立反应体系的固定引物。实验中使用的dNTP mixture、Taq DNA聚合酶、10×Buffer、100 bp DNA Ladder、200 bp Ladder均购自宝生物工程(大连)有限公司。
C1000 TouchTM Thermal Cycler PCR仪,美国Bio-Rad;Power PacTM Universal 电泳仪,美国Bio-Rad;ChemiDocTM MP凝胶成像系统,美国Bio-Rad。
1.2 方法 1.2.1 云生毛茛基因组总DNA提取采用改良CTAB法[17]提取云生毛茛的基因组总DNA。各取3 µL DNA样品,经1%琼脂糖凝胶电泳检测;使用Nano Drop 2000c微量分光光度计测定DNA浓度、A260和A280值。DNA纯度以A260/A280比值为标准进行评估。提取得到的云生毛茛基因组总DNA样品放入-20 ℃ 冰箱保存。
1.2.2 云生毛茛ISSR-PCR扩增反应体系优化采用正交设计法,设计以Mg2+浓度、Taq DNA聚合酶用量、dNTP浓度、引物用量、DNA浓度为变量的五因素四水平正交实验(表 1),研究各因素对扩增结果的影响。PCR反应程序设置为:94 ℃ 预变性5 min;94 ℃ 变性20 s,58 ℃ 退火1 min,72 ℃ 延伸100 s,共35个循环;最后72 ℃ 延伸6 min。反应产物在1.2% 琼脂糖凝胶(含0.5 µg/mL EB)中电泳拍照。正交实验重复2次。参照何正文等的直观分析法[18, 19],对每一处理结果进行评分。依据条带清晰度、多态性、稳定性对各实验结果进行评分,特异性高、条带清晰、亮度最高的16分,最低1分。评分结果用DPS 7.05 统计软件进行方差分析[20]。
1.2.3 云生毛茛ISSR-PCR扩增反应程序优化设计33、35、38、40和45个扩增循环次数和60 s、80 s、100 s、120 s和150 s五个延伸时间,比较不同循环次数和延伸时间对PCR扩增结果的影响。
1.2.4 云生毛茛ISSR-PCR扩增体系验证以不同居群的云生毛茛基因组总DNA为模板,在优化得到的最佳反应条件下用引物UBC810进行PCR扩增,检验建立的扩增体系的稳定性。每个样品做两个重复。
1.2.5 引物筛选及其退火温度优化应用以优化的反应体系与反应程序,选取一个云生毛茛基因组总DNA样品作为模板,分别与100条ISSR引物进行PCR扩增,选取扩增条带清晰、丰富、多态性好的引物作为云生毛茛ISSR-PCR扩增的最佳引物。再根据公式Tm = 4(G+C)+ 2(A+T),计算出各引物的理论退火温度Tm。在理论退火温度Tm值上下 1-3 ℃ 范围内,利用PCR仪自动生成的温度梯度进行PCR扩增,优化各引物的最佳退火温度。
2 结果 2.1 云生毛茛基因组总DNA提取结果云生毛茛基因组总DNA凝胶电泳结果如图 1所示,DNA条带清晰明亮,无拖尾现象,说明所提取的云生毛茛基因组总DNA完整性好,无明显降解。微量分光光度计测得DNA样品浓度在23 9-8 23 ng/µL 之间,A260/A280的比值均在1. 8-2 .0之间,说明用改良CTAB法提取获得的DNA样品纯度较高,能够满足后续实验要求。
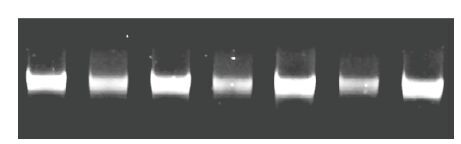
|
| 图 1 云生毛茛正交实验电泳图 |
云生毛茛正交实验电泳结果如图 2所示,各因素不同浓度组合的扩增结果差异明显,其中实验7多态性位点多,且条带清晰明亮。对正交实验各处理扩增结果进行评分,评分结果,见表 1。

|
| 图 2 云生毛茛正交实验电泳图 |
根据评分计算同一因素不同水平间极差R和平均值X,结果见表 2。极差值R越大,说明该因素对扩增结果的影响越大;平均值X最大的因素水平即为该因素的最佳浓度。表 2中结果显示,各因素对扩增结果的影响从大到小依次为引物>Mg2+> dNTP>DNA>Taq DNA聚合酶;Mg2+和DNA水平2、Taq DNA聚合酶水平3、dNTP和引物水平4最好,即模板DNA 30 ng,Mg2+ 1.95 mmol/L,Taq DN聚合酶0.04 U/µL,引物0.5 µmol/L,dNTP 0.150 mmol/L。
方差分析(表 3)结果显示,各因素对实验结果均有影响,且每个因素对扩增结果的影响均达到极显著水平(P<0.01)。F值显示的各因素对扩增结果的影响从大到小依次为引物 > Mg2+ > dNTP > DNA> Taq DNA聚合酶,与极差法分析的结果一致。为确定每个因素的最适浓度水平,对5个因素进行Duncan多重比较,结果见表 4。
引物是影响云生毛茛ISSR-PCR扩增结果的最大因素,本实验中当引物浓度为0.5 µmol/L时极差分析评分结果均值最大,且与其它水平之间差异显著,因此选择0.5 µmol/L为最佳引物浓度。
Mg2+对云生毛茛ISSR-PCR反应的影响仅次于引物,本实验中当Mg2+浓度为1.95 mmol/L时极差分析评分结果均值最大,且与其它水平之间差异显著,因此选择1.95 mmol/L为Mg2+最佳浓度。
dNTP是ISSR-PCR扩增反应的重要原料,本实验中当dNTP浓度为0.150 mmol/L时评分结果均值最大,且与其它水平之间差异显著。因此选择0.150 mmol/L为dNTP的最佳浓度。
本实验中DNA含量为30 ng时极差分析评分结果均值最大,且与其它水平之间差异显著。因此选择30 ng为DNA的最佳用量。Taq DNA聚合酶浓度对扩增结果影响最小,当Taq DNA聚合酶浓度为0.04 U/µL时,极差分析评分结果均值最大,与低浓度水平1、2间差异显著,但与高浓度水平4(0.05 U/µL)无显著差异。因此从经济角度选择0.04 U/µL为Taq DNA聚合酶的最佳浓度。
综上分析结果确定云生毛茛ISSR-PCR最佳反应体系为:每20 µL反应体系模板DNA 30 ng,Mg2+ 1.95 mmol/L,Taq DNA聚合酶0.04 U/µL,引物0.5 µmol/L,dNTP 0.150 mmol/L。
2.3 云生毛茛ISSR-PCR扩增反应程序优化不同循环次数下云生毛茛ISSR-PCR扩增结果如图 3所示,38个循环的扩增可获得明亮清晰的条带,循环次数再增加,条带无明显变化,说明该扩增体系在38循环时到达平台期。

|
| 图 3 不同循环次数与不同延伸时间下的扩增结果 1-5:循环次数依次为33、35、38、40、45;6-10:延伸时间依次为60 s、80 s、100 s、120 s、150 s ;M1 :100 bp DNA Marker、M2 :200 bp DNA Marker |
不同延伸时间下的云生毛茛ISSR-PCR扩增结果(图 3)显示,延伸时间在60 - 80 s之间时,条带丰富但比较模糊,延伸时间在100 - 120 s之间时条带丰富、清晰明亮,且扩增结果并没有明显差异,延伸时间在150 s 时产生了非特异性条带。为了保证扩增结果同时减少扩增时间,本实验选择了100 s 作为最适延伸时间。
2.4 云生毛茛ISSR-PCR扩增反应体系验证采用优化所得的ISSR-PCR反应体系,引物UBC810与不同居群的云生毛茛基因组总DNA样品进行扩增反应,每个样品做两个重复。扩增结果如图 4所示,不同居群样本在该体系下均能获得清晰丰富且重复性好的扩增条带,证明此体系稳定可靠,适合云生毛茛ISSR-PCR扩增反应。
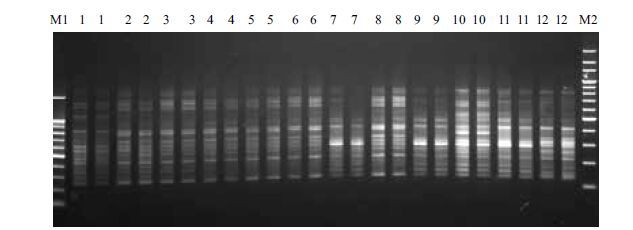
|
| 图 4 引物UBC810 与不同云生毛茛个体的扩增结果 M1 :100 bp DNA Marker ;M2 :200 bp DNA Marker |
通过对100条引物的筛选,共得到16条ISSR-PCR扩增结果良好的引物。温度梯度PCR扩增结果(图 5)显示,退火温度对PCR扩增结果影响明显。退火温度为52.2 ℃ 时扩增条带最丰富,明亮清晰,稳定性好,因此选择该温度为此引物的最适退火温度。16条引物的序列及各自最适退火温度,见表 5。

|
| 图 5 引物(UBC812)不同退火温度下的扩增结果 |
ISSR分子标记技术广泛应用于各种药用植物的种质鉴定与分类、遗传多样性分析等,比传统形态学、细胞学方法更加准确可靠,同时比基因测序等新技术手段更加方便经济。但ISSR扩增结果易受到Mg2+、引物、dNTPs及Taq DNA聚合酶、模板DNA等因素的影响。建立精确的ISSR-PCR反应体系和反应程序,对保证ISSR实验结果的可靠性十分必要。
正交实验设计能用较少处理组合获得各因素不同水平对扩增结果的影响,考察不同因素对扩增结果的影响显著性。在本实验中扩增结果的直观分析结果表明不同因素的各水平组合对云生毛茛ISSR扩增结果影响较大;极差分析结果显示各因素对扩增结果的影响由大到小依次是:引物> Mg2+>dNTP>DNA>Taq DNA聚合酶;方差分析结果与极差分析结果一致,且每个因素对扩增结果均有极显著影响。
引物是影响云生毛茛ISSR扩增反应最大的因子,引物浓度低会降低ISSR体系的扩增效率,浓度过高则会引起错配和非特异性扩增,并容易形成引物二聚体。该结论与杂交油菜[21]的ISSR体系建立等研究结果一致。Mg2+浓度过高,PCR扩增反应特异性降低,会出现非特异扩增,浓度过低会降低Taq DNA聚合酶活性,降低ISSR体系的扩增效率。Mg2+对云生毛茛ISSR-PCR扩增结果同样有极显著影响,但其影响力小于引物。而在黔产宽叶缬草[22]、紫云英等[23]ISSR扩增体系中,Mg2+对扩增结果影响最大。说明在不同物种,各影响因素对扩增结果影响不同。通过对影响扩增结果的主要因素进行优化筛选,建立针对研究物种的最佳反应体系是十分必要的。优化获得的体系对不同样品均能获得清晰明亮,丰富高,重复性好的扩增结果,证明该体系适合云生毛茛ISSR-PCR扩增。
同一引物在不同物种的ISSR扩增体系中最适退火温度也各不相同,甚至差异巨大。如引物UBC810在本实验中对云生毛茛ISSR-PCR扩增反应的最适退火温度为52.2 ℃ ,而在瓜蒌[24]的ISSR-PCR反应体系中,最适退火温度为53.6 ℃ ,在长叶红砂[25]的ISSR-PCR扩增体系中的最适退火温度为48 ℃ 。因此应在理论退火温度的基础上,针对不同物种对引物的退火温度进行适当的筛选与调整,以期获得稳定可靠的扩增图谱。
4 结论采用正交实验设计,对实验结果进行直观分析、极差分析和方差分析,确定了模板DNA、Mg2+、Taq DNA聚合酶、引物、dNTP五个主要因素对云生毛茛ISSR-PCR扩增的影响力大小及最佳用量,最终确定云生毛茛ISSR-PCR的最佳反应体系为:20 µL反应体系中,包含模板DNA 30 ng,Mg2+ 1.95 mmol/L,Taq DNA聚合酶0.04 U/µL,引物0.5 µmol/L,dNTP 0.15 mmol/L;通过对循环次数和延伸时间的优化确立云生毛茛ISSR-PCR扩增的最佳反应程序,即为:94 ℃ 预变性5 min;94 ℃ 变性20 s,49. 6-6 0.6 ℃ 复性1 min,72 ℃ 延伸100 s,共38个循环;72 ℃ 下再延伸6 min。验证实验表明,该体系稳定可靠,适于云生毛茛的ISSR-PCR扩增。
| [1] | 张胜邦, 卢学峰. 青海澜沧江源种子植物[M]. 西宁: 青海民族出版社, 2012. |
| [2] | 卢学峰, 张胜邦. 青海野生药用植物[M]. 西宁: 青海民族出版社, 2012. |
| [3] | 崔秀君. 小毛茛抗肿瘤有效部位的化学成分的研究[D]. 济南:山东中医药大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10441-2006015194.htm |
| [4] | 钟艳梅, 冯毅凡. 毛茛属药用植物中黄酮和内酯类成分的研究进展. 中草药 , 2011, 42 (4) : 825–828. |
| [5] | 王榕乐, 谭毓治. 毛茛总苷对血管紧张素 Ⅱ 致心肌肥大的影响. 广东药学院学报 , 2008, 24 (2) : 154–156. |
| [6] | 王榕乐, 谭毓治, 罗绍宝. 毛茛总苷抗炎镇痛作用研究. 时珍国医国药 , 2009, 20 (2) : 290–292. |
| [7] | 聂谷华, 廖亮, 方亮, 等. 国产毛茛属植物五种一变种的核型. 云南植物研究 , 2007, 29 (3) : 316–322. |
| [8] | 赵志刚, 杜国祯, 任青吉. 5种毛茛科植物个体大小依赖的繁殖分配和性分配. 植物生态学报 , 2004, 28 (3) : 9–16. |
| [9] | 赵志刚, 杜国祯, 刘左军. 雌雄同花植物的性分配. 生态学报 , 2005, 25 (10) : 2725–2733. |
| [10] | 赵志刚, 杜国祯. 毛茛科植物交配系统的特征与花期资源分配对策. 兰州大学学报 , 2003, 39 (5) : 70–74. |
| [11] | Jensen U, Hoot SB, Johansson JT, et al. Systematica and phylogeny of the Ranunculaceae-arevised family concept on the basis of molecular data. Pl Syst Evol , 1995, 9 (Suppl) : 273–280. |
| [12] | Paun O, Lehnebach C, Johansson JT, et al. Phylogenetic relationships and biogeography of Ranunculus and allied genera(Ranunculaceae)in the Mediterranean region and in the European Alpine System. Taxon , 2005, 54 : 911–930. DOI:10.2307/25065478 |
| [13] | Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeats(SSR)-anchored polymerase chain reaction amplification. Genomics , 1994, 20 : 176–183. DOI:10.1006/geno.1994.1151 |
| [14] | Godwin ID, Aitken EA, Smith LW. Application of inter—simple sequence repeat(ISSR)markers to plant genetics. E1ectrophoresis , 1997, 18 : 1524–1528. DOI:10.1002/(ISSN)1522-2683 |
| [15] | Moreno S, Martin JP, Ortiz M. Inter-simple sequence repeats PCR for characterization of closely related grapevine germplasm. Euphytica , 1998, 101 : 117–125. DOI:10.1023/A:1018379805873 |
| [16] | Fang DQ, Krueger RR, Roose ML. Phylogenetic relationships among selected Citrus germplasm accessions revealed by inter-simple sequence repeat(ISSR)markers. J Amer Soc Horticul Sci , 1998, 123 : 612–617. |
| [17] | 邹喻萍, 葛颂, 王晓东. 系统与进化植物学中的分子标记[M]. 北京: 科学出版社, 2001. |
| [18] | 贺石林. 中医科研设计与统计方法[M]. 长沙: 湖南科技出版社, 1989. |
| [19] | 何正文, 刘运生, 陈立. 正交设计直观分析法优化PCR条件. 湖南医科大学学报 , 1998, 23 (4) : 403–404. |
| [20] | 唐启义, 冯明光. DPS数据处理系统-实验设计?统计分析及模型优化[M]. 北京: 科学出版社, 2006. |
| [21] | 彭秉玉, 胡延萍, 巩爱岐, 等. 杂交油菜ISSR-PCR反应体系的建立和优化. 植物研究 , 2010, 30 (5) : 576–581. |
| [22] | 钱志瑶, 周道堂, 黄秀平, 等. 黔产宽叶缬草ISSR反应体系的建立与优化. 生物技术通报 , 2015, 31 (7) : 69–75. |
| [23] | 孙清信, 陈坚, 张辉, 等. 紫云英ISSR引物的筛选及PCR反应体系的优化. 植物遗传资源学报 , 2012, 5 : 870–878. |
| [24] | 王真真, 韩琳娜, 郭庆梅, 等. 瓜蒌ISSR-PCR最佳反应体系的研究. 辽宁中医杂志 , 2013, 40 (10) : 2094–2096. |
| [25] | 王玉山, 张颖娟. 濒危植物长叶红砂ISSR扩增条件的优化与引物筛选. 内蒙古师范大学学报:自然科学汉文版 , 2008, 37 (3) : 417–421. |