2. 中国科学院大连化学物理研究所天然产物与糖工程组,大连 116000
2. Natural Products and Glyco-Biotechnology,Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023
随着化石资源的日益消耗,以及其带来大量温室气体的排放,可再生能源和可再生资源的开发利用在世界范围引起广泛重视。生物质是唯一可再生的碳资源,将生物质转化成平台化合物和大宗化学品是生物质转化利用的重要发展方向。5-羟甲基糠醛(5-hydroxy methylfurfural,HMF)被认为是可由生物质原料制备的、最具价值和潜力替代石化工业中基础化学品的生物基平台化学品,在国际上被视为一种介于生物基糖化学和石油基化学之间的关键桥梁化合物[1]。欧盟BREW“以可再生原料利用生物技术生产大宗化工产品的中长期挑战”200 6-2 050中将HMF列为最重要的六碳平台化合物。HMF分子呋喃环上带有醛基和羟甲基,可以催化氧化生成一系列呋喃类芳香化合物,从而替代石油来源的苯类大宗化学品,因此具有广泛的经济和社会意义。
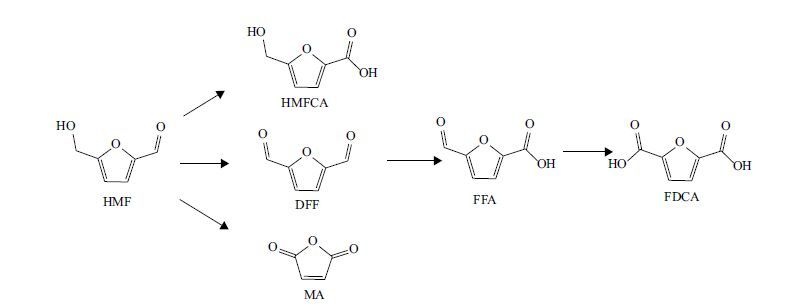
HMF带有一个醛基和一个羟甲基,根据氧化的位置和氧化程度,可以分别氧化成5-羟甲基-2-呋喃甲酸(5-hydroxymethylfuroic acid,HMFCA),2,5-呋喃二甲醛(2,5-diformylfuran,DFF),5-甲酰基-2-呋喃甲酸(5-formylfuroic acid,FFCA),2,5-呋喃二甲酸(2,5-furandicarboxylic acid,FDCA)[2];当氧化程度更高,发生C-C断裂时,可生成马来酸酐(maleic anhydride,MA)[3]。具体如图 1所示。
|
| 图 1 HMF氧化路线 |
在这些HMF氧化产物中,FDCA的市场前景最为广阔。FDCA与石油基大宗化学品对苯二甲酸结构相似,可以替代对苯二甲酸用于制造聚酯、聚酰胺类[4]材料,市场潜在规模可达每年百万吨级。此外,FDCA在农药和医药方面也有着广泛应用。2004年,美国能源部(DOE)将FDCA列为可通过以生物质为原料制备的最具价值、最有希望替代石化产业中基础化学品的十二个平台化学品之一[5]。2012年,国际能源署(IEA)将FDCA列为生物基来源的C6平台化合物[6]。HMF的其他氧化产物同样具有非常重要的应用价值。DFF具有醛的典型化学性质,可以作为聚合物单体以及药物和农药中间体[7],功能性材料[8],具有广泛应用。而HMFCA自身带有羧基和羟甲基,可以自身或者与其他化合物聚合成多种聚酯[9],同时还可以作为白介素抑制剂[10]。
HMF的化学转化已经取得较多进展,主要是以钌[11]、锰[12]和钒[13]等金属催化剂催化HMF氧化制备DFF和MA,用铂[14]、金[15]和钯[16]等催化HMF氧化制备FDCA。然而,这些方法都需要较高温度和压力,存在产物选择性和底物耐受性差的问题。与化学转化相比,生物转化具有反应条件温和,选择性高的特点。近几年,生物转化HMF越来越成为人们关注的重点。本文从生物转化的发现、生物催化过程的构建方面对HMF生物催化氧化进行综述,并提出未来发展方向等,以期为HMF生物转化过程的研究奠定理论基础。
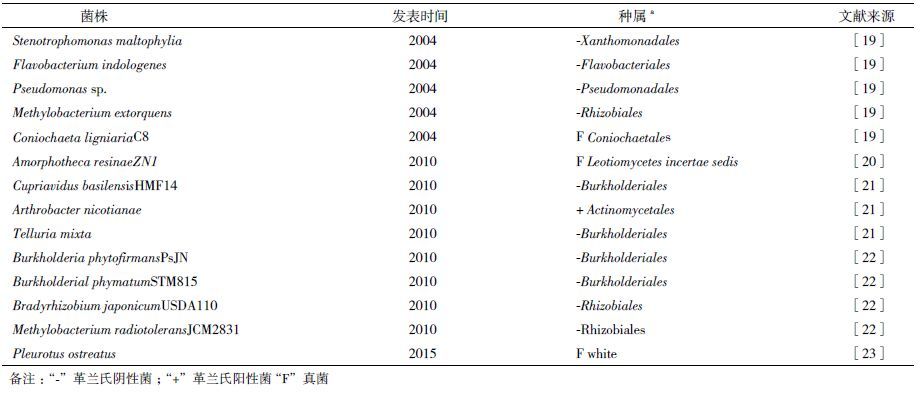
1 HMF生物转化过程的发现HMF的生物转化最初是在发酵过程中发现的。在木质纤维素的预处理过程中,会产生许多影响微生物生长和代谢的化合物,从而影响发酵过程的产量和效率。HMF就是其中主要的抑制因子之一[17]。消除这些发酵抑制因子或者降解其为毒性更小的化合物成为生物质转化中尤为重要的一环。为了消除这些抑制因子的抑制作用,研究人员开发了大量技术,如水洗、超施石灰处理、离子交换吸附、萃取、碱沉淀及使用漆酶处理等[18]。但是这些方法存在耗水量大、水污染严重等问题,且不能完全去除抑制因子。研究发现,采用微生物生物解毒和生物消除能够专一性的消除发酵抑制因子,而不需要添加其他的化学品,并且产生可降解的废物,因此可代替物理化学解毒的方法,并在这一过程中发现了许多能够氧化降解HMF的微生物(表 1)。
Lopez等[19]筛选了5个细菌和1个真菌发现,所选的微生物均能降低实验培养基中毒性抑制因子的浓度,但是只有真菌菌株Coniochaeta ligniaria C8(NRRL30616)能够完全降解其中的HMF和糠醛。Wierckx等[21]在油和水中分离到多种细菌,以HMF为唯一碳源培养,筛选出能利用HMF 的3种菌属:地神菌属(Telluria)、节杆菌属(Arthrobacter)和贪铜菌属(Cupriavidus),共14株菌;其中Cupriavidus HMF13,14能够降解木质纤维素水解物中的有毒抑制因子,且在25 h内不会影响总糖的浓度。2010年,Zhang等[20]在预处理的玉米秸秆材料微生物群落中分离到一种煤油真菌菌株Amorphotheca resinae ZN1,该菌株不仅可以完全降解包括HMF在内的所有已知的发酵抑制因子,不会引起纤维素的损耗,而且可广泛用于各种木质纤维素原料的解毒。另外,该菌生长迅速,能够避免其他微生物的污染,而在后续的无氧发酵中自然消失,无需后续灭菌过程。但是该菌也存在一些问题,处理过程会大量利用预处理纤维素中的木糖,且该菌对抑制因子的解毒时间相对较长( 2-5 d)。2015年,Feldman等[23]首次将木质素降解系统菌株白腐真菌糙皮侧耳菌(Pleurotus ostreatus)用于转化HMF,其能够在48 h内代谢30 mmol/L的HMF,将其转化为2 ,5-呋喃二甲醇和FDCA。研究发现该菌株利用分泌的芳香醇氧化酶(aryl-alcohol oxidase,AAO)和胞内醛脱氢酶(aryl alcohol dehydrogenase,AAD)两个系统共同作用转化HMF。Jimenez等[24]对未经处理的小麦秸秆和经过烘烤的小麦 秸秆中的微生物进行了筛选,分离到96株能够在HMF中生长的菌株,其中48株具有胞外5-羟甲基糠醛氧化酶活性。这些菌株主要归属于粪壳菌(Conicochaeta),假单胞菌(pseudomonas),拉乌尔菌属/克雷白氏菌(Raoultella/Klebsiella),埃希氏菌属(Escherichia),毛孢子菌(Trichospron),节杆菌属(Arthrobacter)和肠杆菌(Enterobacter)。
2 HMF在微生物中的代谢过程虽然能转化利用HMF的微生物种属不同,但是HMF氧化代谢途径在这些微生物之间具有相似性。Koopman等[22]通过转位子突变筛选到两组基因簇(hmfABCDE和hmfFGH’H),将两基因簇分别在P.putida S12中功能性的表达,结合Trudgill等[25]解析的2-呋喃甲酸代谢途径发现,有氧条件下HMF和糠醛在CupriavidusHMF14中的代谢途径,如图 2,并在基因水平上表征了该代谢途径。HMF首先氧化为5-羟甲基糠酸,然后在FAD依赖性氧化酶HMFO的作用下进一步氧化为FDCA,FDCA脱羧氧化为2-呋喃甲酸,进入糠醛代谢途径,最后氧化生成 α-酮戊二酸进入三羧酸循环。糠醛和HMF共用一条代谢途径,而2-呋喃甲酸成为糠醛和HMF的交汇点。
Ran等[26]以HMF和糠醛为唯一碳源,研究Amorphotheca resinae ZN1在不同氧气水平下的代谢,更加完整的解释了Koopman等的代谢途径。有氧条件下,HMF和糠醛首先分别转化为相应的醇而后在醇脱氢酶或醛还原酶的作用下氧化为醛,然后连续氧化生成酸,进入糠醛代谢途径,氧化生成 α-酮戊二酸进入三羧酸循环。而在无氧条件下,HMF和糠醛分别降解为相应的醇而不能生成羧酸;因此充足的氧气条件成为HMF和糠醛完全代谢的先决条件。
Koopman等[22]在P.putida S12中功能性的表达了CupriavidusHMF14中糠醛和HMF的代谢途径,该代谢途径在理论上可以用于不同的宿主。这为多种微生物代谢有毒糠醛抑制因子提供了理论依据,同时为进一步提高木质纤维素的水解效率奠定了基础。但是,该路线中某些酶的特定性质限制了该路线的应用,如hmfABC编码的呋喃甲酰 - 辅酶A脱氢酶需要一个特定的钼喋呤辅因子,这限制了具有不同钼喋呤合成路线的宿主对呋喃醛代谢途径的应用,尤其是对工业应用最广泛的酵母菌,其不能合成钼喋呤。另外,依赖氧气的HMF氧化还原酶只能用于有氧过程,而大多数的工业发酵是在微氧环境下进行的[27]。
3 HMF的生物催化氧化 3.1 HMF的全细胞催化氧化随着绿色化学概念的提出,HMF生物催化氧化制备大宗化学品日益引起人们的关注。HMF的生物催化氧化主要有全细胞催化和分离酶胞外催化氧化两种。Koopman和Wierckx等[28]利用氧化还原酶仅限用于有氧条件的特点,将C.basilensis 氧化还原酶在溶剂耐受性菌株P.putida S12中表达,利用全细胞催化氧化HMF,能得到30 g/L的FDCA,其FDCA收率能达到97%,而HMF的转化率接近于100%,但反应时间长达144 h。该过程虽有效的避免了胞外酶更易受到HMF及产物H2O2破坏而失活的问题;且内源性酶能歧化生成H2O2,同时内源性醛脱氢酶能于HmfH协同氧化HMF,从而提高反应整体的催化效率。但是全细胞催化也存在一些问题,整个过程需要持续的碳源,同时生成的FDCA不易分离,不利于下游氧化产物的回收。而胞外酶氧化能够作用于更高的底物浓度,产物回收率高,且耗水量低,因此,在HMF氧化酶基因信息清晰的情况下,通过构建工程菌胞外表达HMF氧化酶,胞外催化氧化HMF制备下游大宗化学品日益成为大家研究的重点。
3.2 酶法催化HMF氧化制备FDCAHMF生物氧化的下游产物众多。其中,FDCA因具有替代石油基大宗化学品对苯二甲酸的潜力,而成为HMF生物催化氧化的研究重点。
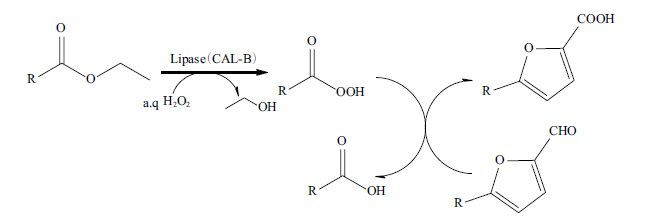
2013年,Krystof等[29]提出了使用过氧酸原位氧化HMF的概念。由于过氧酸氧化性强,不易储存和运输,因此其利用Baeyer-Villiger反应原理,使用脂肪酯提供酰基,与过氧化氢在脂肪酶的催化下反应生成过氧酸(图 3),氧化HMF,然而生成的过氧酸优先氧化醛基,而不是羟甲基。为了完全氧化HMF的醛基和羟甲基,研究人员使用一锅两步法,首先使用TEMPO氧化HMF生成DFF中间体,然后利用过氧酸将DFF氧化成FDCA,过氧酸能完全氧化DFF(50 mmol/L)生成FDCA,其FDCA产率能达到83%。该过程较好的实现了化学催化反应和酶催化反应的溶剂体系的兼容性。当采用纯有机相反应时,DFF完全转化为FDCA(48%)和FFCA(52%),这也为选择性氧化制备FFCA提供一种技术。
|
| 图 3 脂肪酶催化过氧酸生成及其酶催化氧化呋喃衍生物 |
Dijkman等[30]从甲基菌属菌株MP688(Methy-lovorus sp. Strain MP688)中发现了一种黄素腺嘌呤二核苷酸(FAD)依赖性氧化酶,这是报道的第一个对HMF有活性的氧化酶。在FAD存在下,HMF能高选择性转化生成FDCA(95%)而HMF的转化率能达到100%,同时剩余的HMFO仍具有较强的活性[31]。该反应一步氧化,操作简单,使用缓冲液代替有机溶剂,更环保,但是底物浓度较低( 2-4 mmol/L),且需要FAD辅助因子参与,过程成本较高。HMFO仅氧化初级醇,初级硫醇,能氧化醛的水合偕二醇形式而不能氧化醛本身,而中间产物FFCA的水合程度低,使得整个反应所需时间较长。Dijkman等[32]进一步研究了HMFO的晶体结构和三维结构,突变HMFO的位点(V367和W466),使得HMFO对FFCA的催化效率提高了4 400倍,从而提高了FDCA的产率,同时突变的酶能够对映选择性转化二级醇,从而拓宽了HMFO的底物范围。
2015年,Carro等[33]使用两个胞外真菌酶,芳香醇氧化酶(aryl-alcohol oxidase,AAO)和非特异性环化酶(unspecific peroxygenase oxidase,UPO),首次实现了双酶串联催化氧化HMF制备FDCA,其中AAO的氧化性质类似于HMFO,能氧化初级醇和水合醛,而不能氧化醛基。AAO在缓冲液体系中,以氧气为氧化剂,4 h内几乎完全氧化HMF为FFCA(98%)和FDCA,生成H2O2。而UPO利用AAO氧化HMF生成的H2O2可以氧化FFCA转化为FDCA(91%)而仅有9%的FFCA剩余。AAO与UPO串联氧化HMF到FDCA,只消耗氧气,生成水,过程更加绿色;但是AAO同HMFO性质类似,氧化醛的水合偕二醇形式,而不氧化醛基本身,另外UPO氧化FFCA的反应速度太慢,长达120 h,从而降低了整体反应效率。
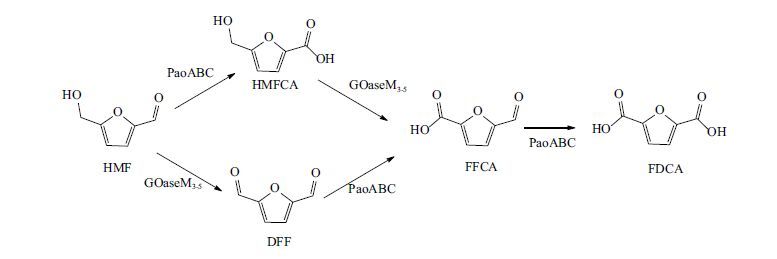
2015年,Qin等[34]改进了Krystof实验,其利用半乳糖氧化酶(galactose oxidase,GO)取代TEMPO和脂肪酶串联氧化HMF。GO协同过氧化氢酶和辣根过氧化物酶氧化HMF生成DFF,其最高产率为91%。生成的DFF及剩余的HMF浓缩,利用乙酸乙酯萃取后用脂肪酶氧化最后生成FDCA。该一锅两步氧化反应终产物FDCA产率可达88%,略高于Krystof反应中FDCA的产率(82%),但是反应时间长。Mckenna等[35]在前面研究的基础上,取得更好的结果,采用半乳糖氧化酶变体(galactose oxidase M3-5,GOaseM3-5)和醛氧化酶(aldehyde oxidase,PaoABC)第一次实现了双酶协同一锅法氧化HMF制备FDCA。GOaseM3-5和PaoABC协同一锅法氧化HMF,以PH7.6的磷酸盐缓冲液为反应介质,空气氧为氧化剂,37 ℃ 反应1 h,产物FDCA产率达到97%。但是GOaseM3-5对HMFCA的氧化能力较弱,因此一锅法局限于较低的底物浓度范围。另外,作者在相同条件下将两酶串联可以完全氧化HMF(图 4),最高的底物浓度可达到100 mmol/L,是迄今报道过的最高底物浓度,较之前报道的酶HMFO( 2-4 mmol/L)和AAO(3 mmol/L)高5 0-1 00倍,是一个绿色可持续可发展的化学催化方法。与AAO、UPO和HMFO相比,PaoABC对醛基本身有活性,而不是氧化水合醛,从而缩短了反应时间,8 h内能将HMF(50 mmol/L)完全转化,产物FDCA产率大于99%。
|
| 图 4 GOaseM3-5和PaoABC协同氧化HMF |
HMF下游大宗化学品除了FDCA外,DFF、HMFA和FFCA等也具有广泛应用,研究人员在酶法转化HMF制备这些化合物方面也取得了较好研究成果。
早在1997年,van Deurzen等[36]首次将 胞外酶用于HMF氧化。从卡尔黑霉烟煤菌(Cladariomyces fumago)中分离得到氯化物过氧化物酶,以H2O2为氧化剂,催化氧化HMF生成DFF。在控制H2O2的条件下,主要生成DFF(60% - 74%),以及副产物HMFCA(25% - 40%)。该反应中HMF氧化不完全,最高转化率为87%,且氯化物过氧化物酶的催化过程中生成氧络铁离子卟啉中间体,竞争性地从HMF的羟基和醛基上提取氢,从而导致产物不唯一,因此氯化物过氧化物酶不适合用于HMF氧化生成单一物质。
Krystof等[29]利用TEMPO和脂肪酶串联氧化制备FDCA,发现当TEMPO反应液中有机相直接用过氧酸氧化则DFF完全转化为FDCA(48%)和HMFCA(52%),优化该法也可以分离制备HMFCA。但是该法收率低,利用有机试剂,反应时间长。
2015年Qin等[34]采用了多种生物酶、黄嘌呤氧化酶(xanthine oxidase,XO)、漆酶(laccase),半乳糖氧化酶(galactose oxidase,GO)和醇氧化酶(alcohol oxidase,AO)研究了HMF向下游化学品的选择性氧化,从而高选择性的生成HMFCA,DFF和FFCA和FDCA(图 5)。在XO酶催化作用下,以磷酸盐缓冲液为反应介质,O2 为氧化剂,仅反应7 h后,产物HMFCA的产率能达到了 94%。另外,该文中筛选了3种漆酶:变色栓菌漆酶(Trametes versicolor laccase)、贝壳状革耳菌漆酶(Panus conchatus laccase)和金针菇漆酶(Flammulina velutipes laccase),协同TEMPO 氧化HMF生成FFCA、DFF和FDCA,其中FFCA为主要产物。以贝壳状革耳菌漆酶为催化剂时产率最高,为88%。而在去离子水中,GO能选择性制备DFF,产率达91%。与Krystof的结果相比,该研究的过程采用氧气,成本更低;不使用有机溶剂,更环保。此外,选择性更高,反应时间也更短。
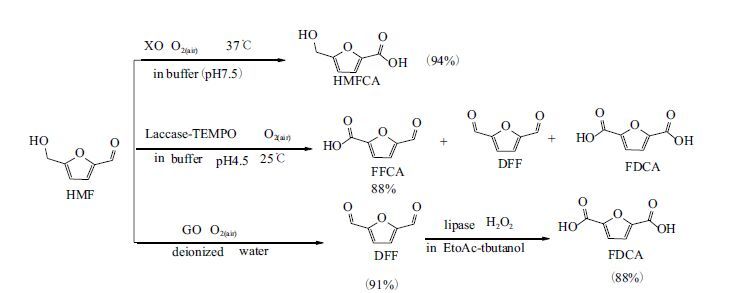
|
| 图 5 不同酶作用下HMF的生物氧化 |
迄今,HMF在微生物细胞内的代谢途径或使用胞外酶氧化转化两方面的研究均已取得了很大的进步。微生物细胞内降解HMF,探究了其在CupriavidusHMF14和Amorphotheca resinae ZN1中的代谢途径,为进一步探究其在其他菌体内的代谢途径提供了依据,并为基因改造提高5-羟甲基糠醛利用率奠定了基础。胞外酶催化氧化HMF制备下游呋喃大宗化学品也都有较好的产率,但都存在底物浓度不够高、单一酶不能完成羟甲基和醛基的完全氧化,以及转化时间长等问题,导致利用胞外酶氧化的工艺路线仅限于实验室研究。因此,在以后的研究中,需要进一步筛选代谢转化HMF能力更强的菌株;研究HMF氧化酶的的高效表达技术,实现酶的高活性大量表达;研究酶的立体结构,明确结合和催化位点等信息;针对下游目标产物,主要包括DFF、HMFCA、FFCA和FDCA,开展HMF氧化酶的突变技术,实现对不同目标产物的高效选择性转化。当然,目标产物除了上述的四种呋喃化合物外,未来的研究也可筛选氧化HMF制备其他化学品的菌株,如MA等,也会取得更有应用价值的成果。另外,为解决酶的重复利用问题,以后的研究需加大相关酶的固定化和固定化酶催化HMF氧化制备下游产品的的工艺研究,降低酶的使用成本,为酶法催化氧化HMF制备大宗化学品工业化奠定基础。
| [1] | Rosatella AA, Simeonov SP, Frade RFM, et al. 5-Hydroxymethylfur-fural(HMF)as a building block platform:Biological properties, synthesis and synthetic applications. Green Chemistry , 2011, 13 : 754–793. DOI:10.1039/c0gc00401d |
| [2] | Lilga MA, Hallen RT, Gray M. Production of Oxidized Derivatives of 5-Hydroxymethylfurfural(HMF). Topics in Catalysis , 2010, 53 : 1264–1269. DOI:10.1007/s11244-010-9579-4 |
| [3] | Du Z, Ma J, Wang F, et al. Oxidation of 5-hydroxymethylfurfural to maleic anhydride with molecular oxygen. Green Chemistry , 2011, 13 : 554–557. DOI:10.1039/c0gc00837k |
| [4] | Gandini A, Silvestre AJD, Neto CP, et al. The furan counterpart of poly(ethylene terephthalate):An alternative material based on renewable resources. Journal of Polymer Science Part A:Polymer Chemistry , 2009, 47 : 295–298. DOI:10.1002/pola.v47:1 |
| [5] | Werpy T, Petersen G. Top value added chemicals from biomass:volume I—results of Screening for potential candidates from sugars and synthesis gas[R]. US:Produced by the Staff at Pacific Northwest National Laboratory(PNNL)National Renewable Energy Laboratory(NREL)Office of Biomass Program(EERE)For the Office of the Biomass Program, 2004. http://cn.bing.com/academic/profile?id=1550965069&encoded=0&v=paper_preview&mkt=zh-cn |
| [6] | Jong Ed, Higson A, Walsh P, et al. Bio-based Chemicals Value Added Products from Biorefinerie[R]. 2012. |
| [7] | Hopkins KT, Wilson WD, Bender BC, et al. Extended aromatic furan amidino derivatives as anti-pneumocystis carinii agents. Medicinal Chemistry , 1998, 41 : 3872–3878. DOI:10.1021/jm980230c |
| [8] | Ma J, Du Z, Xu J, et al. Efficient aerobic oxidation of 5-hydroxymethylfurfural to 2, 5-diformylfuran, and synthesis of a fluorescent material. Chemistry and Sustainable Chemistry , 2011, 4 : 51–54. DOI:10.1002/cssc.v4.1 |
| [9] | Hirai H. Oligomers from hydroxymethylfurancarboxylic acid. Journal of Macromolecular Science:Part A - Chemistry , 2006, 21 : 1165–1179. |
| [10] | Braisted AC, Oslob JD, Delano WL, et al. Discovery of a potent small molecule IL-2 inhibitor through fragment assembly. Journal of American Chemical Society , 2013, 125 : 3714–3715. |
| [11] | Nie J, Xie J, Liu H. Efficient aerobic oxidation of 5-hydroxymethylfurfural to 2, 5-diformylfuran on supported Ru catalysts. Journal of Catalysis , 2013, 301 : 83–91. DOI:10.1016/j.jcat.2013.01.007 |
| [12] | Amarasekara AS, Green D, McMillan E. Efficient oxidation of 5-hydroxymethylfurfural to 2, 5-diformylfuran using Mn(Ⅲ)-salen catalysts. Catalysis Communications , 2008, 9 : 286–288. DOI:10.1016/j.catcom.2007.06.021 |
| [13] | Halliday GA, Young RJ Jr, Grushin VV. One-pot, two-step, practical catalytic synthesis of 2, 5-diformylfuran from fructose. Organic Letters , 2003, 5 (11) : 2003–2005. DOI:10.1021/ol034572a |
| [14] | Siankevich S, Savoglidis G, Fei Z, et al. A novel platinum nanocatalyst for the oxidation of 5-Hydroxymethylfurfural into 2, 5-furandicarboxylic acid under mild conditions. Journal of Catalysis , 2014, 315 : 67–74. DOI:10.1016/j.jcat.2014.04.011 |
| [15] | Gorbanev YY, Klitgaard SK, Woodley JM, et al. Gold-catalyzed aerobic oxidation of 5-hydroxymethylfurfural in water at ambient temperature. Chemistry and Sustainable Chemistry , 2009, 2 : 672–675. DOI:10.1002/cssc.v2:7 |
| [16] | Zhang Z, Zhen J, Liu B, et al. Selective aerobic oxidation of the biomass-derived precursor 5-hydroxymethylfurfural to 2, 5-furandicarboxylic acid under mild conditions over a magnetic palladium nanocatalyst. Green Chemistry , 2015, 17 : 1308–1317. DOI:10.1039/C4GC01833H |
| [17] | Liu ZL, Slininger PJ, Dien BS, et al. Adaptive response of yeasts to furfural and 5-hydroxymethylfurfural and new chemical evidence for HMF conversion to 2, 5-bis-hydroxymethylfuran. Journal of Industrial Microbiology and Biotechnology , 2004, 31 : 345–352. DOI:10.1007/s10295-004-0148-3 |
| [18] | Palmqvist E, Hahn-H?gerdal B. Fermentation of lignocellulosic hydrolysates. I:inhibition and detoxification. Bioresource Technology , 1999(2000), 74 : 17–24. |
| [19] | Lopez MJ, Nichols NN, Dien BS, et al. Isolation of microorganisms for biological detoxification of lignocellulosic hydrolysates. Applied Microbiology and Biotechnology , 2004, 64 : 125–131. DOI:10.1007/s00253-003-1401-9 |
| [20] | Zhang J, Zhu Z, Wang X, et al. Biodetoxification of toxins generated from lignocellulose pretreatment using a newly isolated fungus, Amorphotheca resinae ZN1, and the consequent ethanol fermentation. Biotechnolology for Biofuels , 2010, 3 : 26. DOI:10.1186/1754-6834-3-26 |
| [21] | Wierckx N, Koopman F, Bandounas L, et al. Isolation and characterization of Cupriavidus basilensis HMF14 for biological removal of inhibitors from lignocellulosic hydrolysate. Microbial Biotechnology , 2010, 3 : 336–343. DOI:10.1111/mbt.2010.3.issue-3 |
| [22] | Koopman F, Wierckx N, de Winde JH, et al. Identification and characterization of the furfural and 5-(hydroxymethyl)furfural degradation pathways of Cupriavidus basilensis HMF14. Proceedings of the National Academy of Sciences of the United States of America , 2010, 107 : 4919–4924. DOI:10.1073/pnas.0913039107 |
| [23] | Feldman D, Kowbel DJ, Glass NL, et al. Detoxification of 5-hydroxymethylfurfural by the Pleurotus ostreatus lignolytic enzymes aryl alcohol oxidase and dehydrogenase. Biotechnology for Biofuels , 2015, 8 : 63. DOI:10.1186/s13068-015-0244-9 |
| [24] | Jimenez DJ, Korenblum E, van Elsas JD. Novel multispecies microbial consortia involved in lignocellulose and 5-hydroxymethylfurfural bioconversion. Applied Microbiology and Biotechnology , 2014, 98 : 2789–2803. DOI:10.1007/s00253-013-5253-7 |
| [25] | Trudgill PW. The metabolism of 2-furoic acid by pseudomonas F2. Biochemistry , 1969, 113 : 577–587. DOI:10.1042/bj1130577 |
| [26] | Ran H, Zhang J, Gao Q, et al. Analysis of biodegradation performance of furfural and 5-hydroxymethylfurfural by Amorphotheca resinae ZN1. Biotechnology for Biofuels , 2014, 7 : 51. DOI:10.1186/1754-6834-7-51 |
| [27] | Wierckx N, Koopman F, Ruijssenaars HJ, et al. Microbial degradation of furanic compounds:biochemistry, genetics, and impact. Applied Microbiology and Biotechnology , 2011, 92 : 1095–1105. DOI:10.1007/s00253-011-3632-5 |
| [28] | Koopman F, Wierckx N, de Winde JH, et al. Efficient whole-cell biotransformation of 5-(hydroxymethyl)furfural into FDCA, 2, 5-furandicarboxylic acid. Bioresour Technology , 2010, 101 : 6291–6296. DOI:10.1016/j.biortech.2010.03.050 |
| [29] | Krystof M, Perez-Sanchez M, Dominguez de Maria P. Lipase-media-ted selective oxidation of furfural and 5-hydroxymethylfurfural. Chemistry and Sustainable Chemistry , 2013, 6 : 826–830. DOI:10.1002/cssc.v6.5 |
| [30] | Dijkman WP, Fraaije MW. Discovery and Characterization of a 5-hydroxymethylfurfural oxidase from methylovorussp. strain MP688. Applied and Environmental Microbiology , 2014, 80 (1082) : 1090. |
| [31] | Dijkman WP, Groothuis DE, Fraaije MW. Enzyme-catalyzed oxidation of 5-hydroxymethylfurfural to furan-2, 5-dicarboxylic acid. Angewandte Chemie International Edition , 2014, 53 : 6515–6518. DOI:10.1002/anie.201402904 |
| [32] | Dijkman WP, Binda C, Fraaije MW, et al. Structure-based enzyme tailoring of 5-hydroxymethylfurfural oxidase. ACS Catalysis , 2015, 5 : 1833–1839. DOI:10.1021/acscatal.5b00031 |
| [33] | Carro J, Ferreira P, Rodriguez L, et al. 5-hydroxymethylfurfural conversion by fungal aryl-alcohol oxidase and unspecific peroxygenase. FEBS Journal , 2015, 282 (16) : 3218–3229. DOI:10.1111/febs.13177 |
| [34] | Qin YZ, Li YM, Zong MH, et al. Enzyme-catalyzed selective oxidation of 5-hydroxymethylfurfural(HMF)and separation of HMF and 2, 5-diformylfuran using deep eutectic solvents. Green Chemistry , 2015, 17 : 3718–3722. DOI:10.1039/C5GC00788G |
| [35] | McKenna SM, Leimkühler S, Herter S, et al. Enzyme cascade reactions:synthesis of furandicarboxylic acid(FDCA)and carboxylic acids using oxidases in tandem. Green Chemistry , 2015, 17 : 3271–3275. DOI:10.1039/C5GC00707K |
| [36] | van Deurzen MPJ, van Rantwijk F, Sheldon RA. Chloroperoxidase-Catalyzed Oxidation of 5-Hydroxymethylfurfural. Journal of Carbohydrate Chemistry , 1997, 16 : 299–309. DOI:10.1080/07328309708006531 |