1897年,德国化学家毕希纳在细胞研磨破液中发现一种发酵液,功能类似于活体酵母[1],这项实验开启无细胞体外代谢领域的研究。无细胞体外代谢是利用生物催化剂酶在活体细胞体外进行催化反应[2, 3]。早期研究利用未处理过的细胞抽提物直接进行催化,但其成分复杂,不能持续大量的生成所需产物。随的生物体内酶的分离和研究,利用基因和酶的相关技术可以获得大量的酶。Welch等[4]用纯化过的重组酶在体外组装了一条酵母糖酵解途径,在体外能持续较长时间代谢葡萄糖生成酒精。合成生物学的兴起更加推动这项技术的发展,相比于早期的研究内容,现阶段更注重理性组装各种代谢途径或者系统,生产更多有价值的化学物、燃料、药品及生物基材料等[5]。
在体外构建代谢途径合成目标产物这种方法相比于传统的生物发酵法有着相当大的优势。传统发酵法通常采用基因重组技术优化菌内代谢途径来提高目的产量,往往会使菌株失去天然代谢的调控机制,代谢通量失去平衡,对菌株生长造成不利。体外构建的代谢途径不受胞内转录调控等影响,只在酶分子水平上进行调节,简单方便,避免发酵过程中复杂的控制条件操作。没有细胞膜的运输阻碍,减少底物进入代谢途径的限速步骤,加快反应速度[6]。同时底物直入目标代谢途径,没有支路分流影响,增加产率。体外代谢途径的反应体系中没有培养基等杂质,简化后期分离纯化步骤,降低工业生产成本[7]。
构建一条体外代谢途径途径不是简单地将胞内的途径复制到胞外,失去胞内能量和辅酶复杂的供给系统,体外的反应中的能量和辅酶会很快消耗殆尽,则需要源源不断的补充添加,成本太高,因此建立能量循环和辅酶循环系统很重要。Welch等[4]在代谢途径中额外添加了ATP酶,实现了ATP、ADP的循环利用。后来,Woodward等[8]在体外生物产氢的实验中,偶联NADPH脱氢酶实现辅酶的循环利用。Ye等[9]用NAD+依赖的非磷酸化的3-磷酸甘油醛脱氢酶(non-phosphorylating glyceraldehyde-3-phosphate dehydrogenase,GAPN)和NADH依赖的苹果酸/乳酸脱氢酶(malate/lactate dehydrogenase,MLDH)嵌合在体外反应途径里,无需额外添加酶,巧妙地实现能量和辅酶的循环。
乳酸材料绿色环保价值高,广泛运用在食品、医药、化工等领域[10, 11]。本实验以乳酸为目标产物,设计一条能实现ATP、ADP的循环和辅酶NADP+、NADPH供给平衡的无细胞体外合成代谢途径(图 1)。用Streptococcus thermophilus CNRZ1006中的非磷酸化的3-磷酸甘油醛脱氢酶(GAPN)[12]代替传统糖酵解途径中的甘油醛3-磷酸脱氢酶(GAPDH)和磷酸甘油酸激酶(PGK),直接催化3-磷酸甘油醛生成3-磷酸甘油酸。其他的酶选自Thermus thermophilus HB8中催化专一强、稳定性好的嗜热酶[13]作催化模块。本研究用分子生物学方法构建表达载体,在大肠杆菌表达系统中诱导表达,经加热处理得到纯化的酶液,把这些酶在体外组装成一条合成代谢乳酸的途径,并对该途径的性质进行研究。

|
| 图 1 体外合成乳酸流程图 GK:葡萄糖脱氢酶;G6P:葡萄糖-6-磷酸;PGI:葡萄糖-6-磷酸异构酶;F6P:果糖-6-磷酸;PFK:磷酸果糖激酶;FBP:1,6-二磷酸果糖;FBA:果糖二磷酸醛缩酶;DHAP:磷酸二羟丙酮;TIM:磷酸丙糖异构酶;GAP:3磷酸甘油醛;GAPN:非磷酸化的3-磷酸甘油醛脱氢酶;3-PG:3-磷酸甘油酸;2-PG:2-磷酸甘油酸;ENO:磷酸丙酮酸水合酶;PEP:磷酸烯醇式丙酮酸;PK:丙酮酸激酶;LDH:乳酸脱氢酶 |
T. thermophilus HB8购自德国生物材料资源中心,编号DSMZ579。Streptococcus thermophilus CNRZ1006、大肠杆菌菌株Escherichia coli DH5α、BL21(DE3)以及质粒pET-22b、pET-28a均来自于本实验室。
1.1.2 酶和试剂实验中的引物由南京金斯瑞公司合成;DNA限制性内切酶、T4 DNA连接酶、LA Taq DNA聚合酶、2000、15000DNA Marker购自于宝生物工程(大连)有限公司;细菌基因组提取试剂盒、质粒抽提试剂盒、PCR产物纯化试剂盒、胶回收试剂盒购买于Biomiga公司;抗生素及其余试剂购自于生工生物工程(上海)股份有限公司。
1.1.3 培养基和培养条件DSM74培养基:蛋白胨8 g/L,酵母粉4 g/L,NaCl 2 g/L。T. thermophilus HB8于75℃,200 r/min高温摇床中培养24 h。ST培养基:胰蛋白胨5 g/L,酵母粉10 g/L,葡萄糖10 g/L,大豆蛋白胨5 g/L,吐温80 1 mL/L,盐溶液40 mL,半胱氨酸盐酸盐0.5 g/L,调节pH至6.8-7.0。盐溶液:K2HPO4 1 g/L,KH2PO41 g/L,NaHCO310 g/L,NaCl 2 g/L,CaCl2 0.2 g/L,MgSO4·7H2O 0.48 g/L。Streptococcus thermophilus CNRZ1006于42℃恒温箱厌氧培养24 h。大肠杆菌基本培养基(LB培养基):蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L。E.coli DH5α、Rosetta、BL21(DE3)于37℃培养8 h。大肠杆菌发酵培养基(TB培养基):蛋白胨15 g/L,酵母粉25 g/L,NaCl10 g/L,葡萄糖2 g/L,乳糖3 g/L。于37℃培养3 h后转30℃培养15 h。
1.2 方法 1.2.1 表达载体的构建在BioCyc Database Collec-tion上检索gk、pgi、pfk、fba、tim、gapn、ipgm、pk、eno、ldh的基因序列,并设计引物[14](表 1)。
用细菌基因组提取试剂盒提取T. thermophilus HB8和 Streptococcus thermophilus CNRZ1006的基因组作为模板,通过PCR扩增目的基因。反应体系:基因组DNA 1 μL,2.5 mmol/L dNTP 8 μL,LA Taq DNA聚合酶0.5 μL,2×GC buffer with Mg2+25 μL,上游引物1 μL,下游引物1 μL,加ddH2O至总体积为50 μL。反应条件:95℃预变性5 min,95℃变性2 min,退火(温度参照计算得到的Tm值)1 min,72℃延伸5 min,循环30次,72℃再延伸5 min。根据Biomiga公司的 PCR产物纯化试剂盒操作手册纯化目的基因片段。根据设计的限制性酶切位点,酶切基因片段和质粒,根据胶回收试剂盒操作手册的回收到基因片段和质粒片段,用T4 DNA 连接酶将基因片段和质粒片段连接,连接体系:质粒片段3 μL,基因片段1 μL,T4 DNA 连接酶1 μL,10×连接液缓冲1 μL,加ddH2O至总体积为10 μL。16℃过夜连接。取5 μL连接液用42℃热休克方法转入E.coli BL21(DE3)感受态细胞中。用带有100 μg/mL氨苄青霉素的LB培养基和带有30 μg/mL卡那霉素的LB培养基来筛选,挑选阳性克隆送至南京金斯瑞公司测序。
1.2.2 重组质粒在大肠杆菌中的表达和SDS-PAGE电泳挑选带有正确基因序列重组质粒的大肠杆菌单菌落,接到含有抗生素的LB培养基中,37℃,200 r/min,培养12 h。按1%的接种扩大培养2 h左右,OD600值达到0.6,加IPTG至终浓度为0.8 mmol/L,培养6 h。SDS-PAGE按参考文献[15]配置,分离胶浓度12%,浓缩胶5%。粗酶液加入2×loading Buffer,95℃煮5 min后,上样10 μL,进行电泳,分析重组蛋白的表达情况。蛋白质定量采用常规的Bradford法[16]。
1.2.3 细胞抽提物的获得和处理将菌液8 000 r/min,4℃冷冻离心10 min,用50 mmol/L HEPES-NaOH缓冲(pH7.0)洗菌两遍,重悬后用高压均质机(ATS 加拿大)破碎细胞。细胞破碎液8 000 r/min、4℃冷冻离心30 min,取上清。因为嗜热栖热菌是耐热菌,在高温下有较好的稳定性,所以除了GAPN的其他9个粗酶液均用加热的方法来处理,70℃水浴30 min,12 000 r/min,4℃冷冻离心20 min。留取上清冻干保存。GAPN来自Streptococcus thermophilus CNRZ1006,培养温度和大肠杆菌比较接近,用硫酸铵分级沉淀的方法处理粗酶液。用30%浓度的硫酸铵沉淀初步除杂,再用60%浓度的硫酸铵将目标蛋白沉淀下来,用50 mmol/L HEPES-NaOH缓冲(pH7.0)将沉淀蛋白复溶后使用。
1.2.4 体外合成乳酸体系的构建每一个酶是体外合成乳酸途径中的催化模块,根据设计好的体外合成途径,将各个模块组建在一起。该反应体系中还含有50 mmol/L HEPES-NaOH缓冲(pH7.0),0.2 mmol/L ATP、0.2 mmol/L ADP、0.2 mmol/L NADP+、10 mmol/L Mg2+、2 mmol/L Mn2+、50 mmol/L葡萄糖。反应在50℃下进行,每隔1 h取样,样品置95℃水浴锅处理10 min,终止反应。样品中的葡糖糖浓度用生物传感仪SBA-40E测量,乳酸用高效液相色谱检测。
1.2.5 色谱条件色谱柱:Sepax HP-C18(4.6 mm×250.0 mm,5 μm);流动相:乙腈-磷酸二氢钾(体积比),用磷酸调pH值为2.9;流速为1.0 mL/min;检测波长210 nm;柱温为30℃,进样量15 μL。
1.2.6 反应体系条件优化模拟细胞体内代谢途径,合理设计体外合成乳酸系统。该系统中的酶单元模块来源于不同的菌种,设计不同的温度梯度,用上述方法测定葡萄糖的消耗量以及乳酸的生成量,确定该体系反应的最佳温度。此外,还有pH值,辅酶NADP+浓度,Mg2+浓度,Mn2+浓度,葡萄糖浓度对反应体系的影响,找到最适反应条件,提高乳酸的产率。
酶活定义:1个U为每分钟转化1 μmol葡萄糖所需要的酶总量。
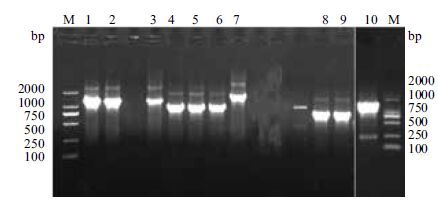
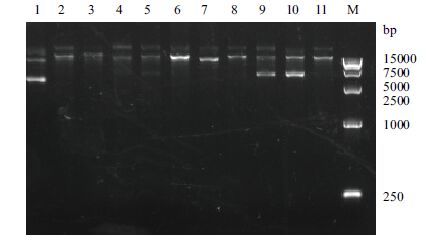
2 结果 2.1 表达载体的构建以T. thermophilus HB8基因组为模板,根据设计的引物,用PCR法扩增得到片段gk、pgi、pfk、fba、tim、gapn、ipgm、pk、eno、ldh,在相应的位置有特异性条带与数据库中登载的基因大小一致(图 2)。将扩增的目的基因连接在质粒pET-22b或上pET-28a(除了gapn连接在pET-28a上,其他基因都连接在pET-22b上),转入大肠杆菌菌株E.coli BL21(DE3)感受态细胞中,双挑提取表达质粒(图 3)进行PCR验证,将验证正确的质粒进行测序,测序结果与基因库中登载的基因进行比较,选取基因序列相同的重组菌株进行后续实验。
|
| 图 2 目的基因的PCR扩增 M:DNA marker;1:pgi 基因;2:gapn基因;3:eno基因;4:gk基因;5:pfk基因;6:fba基因;7:pk基因;8:tim基因;9:ldh基因;10:ipgm基因 |
|
| 图 3 构建好的质粒 1:pET-22b;2:pET-22b-GK;3:pET-22b-PGI;4:pET-22b-PFK;5:pET-22b-FBA;6:pET-22b-TIM;7:pET-22b-GAPN;8:pET-22b-iPGM;9:pET-22b-ENO;10:pET-22b-PK;11:pET-22b-LDH;M:DNA marker |
将测序正确的质粒转入E.coli BL21(DE3),重组菌经诱导表达目标蛋白,蛋白样品处理后进行蛋白电泳分析。由SDS-PAGE结果(图 4) 可以看出,各个重组质粒在的E.coli BL21(DE3)里,通过乳糖的诱导,有一定量的外源蛋白在胞内表达,和泳道11的空对照相比,泳道1-10中能明显的看出有特异性蛋白表达,分别是GK、PGI、PFK、FBA、TIM、GAPN、iPGM、ENO、PK、LDH,大小与已报道的一致,说明构建的10个质粒在宿主中成功表达。

|
| 图 4 重组大肠杆菌破碎液上清SDS-PAGE电泳图 M:protein marker;1:重组菌BL21-pET-22b-GK破碎液上清;2:重组菌BL21-pET-22b-PGI破碎液上清;3:重组菌BL21-pET-22b-PFK破碎液上清;4:重组菌BL21-pET-22b-FBA破碎液上清;5:重组菌BL21-pET-22b-TIM破碎液上清;6:重组菌BL21-pET-22b-GAPN破碎液上清;7:重组菌BL21-pET-22b-iPGM破碎液上清;8:重组菌BL21-pET-22b-ENO破碎液上清;9:重组菌BL21-pET-22b-PK破碎液上清;10:重组菌BL21-pET-22b-LDH破碎液上清;11:重组菌BL21-pET-22b破碎液上清 |
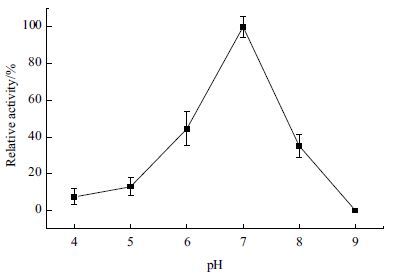
在体外合成的环境中,pH会受到中间产物和终产物影响,随着底物葡糖糖逐级转化为乳酸,反应体系的pH值会不断下降,直接影响到部分酶的稳定性。实验结果(图 5)显示,在pH 7左右,反应体系总体酶活最大,催化葡萄糖转化生成乳酸的速度最快。pH值在6以下,8以上的时候,反应体系总体的酶活相对最高的酶活性降低至50%以下。因此应该将反应体系的pH值控制在7左右。
|
| 图 5 体外合成乳酸途径的最适pH |
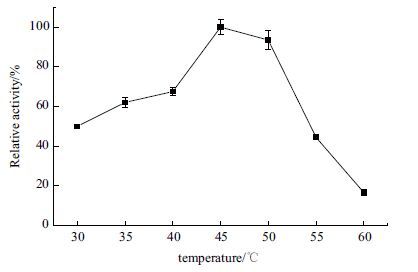
设计温度范围30-60℃,测量不同温度下反应体系总体酶活。实验结果(图 6)显示,在45-50℃时,反应体系总体的酶活最大;温度到60℃时,反应体系的总体酶活迅速下降,推断是GAPN在高温下迅速失活。图 7中,GAPN在不同温度下温浴20 min,测酶的活性。在55℃时,GAPN的酶活就下降到75%以下。所以GAPN的高温稳定性比较差。
|
| 图 6 体外合成乳酸途径的最适温度 |

|
| 图 7 温度对GAPN酶活的影响 |
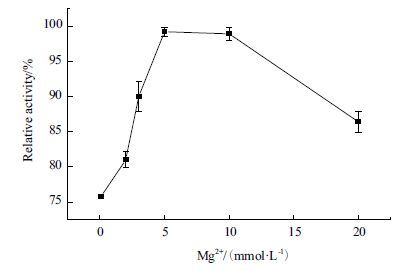
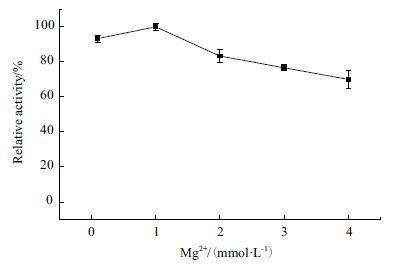
设计Mg2+浓度分别为0.1、1、3、5、10 和20 mmol/L,Mn2+浓度0.1、1、2、3和4 mmol/L,观察不同浓度的金属离子对反应体系的影响。从图 8中可以看出,Mg2+浓度大于3 mmol/L时,该体系生成乳酸的速率差不多,但是Mg2+浓度过低会明显降低反应速率。图 9表明Mn2+浓度对反应体系有明显的影响,在Mn2+浓度为2 mmol/L时反应速度最快。低浓度和高浓度的Mn2+对反应体系有略微的抑制。
|
| 图 8 Mg2+浓度对反应体系的影响 |
|
| 图 9 Mn2+浓度对反应体系的影响 |
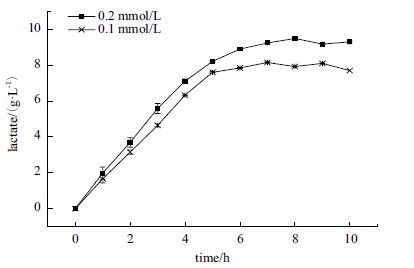
为获得该辅酶系统的最大转化能力,设计不同辅酶浓度,观察其对整个反应体系的影响。图 10中明显可以看出NADP+初始浓度高的比低的反应快,并从5 h的转折点可以看出,初始浓度0.1 mmol/L体系已经停止生成乳酸,但初始浓度0.2 mmol/L体系的生成速率保持在原来的30%以上。适当提高反应体系中NADP+初始浓度有利于提高乳酸的产率。
|
| 图 10 NADP+浓度对体外合成乳酸体系的影响 |
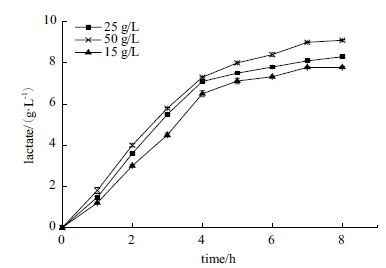
研究底物葡萄糖不同初始浓度对体外合成乳酸体系的影响,葡萄糖的初始浓度分比为15 g/L,25 g/L和50 g/L,从图 11中可以看出,高浓度的葡萄糖确实能加快反应的速率,最快反应速度2.2 g/(L·h)。
|
| 图 11 底物初始浓度对外合成乳酸体系的影响 |
利用无细胞体外合成技术构建的体外合成代谢途径主要为了避开代谢工程手段改造菌株发酵生产的弊端,省去对突变菌株代谢流量的复杂分析,较少优化发酵条件的繁琐步骤,降低工业生产的成本。本实验构建了一条体外合成乳酸的代谢途径。从T. thermophilus HB8和Streptococcus thermophilus CNRZ1006中选择合适的基因在E.coli BL21(DE3)中表达,经简单的加热纯化处理后组装成体外合成代谢途径。该途径不依赖于活体细胞内的转录水平的调节,仅从酶分子水平上就能预测各个酶对该途径的变构调节。
能量和辅酶的平衡是研究这个途径的关键。若将生产目标产物的体内代谢途径直接搬到体外,没有活体细胞内完善的能量和辅酶循环再生系统的帮助,则需要不断添加能量ATP和辅酶NADPH。本实验用来自Streptococcus thermophilus CNRZ1006的GAPN代替经典EMP途径中的GAPDH和PGK,修改了ATP和NADPH在代谢途径中的分配使用,实现该途径在体外ATP能量循环平衡和辅酶NADPH循环平衡,ATP的总转化数(TTN)为266。NADPH的再生系统已经广泛地运用于多种化合物的合成[17],相对电化学法和光化学法,酶法再生辅酶简单,清洁无污染,通常用糖类作为供氢体成本小。在本研究途径中嵌入的GAPN和LDH组成的NADPH再生系统无需再添加供氢体,利用代谢的中间产物参与辅酶再生循环。这种辅酶NADPH再生系统,以后也可以广泛的运用于手性合成,生物制药等方面。
本实验对体外合成乳酸的体系进行研究,最适合的pH值为7,与活体细胞体内反应环境相近。整个代谢途径中,除了GAPN以外,其他酶的来源都是T. thermophilus HB8,这个酶的温度耐受性相对较弱,因此选择一个合适的反应温度是整个反应体系的关键,该体系的最适温度为50℃。整个体系最长能维持8 h,其中的影响因素是多方面的,有待继续研究考量。现有的思路是寻找特异性更高、稳定性更好的标准化酶模块来替换现有的酶,或者使用人工仿生的辅酶NADP(H)提高辅酶的稳定性,还可以用固定化技术研究多酶的重复利用。
4 结论本实验构建一条简单的体外多酶合成乳酸的代谢途径,该途径在体外能实现自身的能量ATP循环平衡和辅酶NADPH循环平衡。ATP的总转换数为266。在50℃,pH值为7的条件下,持续生产8 h,乳酸产量达9.5 g/L。最快反应速率达2.2 g/L/h。
| [1] | Banuelos M, Gancedo C. In situ study of the glycolytic pathway in Saccharomyces cerevisiae. Arch Microbiol , 1978, 117 : 197–201. DOI:10.1007/BF00402308 |
| [2] | 许可, 吕波, 李春. 无细胞的合成生物技术—多酶催化与生物合成. 中国科学(化学) , 2015, 45 (5) : 429–437. |
| [3] | Fessner WD. Systems Biocatalysis: Development and engineering of cell-free“artificial metabolisms”for preparative multi-enzymatic synthesis. New Biotechnology , 2015, 32 (6) : 658–664. DOI:10.1016/j.nbt.2014.11.007 |
| [4] | Welch P, Scopes RK. Studies on cell-free metabolism: Ethanol production by a yeast glycolytic system reconstituted from purified enzymes. Journal of Biotechnology , 1985, 2 : 257–273. DOI:10.1016/0168-1656(85)90029-X |
| [5] | Peralta-Yahya P, Zhang FZ, del Cardaryre S, et al. Microbial engineering for the production of advanced biofuels. Nature , 2012, 488 (7411) : 320–328. DOI:10.1038/nature11478 |
| [6] | 孙继国, 韩增叶, 葛喜珍, 等. 基于重组大肠杆菌无细胞体系生产吡咯喹啉醌. 生物技术通报 , 2014 (4) : 164–168. |
| [7] | 李卫星, 邢卫红. 发酵法乳酸精制技术研究进展. 化工进展 , 2009, 3 : 491–495. |
| [8] | Woodward J, Orr M, Cordary K, et al. Biotechnology: enzymatic production of biohydrogen. Nature , 2000, 405 : 1014–1015. DOI:10.1038/35016633 |
| [9] | Ye XT, Honda K, Sakai T, et al. Synthetic metabolic engineering-a novel, simple technology for designing a chimeric metabolic pathway. Microbial Cell Factories , 2012, 11 : 120. DOI:10.1186/1475-2859-11-120 |
| [10] | 王立梅, 齐斌. L-乳酸应用及生产技术研究进展. 食品科学 , 2007, 10 : 608–612. |
| [11] | 翁云宣. 聚乳酸合成、生产、加工及应用研究综述. 塑料工业 , 2007, 6 (35) : 69–73. |
| [12] | Iddar A, Valverde F, Assobhei O, et al. Widespread occurrence of non-phosphorylating glyceraldehyde-3-phosphate dehydrogenase among gram-positive bacteria. International Microbiology , 2005, 8 (4) : 251–258. |
| [13] | Skander E, Christian S, Saskia B, et al. Exploration of extremop-hiles for high temperature biotechnological processes. In Environmental Microbiology Extremophiles, Current Opinion in Microbiology , 2015, 25 : 113–119. DOI:10.1016/j.mib.2015.05.011 |
| [14] | Partow S, Siewers V, Bjorn S, et al. Characterization of different promoters for designing a new expression vector in Saccharomyces cerevisiae. Yeast , 2010 (27) : 955–964. |
| [15] | 萨姆布鲁克J, 拉塞尔DW. 分子克隆实验指南[M]. 第3版. 黄培堂, 译. 北京: 科学出版社, 2002: 1601-1604. |
| [16] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry , 1976, 72 (1) : 248–254. |
| [17] | Johannes TW, Woodywer RD, Zhao H. Efficient regeneration of NADPH using an engineered phosphite dehydrogenase. Biotechnol Bioengineering , 2007, 96 : 18–26. DOI:10.1002/(ISSN)1097-0290 |





