2. 天津国际生物医药联合研究院,天津 300457
2. Tianjin International Joint Academy of Biomedicine, Tianjin 300457
巨噬细胞迁移抑制因子(Macrophage migration inhibitory factor,MIF)是一种由T细胞分泌,能够抑制巨噬单核细胞移动的细胞因子[1]。人源MIF基因片段全长845 bp,由3个外显子(66、107、172碱基对)和2个内含子(94和188碱基对)组成[2]。MIF蛋白晶体结构解析表明MIF蛋白为同源三聚体,单体由115个氨基酸组成,包含2个α螺旋和6个β折叠,3个单体构成一个筒状通道[3]。
MIF蛋白参与调节炎症反应,正常状态下,MIF以前体形态存于巨噬细胞和其他细胞内,在免疫性刺激、感染、炎症刺激下释放出来。MIF作为前炎症细胞因子诱导其它炎症细胞因子表达,如IL-2、IL-6、INF-r等,这些因子与炎症反应和免疫反应密切关系[4]。大多数的前炎症细胞因子可被糖皮质激素抑制,而MIF可作为糖皮质激素的负调节剂[5, 6]。同时,MIF蛋白与癌症密切相关[7-11],在基因水平,MIF在许多种肿瘤细胞里表达水平升高,肿瘤抑制因子p53可被MIF作用而失去活性[12]。此外,MIF蛋白在红斑狼疮[13]、肥胖症[14]等疾病中也具有重要的作用,在患者体内MIF蛋白表达水平明显升高,其浓度与疾病严重程度成正相关性。
MIF蛋白与多种疾病密切相关,已成为治疗相关疾病的重要作用靶点[15-17]。MIF蛋白还具有酮式-烯醇式互变异构酶活性,可作用于D-多巴色素[18]、羟基苯丙酮酸、4-羟基苯丙酮酸[19]等,且其氮末端脯氨酸(Pro1)为互变异构酶活性中心,在抑制MIF蛋白酶活反应中起重要作用[20]。
目前,筛选MIF抑制剂主要通过作用于互变异构酶活性中心抑制其活性来达到筛选目的。已发现的抑制剂主要包括以下几种类型:多巴色素衍生物、苯丙酮酸衍生物、异恶唑类似物、对乙酰氨基酚衍生物、肉桂酸盐、中草药天然化合物、希夫碱类、炔类化合物、α,β-不饱和酮类化合物等[21]。尽管已发现多种MIF酶抑制剂,但没有相关药物上市。因此,亟需建立针对MIF的高通量抑制剂筛选体系,获取新的抑制剂分子,从而为药物研发提供新的思路。综上所述,本实验旨在以MIF蛋白为靶标,建立药物筛选模型,发现效果良好的抑制剂分子,从而利于后期药物开发。
1 材料与方法 1.1 材料和仪器 1.1.1 材料质粒pET-22b,大肠杆菌DH5α、BL21(DE3),Pfu DNA聚合酶由本实验室提供;限制性内切酶和其它分子实验试剂均购于Thermo Fisher公司;人源MIF基因(货号:HG10246-M)购于北京义翘神州生物技术有限公司;目的蛋白表达纯化所用试剂均购自生工生物(上海)股份有限公司;4-羟基丙苯酮酸(4-Hydroxyphenylpyruvic acid,HPP,货号:114286-1G)购于Sigma公司;96孔UV酶标板(货号:655801)购自Greiner公司。
1.1.2 仪器低温超高压连续流细胞破碎机(JN-3000PLUS NO.303032)购于广州聚能生物科技有限公司,蛋白纯化层析系统(AKTA FPLC)及层析柱购于GE公司,各式冷冻离心机和全波长扫描仪(VARIOSKAN FLASH NO.5250040)购于Thermo Fisher公司。
1.1.3 小分子片段库待筛选小分子片段库为本实验室保存,共384种。该分子库的组成分子均来源于与已知蛋白分子有较好结合能力的小分子片段,可用于蛋白与小分子初步筛选实验。
1.2 方法 1.2.1 目的基因的扩增和重组质粒的构建以购买到的MIF基因序列作为模板,设计引物:上游引物5'-GGGACTTCCATATGCCGATGTTCATCG-3'(NdeI);下游引物5'-TACAGCTCGAGACCTCGACCGGCGAAG-3'(Xho I)。通过PCR对目的基因进行扩增,将得到的目的基因和载体质粒pET-22b分别进行双酶切,通过DNA回收试剂盒对酶切后的基因和载体进行回收,用T4 DNA连接酶进行连接,构建重组质粒。将重组质粒转化到大肠杆菌DH5α感受态中,培养扩增目的重组质粒。对重组质粒进行双酶切鉴定,同时对重组质粒进行核苷酸序列测定(金唯智有限公司)。
1.2.2 目的蛋白表达和纯化将测序正确的重组质粒转化到大肠杆菌BL21(DE3)感受态中,在LB低盐固态培养基(含有氨苄霉素)上进行涂布,37℃过夜培养,挑取单个菌落,接种于5 mL的LB液体培养基中(含有氨苄霉素),37℃、180 r/min摇床培养6 h,之后转接800 mL培养基中扩大培养4 h,1 mmol/L IPTG(Isopropyl-β-D-1-thiogalactopyranoside)、16℃诱导表达16 h。将菌液4℃、3500 r/min进行离心,15 min收集沉淀,用缓冲液A(50 mmol/L Tris-HCl、50 mmol/L NaCl、pH8.0)重悬,得到菌体溶液。对菌体溶液进行高压破菌,4℃、12000 r/min离心30 min,收集上清液流穿离子亲和层析柱(Ni Sepharose 6 Fast Flow,GE)。用缓冲液B(10 mmol/L Imidazole、50 mmol/L Tris-HCl、50 mmol/L NaCl、pH8.0)进行平衡,去除杂蛋白;用缓冲液C(500 mmol/L Imidazole、50 mmol/L Tris-HCl、50 mmol/L NaCl、pH8.0)将目的蛋白洗脱下来,借助3 kD的超滤管(Millipore)进行浓缩换液,去除目的蛋白中的咪唑;将50 μL的凝血酶(Sigma)加到目的蛋白溶液中,4℃,160 r/min摇床过夜酶切,将组氨酸标签去除。对去除标签的目的蛋白用缓冲液D(20 mmol/L Tris-HCl、20 mmol/L NaCl、pH7.5)再次进行浓缩换液,经排阻色谱层析柱进一步纯化蛋白。最后用聚丙烯酰氨凝胶电泳(SDS-PAGE)进行纯度鉴定和分析。
1.2.3 互变异构酶-酶活体系的建立选择4-羟基丙苯酮酸(4-Hydroxyphenylpyruvic acid,HPP)作为互变异构酶MIF的检测底物,方法参照文献[22]。底物HPP用50 mmol/L醋酸钠溶解(pH 6.0),4℃过夜平衡后,溶液中HPP大多以酮式存在;在缓冲液(500 mmol/L硼酸,0.2 mol/L PBS,pH6.2)中加入蛋白MIF溶液,再加入底物溶液,底物在互变异构酶MIF的作用下会从酮式互变异构为烯醇式,并保持稳定。在96孔板中(透紫外),用分光光度计检测,波长302 nm时,烯醇式与硼酸复合物有强吸收峰。酶活反应温度25℃,反应总体积为100 μL。通过优化反应体系,计算EC80和Km,确定最佳反应体系配比、蛋白浓度和底物浓度。
1.2.4 抑制剂的筛选用95%的DMSO溶解小分子384种,终浓度50 mmol/L。初筛时,稀释小分子浓度至5 mmol/L作为储备液。将2 μL小分子加入到蛋白中,对照组加入等体积的95% DMSO溶液,室温孵育50 min,之后将蛋白加入到反应缓冲液中,最后加入底物溶液,充分混合后,在302 nm处测定吸光度,以前60 s内的酶反应初速率为标准,计算小分子的抑制率(Inhibition ratio,Ir)。抑制率与初速率变化公式为:Ir=(1-Vi/V0)'100%(Vi为加入药物组反应初速率,V0为加入95% DMSO空白对照组初速率)。将Ir>80%的小分子药物进行梯度稀释,按上述方法再次进行实验,通过测定计算其半数抑制浓度(IC50)来确定抑制活性。
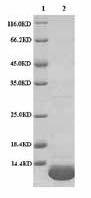
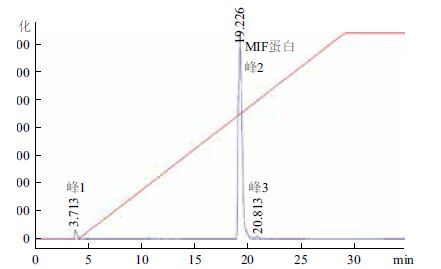
2 结果 2.1 目的蛋白的表达和纯化目的基因进行双酶切鉴定结果(图 1)良好;目的蛋白通过离子亲和层析和排阻色谱层析后,15% SDS-PAGE鉴定其纯度,目的蛋白的分子量约为12.5 kD(图 2),经高效液相色谱分析进一步测定纯度为96.4%(图 3,表 1)。最终蛋白浓度测定为25.9 mg/mL(Nano Drop,Thermo Scientific,USA),冻存于-80℃。

|
| 图 1 DNA琼脂糖凝胶电泳分析 1:重组质粒双酶切;2:基因分子量标准 |
|
| 图 2 15% SDS-PAGE电泳分析 1:蛋白分子量标准;2:目的蛋白 |
|
| 图 3 HPLC纯度测定分析 |
反应体系中三部分成分包括目的蛋白溶液、底物HPP溶液和硼酸溶液(表 2)。选取反应终蛋白浓度为125 μmol/L,底物终浓度为1 mmol/L,在波长为302 nm处间隔1 s测定吸光度,测定时间5 min,3组平行试验。以吸光度为纵坐标,时间为纵坐标制图。体系1和体系2在酶活反应初,体系不平稳,无法计算初速率,体系3的酶活动力曲线较为理想。
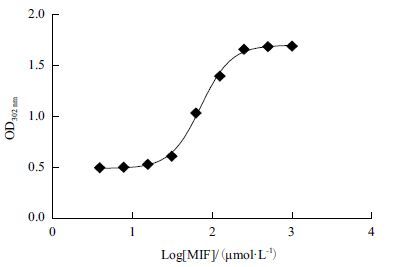
选取底物浓度为1 mmol/L,将蛋白浓度从1 000 nmol/L进行梯度稀释,共9个梯度,3组平行试验,测定后,以最大吸光度与酶浓度对数值作图(图 4),通过软件Graphpad Prism 5,计算EC80值为131.8 nmol/L。
|
| 图 4 蛋白浓度的确定 |
固定蛋白浓度130 nmol/L,将底物HPP浓度从15 mmol/L进行梯度稀释,共9个梯度,3组平行实验,测定后,由米氏方程算出Km值约为1.103 mmol/L(图 5)。

|
| 图 5 Km值的测定 |
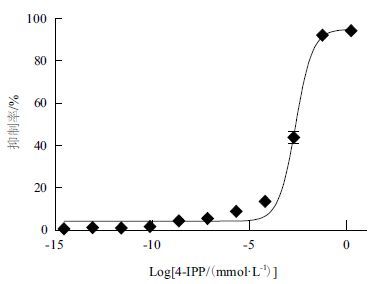
以人源MIF蛋白为靶标建立的药物筛选体系确定为:蛋白浓度为130 nmol/L(0.2 mol/L PBS溶,pH6.2),底物HPP浓度为1 mmol/L(50 mmol/L NaAC溶,pH6.0),酶促反应缓冲液为500 mmol/L 硼酸,0.2 mol/L PBS,pH6.2。三者体积比为3∶3∶4,添加顺序为蛋白加入缓冲液中,最后加底物溶液,总体积为100uL,反应温度25℃。用Z'因子对药物筛选体系进行评定。Z'因子计算公式为:Z'=1-3×(σp-σn)/|μp-μn|(σ:标准差;μ:平均值;p:信号;n:背景)。当0.7≤Z'<1时,表示信噪比较大,数据平行性较好,筛选体系理想。本实验中Z'因子为0.927 5>0.7,以MIF蛋白典型抑制剂4-IPP作为阳性对照,进行酶活测定。最终以酶活抑制率与4-IPP分子浓度对数值作图,通过软件Graphpad Prism 5,计算其IC50值为2.34 μmol/L(图 6),与文献[23]测定结果相似,且抑制效果更好,由此可确定此筛选体系理想,可用于药物筛选实验。
|
| 图 6 阳性抑制剂分子4-IPP的抑制曲线 |
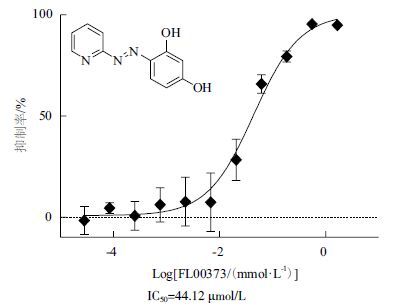
应用此药物筛选体系对实验室小分子库中384种小分子进行初筛,从中筛选出Ir>80%的小分子2种:FL00096,FL00373。对2种小分子进行复筛,将每种小分子浓度从1.667 mmol/L梯度稀释,共11个梯度,测定其IC50值分别为59.07 μmol/L(图 7)、44.12 μmol/L(图 8)。

|
| 图 7 分子FL00096的抑制曲线 |
|
| 图 8 FL00373的抑制曲线 |
MIF蛋白经SDS-PAGE分析测定分子量为12.5 kD,与文献一致[3];HPLC分析、结晶实验进一步验证了目的蛋白纯度高,证明实验中重组构建所表达的MIF蛋白利于酶活实验的开展。
构建的酶活体系经阳性药物4-IPP验证,测得4-IPP分子的IC50值为2.34 μmol/L,优于文献测定值5.00 μmol/L,证明构建效果理想[23]。本实验运用高通量药物筛选技术筛选对人源MIF蛋白互变异构酶活性具有良好抑制的小分子,经初筛有2种小分子的抑制率达到80%以上。复筛测定2种小分子IC50分别为59.07 μmol/L、44.12 μmol/L。运用生物信息学分子对接技术(Schrodinger Suite 2013,Discovery Studio 3.5)将2种小分子FL00096和FL00373分别与蛋白MIF进行对接(图 9),发现2种小分子与蛋白MIF结合位点异于已发现的抑制剂分子[23],这为后期研发新的抑制剂以及与其它抑制剂联合使用提供了可能。

|
| 图 9 2种小分子与蛋白MIF对接 a、b为MIF蛋白与小分子FL00096对接;c、d为MIF蛋白与小分子FL00373对接 |
MIF重组基因构建多次,分别选取pET-28a的氮端组氨酸标签和碳端组氨酸标签,氮端标签的凝血酶酶切效率低,导致MIF蛋白氮端活性位点处于非暴露状态,无法与小分子进行结合;碳端组氨酸标签对酶活也有一定的影响。最终选择将目的基因构建到pET-22b上,使用碳端组氨酸标签,并且在标签基因序列前添加凝血酶酶切位点,利于后期标签的去除。经大肠杆菌原核表达系统表达纯化,获得纯度高且酶活性好的MIF蛋白。
构建酶活体系时,同时选取2种底物:L-3,4-二羟基苯基丙氨酸甲酯(L-dopachrome methyl ester)[24]和对羟基苯丙酮酸(HPP)。L-3,4-二羟基苯基丙氨酸甲酯在4℃只能保存数小时,常温状态下保存时间更短,因此配置后需立即使用,由此导致整个测活体系不稳定而难以优化,不适合进行长时间、大规模的高通量筛选操作。相较于前者,底物HPP较为稳定,在4℃可保存数天,常温保存时间也相对较长,适合药物筛选模型的构建。实验时,底物HPP用醋酸钠溶解底物之后,与配置好的MIF蛋白一起需过夜平衡,否则测定曲线不平滑,不利于初速率的计算。
MIF蛋白与肿瘤、动脉粥样硬化、关节炎、系统免疫等疾病相关,已成为研究这些疾病的一个重要作用靶标。成功构建的以MIF蛋白为靶标,HPP为底物的高通量药物筛选模型,可以对多个化合物库进行筛选,以期得到具有良好抑制效果的化合物,并对筛选到的化合物进行共晶实验或者细胞实验,进一步研究化合物与MIF蛋白、与某种疾病的关系。
4 结论本实验经过不断摸索,成功构建以蛋白MIF为靶点,HPP为底物的药物筛选模型,并对384种小分子进行筛选,测定出2种小分子的半数抑制浓度(IC50)分别为59.07 μmol/L、44.12 μmol/L。在后期实验中,希望通过共结晶、结构验证等手段对这两种小分子进行不断优化,同时在细胞水平进行验证,期望得到抑制效果良好且利于药物开发的新型抑制剂分子。
| [1] | Bloom B, Bennett B. Mechanism of a reaction in vitro associated with delayed-type hypersensitivity. Science , 1966, 153 (373) : 80–82. |
| [2] | Weiser W, Temple P, David J. Molecular cloning of a cDNA encoding a human macrophage migration inhibitory factor. Proceedings of the National Academy of Sciences of the United States America , 1989, 86 (19) : 7522–7526. DOI:10.1073/pnas.86.19.7522 |
| [3] | Merk M, Mitchell R, Endres S, et al. D-dopachrometautomerase(DDT or MIF-2): doubling the MIF cytokine family. Cytokine , 2012, 59 (1) : 10–17. DOI:10.1016/j.cyto.2012.03.014 |
| [4] | Kim H, Kim K, Jung H, et al. Macrophage migration inhibitory factor enhances osteoclastogenesis through upregulation of RANKL expression from fibroblast-like synoviocytes in patients with rheumatoid arthritis. Arthritis Research & Therapy , 2011, 13 (43) : 1–13. |
| [5] | Calandra T, Bernhagen J, Bucala R. MIF as a glucocorticoid-induced modulator of cytokine production. Nature , 1995, 377 (6544) : 68–71. DOI:10.1038/377068a0 |
| [6] | Aeberli D, Yang Y, Mansell A, et al. Endogenous macrophage migration inhibitory factor modulates glucocorticoid sensitivity in macrophages via effects on MAP kinase phosphatase-1 and p38 MAP kinase. FEBS Letters , 2006, 580 (3) : 974–981. DOI:10.1016/j.febslet.2006.01.027 |
| [7] | Krockenberger M, Engel J, Kolb J, et al. Macrophage migration inhibitory factor expression in cervical cancer. Journal of Cancer Research and Clinical Oncology , 2010, 136 (5) : 651–657. DOI:10.1007/s00432-009-0702-5 |
| [8] | Bandres E, Bitarte N, Arias F, et al. microRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells. Clinical Cancer Research , 2009, 15 (7) : 2281–2290. DOI:10.1158/1078-0432.CCR-08-1818 |
| [9] | G uo, Y, Dai Y, Li W, et al. Expression and significance of macrophage migration inhibitory factor in bladder urothelial cell carcinoma. Chinese Journal of Oncology , 2011 (33) : 28–31. |
| [10] | Tan L, Ye X, Zhou Y, et al. Macrophage migration inhibitory factor is overexpressed in pancreatic cancer tissues and impairs insulin secretion function of beta-cell. Journal of Translational medicine , 2014, 12 : 92. DOI:10.1186/1479-5876-12-92 |
| [11] | Razzaghi M, Mazloomfard M, Lotfi B. Macrophage migration inhibitory factor gene-173G>C polymorphism and risk of prostate cancer. European Urology Supplements , 2012, 19 (12) : 142. |
| [12] | Nabizadeh MM, Sima HR, Ghaffarzadehgan K, et al. Clinicopathol-ogical significance of macrophage migration inhibitory factor and its relation with p53 in gastric cancer. Journal of Gastrointestinal Cancer , 2011, 42 (1) : 5–10. DOI:10.1007/s12029-010-9215-3 |
| [13] | Santos L, Morand E. Macrophage migration inhibitory factor: a key cytokine in RA, SLE and atherosclerosis. Clinicachimicaacta; International Journal of Clinical Chemistry , 2009, 399 (1-2) : 1–7. |
| [14] | Sanchez-Niño M, Sanz A, Ihalmo P, et al. The MIF receptor CD74 in diabetic podocyte injury. Journal of the American Society of Nephrology , 2009, 20 (2) : 353–362. DOI:10.1681/ASN.2008020194 |
| [15] | Hawkins O, Verma B, Lightfoot S, et al. An HLA-presented fragment of macrophage migration inhibitory factor is a therapeutic target for invasivebreast cancer. Journal of Immunology , 2011, 186 (11) : 6607–6616. DOI:10.4049/jimmunol.1003995 |
| [16] | Grieb G, Merk M, Bernhagen J, et al. Macrophage migration inhibitory factor(MIF): a promising biomarker. Drug News Perspect , 2010, 23 (4) : 257–264. DOI:10.1358/dnp.2010.23.4.1453629 |
| [17] | Vujicic M, Senerovic L, Nikolic I, et al. The critical role of macrop-hage migration inhibitory factor in insulin activity. Cytokine , 2014, 69 (1) : 39–46. DOI:10.1016/j.cyto.2014.05.013 |
| [18] | Sugimoto H, Taniguchi M, Nakagawa A, et al. Crystal structure of human D-dopachrometautomerase, a homologue of macrophage migration inhibitory factor, at 1. 54 ? resolution. Biochemistry , 1999, 38 (11) : 3268–3279. DOI:10.1021/bi982184o |
| [19] | Rosengren E, Aman P, Thelin S, et al. The macrophage migration inhibitory factor MIF is a phenylpyruvatetautomerase. FEBS Letters , 1997, 417 (1) : 85–88. DOI:10.1016/S0014-5793(97)01261-1 |
| [20] | Swope M, Sun H, Blake P, et al. Direct link between cytokine activity and a catalytic site for macrophage migration inhibitory factor. The EMBO Journal , 1998, 17 (13) : 3534–3541. DOI:10.1093/emboj/17.13.3534 |
| [21] | Xu L, Li Y, Sun H, et al. Current developments of macrophage migration inhibitory factor(MIF)inhibitors. Drug Discovery Today , 2013, 18 (11-12) : 592–600. DOI:10.1016/j.drudis.2012.12.013 |
| [22] | Hajer O, Liu M, Farah E, et al. Kinetic-based high-throughput screening assay to discover novel classes of macrophage migration inhibitory factor inhibitors. Journal of Biomolecular Screening , 2010, 15 (4) : 347–358. DOI:10.1177/1087057110363825 |
| [23] | Zierow S, Crichlow G, Lolis E. A novel, macrophage migration inhibitory factor suicide substrate inhibits motility and growth of lung cancer cells. Cancer Research , 2008, 68 : 7253–7257. DOI:10.1158/0008-5472.CAN-07-6227 |
| [24] | Xu L, Zhang Y, Zheng L, et al. Discovery of novel inhibitors targeting the macrophage migration inhibitory factor via structure-based virtual screening and bioassays. Journal of Medicinal Chemistry , 2014, 57 : 3737–3745. DOI:10.1021/jm401908w |