2. 南京大学医药生物技术国家重点实验室,南京 210093
2. The State Key Laboratory of Pharmaceutical Biotechnology, Nanjing University, Nanjing 210093
吸血蝙蝠唾液中含有可以帮助吸血动物进食的纤溶酶原激活剂,称为吸血蝙蝠唾液纤溶酶原激活剂(DSPAs)。研究发现DSPAs有4种形式,分别为:DSPAα1、α2、β及γ。其中,DSPAα1和 DSPAα2包含信号肽、指形区(F)、表皮生长因子区(E)、kringle区(K)和丝氨酸蛋白酶区(P),而DSPAβ缺乏F,DSPAγ缺乏F和P。DSPAs与组织性纤溶酶原激活剂(t-PA)相似,但是不含t-PA分子的K2区和纤溶酶切割位点[1, 2]。
DSPAs 与t-PA不同,对纤溶酶原的激活严格要求血纤蛋白作为辅助因子,DSPAs的纤维蛋白依赖性及纤维蛋白选择性需要其与纤维蛋白结合来介导,与F区有关[3]。DSPAs的4种形式中以DSPAα1的活性最高,研究也最多。同t-PA相比,DSPAα1的血纤蛋白依赖性[4]和选择特异性更高[5],当血纤蛋白存在时,DSPAα1的催化速率将提高105倍,而t-PA仅提高550倍。动物实验证明,重组的DSPAα1的溶栓速度比重组的t-PA更快[6],对血栓中血纤蛋白选择性更强,持续的时间更长。同时,在给药后,t-PA致使血纤蛋白原、纤溶酶原、α2-抗纤溶酶下降的比例都明显大于DSPAα1[7-9]。还有研究发现t-PA用药后有高分子质量的血纤蛋白原降解产物片段的积累,而DSPAα1不积累;t-PA导致纤溶酶原和因子Ⅷ下降,而DSPAα1引起的变化不明显。从稀有物种中发现的天然的溶栓物质DSPAα1因其绝佳的自然选择性及对新鲜血栓的溶解作用已经被报道用作溶栓药物[10]。
研究证明[11],在纤维蛋白凝块的溶解实验中,DSPAγ具有溶解纤维蛋白凝块的能力,但其作用比DSPAα1差,取得相同的溶栓效果时,所需的DSPAγ的量约为DSPAα1的48倍。DSPAα1溶栓性能最为优越,具有高度的纤维蛋白结合特性。血浆凝块溶解实验显示DSPAγ未表现出溶栓作用。因而推断Finger区和EGF区对DSPAα1的功能至关重要。为此,本研究通过SOE-PCR技术构建出了缺乏E区的DSPAα1(命名为mDSPAα1),与DSPAα1、DSPAβ和DSPAγ一起克隆到毕赤酵母中进行表达,随后采用纤溶平板法进行了活性测定,探讨DSPAs结构与功能的关系。
1 材料与方法 1.1 材料毕赤酵母(Pichia pastoris,P. pastoris)菌株GS115,质粒pPIC9K购自Invitrogen公司,宿主菌E.coil Top10由本实验室保存。DSPAα1全长由上海生工合成,mDSPAα1、mDSPAα1、DSPAγ引物及测序由上海生工生物工程技术有限公司完成。DSPAα1巴斯德毕赤酵母工程菌株由本实验室构建并保存[12]。各类限制性内切酶,T4 DNA连接酶,Taq酶,Primer STARTMHS DNA Polymerase等购自Takara公司,RNase购自上海生工。胶回收试剂盒购自BioFlux;质粒小提试剂盒购自天根生物。其他试剂为分析纯试剂。蛋白电泳仪购自Bio-Rad 公司。
1.2 方法 1.2.1 重组质粒mDSPAα1/pPIC9K、DSPAβ/pPIC9K、DSPAγ/pPIC9K的构建以合成的 pUC57-DSPAa1为模板,设计引物(表 1)通过PCR技术合成mDSPAα1、DSPAβ、DSPAγ。引物1及引物2扩增出F区,引物3和引物4扩增出KP区。以F和KP区为模板,通过引物1和引物4扩增得到F+KP(即mDSPAα1);引物5和引物6扩增得到EKP区(即DSPAβ);引物7和引物8扩增得到KP区(即DSPAγ)。
将扩增得到的3种PCR产物分别进行 Xho I和EcoR I双酶切后连接到毕赤酵母表达载体 pPIC9K 构建重组质粒mDSPAα1/pPIC9K、DSPAβ/pPIC9K、DSPAγ/pPIC9K。
1.2.2 重组酵母工程菌的构建将重组质粒mDSPAα1/pPIC9K、DSPAβ/pPIC9K、DSPAγ/pPIC9K分别电转入P. pastoris GS115,通过 5' AOX1 和3' AOX1 引物进行菌落PCR筛选阳性克隆。筛选到的阳性克隆进行G418筛选高拷贝菌株,将只在2-4 mg/mL G418下生长良好的菌株用作表达分析。
1.2.3 重组酵母工程菌的表达重组mDSPAα1、DSPAα1、DSPAβ和DSPAγ酵母工程菌进行小量表达并分析其表达情况。将工程菌接种到3 mL BMGY培养基,30℃,250 r/min培养至OD600=3-6(约24 h),1 500 g离心5 min,弃上清,将细胞沉淀悬浮于3 mL BMMY培养基中诱导表达。期间,每24 h补加甲醇至终浓度为1%,诱导72 h后取样。样品经三氯乙酸(TCA)沉淀法处理后进行 SDS-PAGE分析,采用Bradford(CBB)法测定蛋白质浓度。
1.2.4 重组蛋白的活性测定将重组酵母工程菌进行大量表达,甲醇诱导72 h后,离心收集上清,经65%硫酸铵沉淀并透析后,使用纤维平板法对其进行活性测定[13]。
1.2.4.1 标准曲线的绘制在制备好的纤维平板上打九个孔,分别加入总体积为50 μL总酶活梯度为:0 U、20 U、40 U、80 U、160 U、320 U、640 U、960 U、1 280 U的尿激酶。37℃恒温观察12 h乳白色平板透明圈情况。从第2 h开始,每隔2 h记录一次透明圈直径(D/mm),截止12 h止。参考以前纤溶平板测定纤溶活性的方法,通过数学模拟的方法,建立纤溶斑直径与样品纤溶酶活性的函数关系。通过对纤溶直径的测量,计算出样品活性大小。
1.2.4.2 活性测定向纤维平板中分别加入50 μL 重组 DSPAα1,DSPAβ,DSPAγ 和 mDSPAα1 于37℃孵育,根据所建立的数学模型计算出各重组蛋白的活性,活性用比活表示:
比活=上清单位蛋白活性(U/mL)/上清蛋白含量(μg/mL)。
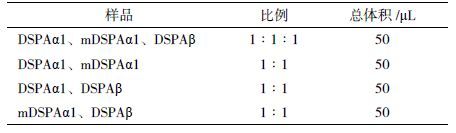
1.2.5 重组蛋白的活性比较取透析后样品DSPAα1、mDSPAα1和DSPAβ按照表 2混合后滴加在纤溶平板的点样孔中,经4 h后对每个样品的纤溶直径(D/mm)进行测量。
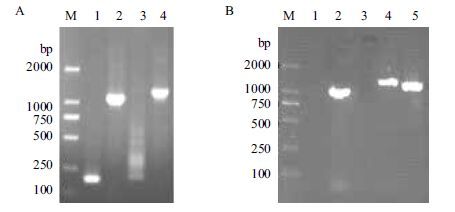
以引物1-4为扩增引物,pUC57-DSPAa1为模板,通过SOR-PCR技术扩增出扩增F+KP区(即mDSPAα1)大小约为1 218 bp(图 1-A)。以引物5-8为扩增引物,分别扩增出1 176 bp的 EKP区(即DSPAβ)和约为1 068 bp的KP区(即DSPAγ)(图 1-B)。对获得的阳性克隆进行序列测定,分析测定结果表明重组质粒构建成功。
|
| 图 1 mDSPAα1的PCR结果(A)、DSPAβ 和DSPAγ的PCR结果(B) (A)M:DL2000 DNA Marker;1为F区;2为KP区;3为阴性结果;4为F+KP区(即mDSPAα1)。(B)M:DL2000 DNA Marker;1为阴性结果;2为阳性对照:mIL-2/pPIC9K(using the 5' AOX1 primer);3为阴性对照;4为DSPAβ;5为DSPAγ |
将经G418筛选到的高拷贝重组克隆mDSPAα1、DSPAβ、DSPAγ酵母工程菌以及本实验室保存的重组DSPAα1酵母工程菌分别进行小量表达,收集表达上清用TCA(三氯乙酸)法浓缩15倍后进行SDS-PAGE。结果显示,未发现有DSPAγ的目的条带;重组DSPAα1在分子量约为66 kD处比GS115多一条可诱导表达的蛋白条带,与分子量预测值基本相符(图 2-A);重组mDSPAα1在分子量约为45 kD处比GS115多一条可诱导表达的蛋白条带,与分子量预测值基本相符(图 2-B);重组DSPAβ在分子量约为43 kD处比GS115多一条可诱导表达的蛋白条带,与分子量预测值基本相符(图 2-C)。
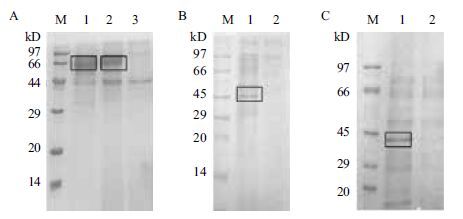
|
| 图 2 重组DSPAα1酵母工程菌(A)、重组mDSPAα1酵母工程菌(B)及重组DSPAβ酵母工程菌表达结果(C) (A)M:蛋白marker;1、2:重组DSPAα1酵母工程菌;3:空酵母工程菌。(B)M:蛋白marker;1:重组mDSPAα1酵母工程菌;2:空酵母工程菌。(C)M:蛋白marker;1:重组DSPAβ酵母工程菌;2:空酵母工程菌 |
以测量直径的平均值为纵坐标,时间为横坐标,作8个不同活性标准品的变化曲线(图 3-A);以测量直径的平均值为纵坐标,活性浓度为横坐标,作6个时间点上的变化曲线(图 3-B);以平均直径的对数为纵坐标,活性的对数为横坐标,作6个时间点上的变化曲线(图 3-C)。分析比较可以看出在6个不同的时间点(2、4、6、8、10、12 h),6条平均纤溶直径的对数与活性对数的变化曲线(图 3-C)较6条平均纤溶直径的与活性的变化曲线(图 3-B)具有更明显的线性关系。因此,利用平均纤溶直径的对数同活性对数之间的变化曲线作为标准曲线更为准确。

|
| 图 3 标准曲线(A)、纤溶直径与纤溶活性的关系(B)、纤溶直径对数与纤溶活性对数的关系(C) |
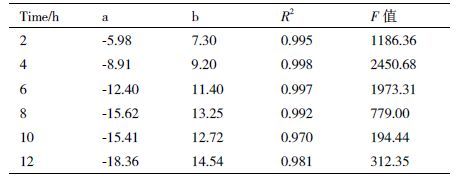
通过对实验数据的分析可知,纤溶斑的直径D与样品活性U的对数之间具有良好的线性关系。以lgD为自变量,lgU为因变量,利用一元线型回归方程,拟合两者之间的关系式为:lgU=a+b*lgD。
2.3.2 重组蛋白的活性测定通过对实验数据建立了数学模型的表达式:lgU=a+b*lgD。应用最小二乘法确定线性回归系数a和b,用相关系数R2值判断模型的拟合效果(表 3),R2越大,模型的拟合效果越好,方程分析F值检验回归方程显著性,F值越大,说明回归显著。从表 3看出,4 h的时候R2最大,因此选取4 h作为最佳活性测定时间,数学模型表达式为lgU=-8.91+9.20*lgD。
取透析后样品mDSPAα1和DSPAβ各50 μL滴加在纤溶平板的点样孔中,经4 h后对每个样品的纤溶直径(D/mm)进行测量。经计算,DSPAα1的活性为2.64×105 U/mg,DSPAβ的活性为1.32×104 U/mg,mDSPAα1的活性为151.52 U/mg。
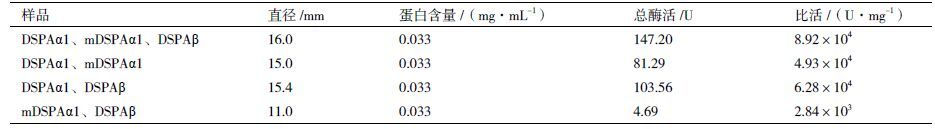
2.4 重组DSPAα1、mDSPAα1、DSPAβ的活性比较纤溶平板测活实验结果(表 4)表明,将DSPAα1、mDSPAα1、DSPAβ三者按1∶1∶1混合、点样测活后,发现同时使用DSPAα1、mDSPAα1、DSPAβ三者时,各自的活性几乎不受影响,即三者之间不存在相互拮抗作用。当将DSPAα1、mDSPAα1、DSPAβ中任意两者按1∶1比例混合时,活性均降低2-3倍。
溶栓药物的研究已经发展到了第三代,这代药物向着更安全、更高效的方向发展,但在副作用方面新一代的药物较之第二代的药物,大规模临床试验中,其主要指标如并发性出血、凝前效应等差异并不显著,仍不能满足临床的需要。因此,更为安全有效的新型溶栓药物的研制是一项紧迫而艰巨的任务。生理学和药理学研究发现DSPAa1具有安全性和耐受性[14, 15]。DSPAa1用于急性缺血性中风(DIAS)试验已部分完成,二期临床试验证明它是安全有效的,然而三期临床试验没有得到理想的结果,虽然安全性没有问题,但对患者还达不到主要的疗效指标,名为DIAS-3 和 DIAS-4的三期临床试验仍在进行[16]。人们一直致力于研究DSPAa1,并将其作为新型候选溶栓药物[17-19],而研究过程中不可避免地需要大量的原材料。天然的DSPAa1只能从吸血蝙蝠得到,共477个氨基酸,约有30个半胱氨酸形成的二硫键。因此,如果在大肠杆菌中表达DSPAa1,会导致其半胱氨酸折叠发生错误而失去活性。目前,已从哺乳动物细胞和昆虫细胞中获得DSPAa1[20, 21],但是价格昂贵,不易操作。在过去的15年,甲醇营养型毕赤酵母已经成功表达多种外源蛋白[22],与酿酒酵母相比,缺少发生在外部寡糖链上的α-1,3键连接,糖基化程度低,寡糖链上增加的甘露糖残基数目较少。因此毕赤酵母中的糖基化可能与哺乳动物细胞中的情况相似。在CHO 细胞和 Sf 9 昆虫细胞中表达的DSPAa1活性完全相同且在酶活特异性上未见明显差异[21],且N-型糖基链对毕赤酵母表达的 DSPAα1 分泌和酶活性具有重要作用[23]。因此,毕赤酵母表达系统使大量获得DSPAa1成为可能,成为开发新型溶栓药物的前提。
本研究中构建的重组DSPAγ在毕赤酵母表达后并发现未有目的蛋白出现,分析其原因可能是以下几方面的因素造成的。蛋白的分泌表达受外源蛋白自身理化性质的影响[24]。蛋白质在内质网和高尔基体中被加工修饰后的去向是由蛋白自身特点决定。因此,未发现DSPAγ表达,其空间结构、糖基化位点、氨基酸组成及其它理化特性都影响毕赤酵母对其分泌;对于表达分泌型外源蛋白来说,蛋白酶降解是影响表达量的一个重要因素。因此DSPAγ也有可能是被蛋白酶降解掉。外源蛋白在毕赤酵母中的表达受多种因素的影响,已有许多细菌、真菌和高等动植物的基因在P. pastoris中成功表达(如破伤风毒素片段C,12 g/L)[25],但也有许多蛋白的表达量并不理想(如多瘤病毒大T 抗原,0. 5 mg/L)[26],甚至不能表达(如HIV表面糖蛋白)[27]。限于目前对毕赤酵母的了解程度,仍然无法预见某种外源蛋白是否能在其中获得高产,甚至仅仅能否表达。
本课题组在毕赤酵母中成功表达了重组DSPAα1、mDSPAα1、DSPAβ,同时使用纤溶平板法测得DSPAα1的活性为2.64×105 U/mg,DSPAβ的活性为1.32×104 U/mg,mDSPAα1的活性为151.52 U/mg。取得相同的溶栓效果时,所需的mDSPAα1的量约为DSPAα1的1 700倍,所需的DSPAβ的量约为DSPAα1的20倍,表明E区的缺失使得DSPAα1的纤溶活性大大降低,而F区的缺失对其纤溶能力有一定的影响,但其影响程度远低于E区的缺失。由此推测,E区是DSPA的一个重要的结构域。通过测定同时使用DSPAα1、mDSPAα1、DSPAβ三者和单独使用其中的任意两者的溶栓活性发现,当同时使用DSPAα1、mDSPAα1、DSPAβ时,总活性几乎不受影响,但当单独使用任意两者时,发现活性均降低2-3倍。对于产生这样的现象的原因需要进一步的实验进行探索。
4 结论DSPAα1的结构与活性相关,构建了并表达了无F区的DSPAβ,无E区的mDSPAα1以及无FE区的DSPAγ。在测定活性的时候,建立了数学模型,使测定结果更为准确可靠。经过表达重组DSPAα1、mDSPAα1、DSPAβ后测定其活性,发现DSPAα1 N端区域对其活性很重要,且E区在DSPAα1溶栓过程中起关键作用。同时,当DSPAα1、mDSPAα1、DSPAβ三者共同存在时,总活性几乎不受影响,但当单独使用任意两者时,活性均降低2-3倍。
| [1] | Gardell SJ, Duong LT, Diehl RE, et al. Isolation, characterization, and cDNA cloning of a vampire bat salivary plasminogen activator. Journal of Biological Chemistry , 1989, 264 (30) : 17947–17952. |
| [2] | Krätzschmar J, Haendler B, Langer G, et al. The plasminogen activator family from the salivary gland of the vampire bat Desmodus rotundas: cloning and expression. Gene , 1991, 105 (2) : 229–237. DOI:10.1016/0378-1119(91)90155-5 |
| [3] | Bringmann P, Gruber D, Liese A, et al. Structural features mediating fibrin selectivity of vampire bat plasminogen activators. Journal of Biological Chemistry , 1995, 270 (43) : 25596–25603. DOI:10.1074/jbc.270.43.25596 |
| [4] | Gardell SJ, Hare TR, Bergum PW, et al. Vampire bat salivary plasminogen activator is quiescent in human plasma in the absence of fibrin unlike human tissue plasminogen activator. Blood , 1990, 76 (12) : 2560–2564. |
| [5] | Bergum PW, Gardell SJ. Vampire bat salivary plasminogen activator exhibits a strict and fastidious requirement for polymeric fibrin as its cofactor, unlike human tissue-type plasminogen activator. A kinetic analysis. Journal of Biological Chemistry , 1992, 267 (25) : 17726–17731. |
| [6] | Witt W, Maass B, Baldus B, et al. Coronary thrombolysis with Desmodus salivary plasminogen activator in dogs. Fast and persistent recanalization by intravenous bolus administration. Circulation , 1994, 90 (1) : 421–426. DOI:10.1161/01.CIR.90.1.421 |
| [7] | Stewart RJ, Fredenburgh JC, Weitz JI. Characterization of the interactions of plasminogen and tissue and vampire bat plasminogen activators with fibrinogen, fibrin, and the complex of D-dimer noncovalently linked to fragment E. Journal of Biological Chemistry , 1998, 273 (29) : 18292–18299. DOI:10.1074/jbc.273.29.18292 |
| [8] | Montoney M, Gardell SJ, Marder VJ. Comparison of the bleeding potential of vampire bat salivary plasminogen activator versus tissue plasminogen activator in an experimental rabbit model. Circulation , 1995, 91 (5) : 1540–1544. DOI:10.1161/01.CIR.91.5.1540 |
| [9] | Gardell SJ, Ramjit DR, Stabilito II, et al. Effective thrombolysis without marked plasminemia after bolus intravenous administration of vampire bat salivary plasminogen activator in rabbits. Circulation , 1991, 84 (1) : 244–253. DOI:10.1161/01.CIR.84.1.244 |
| [10] | Schleuning WD. Vampire bat plasminogen activator DSPA-alpha-1(desmoteplase): a thrombolytic drug optimized by natural selection. Pathophysiology of Haemostasis and Thrombosis , 2001, 31 (3-6) : 118–122. |
| [11] | 董宁征, 吴庆宇, 潘峻亮, 等. dsPAα1 的缺失突变体的构建及其活性. 中国生物化学与分子生物学报 , 2004, 20 : 805–809. |
| [12] | 刘堰, 苏畅, 宋小双, 等. 表达食血蝙蝠唾液纤溶酶原激活剂的毕赤酵母菌株的构建. 生物工程学报 , 2009, 25 (4) : 566–574. |
| [13] | Marsh NA, Gaffney PJ. The rapid fibrin plate-a method for plasminogen activator assay. Thrombosis and Haemostasis , 1977, 38 (2) : 545–551. |
| [14] | Hacke W, Albers G, Al-Rawi Y, et al. The Desmoteplase in Acute Ischemic Stroke Trial(DIAS)a phase II MRI-based 9-hour window acute stroke thrombolysis trial with intravenous desmoteplase. Stroke , 2005, 36 (1) : 66–73. DOI:10.1161/01.STR.0000149938.08731.2c |
| [15] | Hacke W, Furlan AJ, Al-Rawi Y, et al. Intravenous desmoteplase in patients with acute ischaemic stroke selected by MRI perfusion-diffusion weighted imaging or perfusion CT(DIAS-2): a prospective, randomised, double-blind, placebo-controlled study. The Lancet Neurology , 2009, 8 (2) : 141–150. DOI:10.1016/S1474-4422(08)70267-9 |
| [16] | Kummer R, Albers GW, Mori E. The desmoteplase in acute ischemic stroke(DIAS)clinical trial program. International Journal of Stroke , 2012, 7 (7) : 589–596. DOI:10.1111/ijs.2012.7.issue-7 |
| [17] | Balami JS, Chen R, Sutherland BA, et al. Thrombolytic agents for acute ischaemic stroke treatment: the past, present and future. CNS & Neurological Disorders-Drug Targets , 2013, 12 (2) : 145–154. |
| [18] | Patel R, Ispoglou S, Apostolakis S. Desmoteplase as a potential treatment for cerebral ischaemia. Expert Opinion on Investigational Drugs , 2014, 23 (6) : 865–873. DOI:10.1517/13543784.2014.911285 |
| [19] | Albers GW, von Kummer R, Truelsen T, et al. Safety and efficacy of desmoteplase given 3-9 h after ischaemic stroke in patients with occlusion or high-grade stenosis in major cerebral arteries(DIAS-3): a double-blind, randomised, placebo-controlled phase 3 trial. The Lancet Neurology , 2015, 14 (6) : 575–584. DOI:10.1016/S1474-4422(15)00047-2 |
| [20] | Krätzschmar J, Haendler B, Bringmann P, et al. High-level secretion of the four salivary plasminogen activators from the vampire bat Desmodus rotundus by stably transfected baby hamster kidney cells. Gene , 1992, 116 (2) : 281–284. DOI:10.1016/0378-1119(92)90526-U |
| [21] | Petri T, Langer G, Bringmann P, et al. Production of vampire bat plasminogen activator DSPA α1 in CHO and insect cells. Journal of Biotechnology , 1995, 39 (1) : 75–83. DOI:10.1016/0168-1656(94)00146-4 |
| [22] | Cereghino JL, Cregg JM. Heterologous protein expression in the methylotrophic yeast Pichia pastoris. FEMS Microbiology Reviews , 2000, 24 (1) : 45–66. DOI:10.1111/j.1574-6976.2000.tb00532.x |
| [23] | 李剑凤, 阎岩, 王庆民, 等. N-糖基化对毕赤酵母表达的 DSPAα1 分泌和活性的影响. 生物工程学报 , 2010, 26 (9) : 1287–1292. |
| [24] | 张丞斌, 傅正伟. 影响外源蛋白在巴斯德毕赤酵母中表达和分泌的研究进展. 现代生物医学进展 , 2008, 8 (7) : 1382–1384. |
| [25] | Clare JJ, Rayment FB, Ballantine SP, et al. High-level expression of tetanus toxin fragment C in Pichia pastoris strains containing multiple tandem integrations of the gene. Bio/Technolgy , 1991, 9 (5) : 455–460. DOI:10.1038/nbt0591-455 |
| [26] | Peng YC, Acheson NH. Production of active polyomavirus large T antigen in yeast Pichia pastoris. Virus research , 1997, 49 (1) : 41–47. DOI:10.1016/S0168-1702(97)01455-X |
| [27] | Clare J, Scorer C, Buckholz R, et al. Expression of EGF and HIV envelope glycoprotein[M]// Higgins DR, Cregg JM. Pichia protocols. Totowa: Humana Press, 1998: 209-225. |