2. 东华大学化学化工与生物工程学院,上海 201620
2. College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai 201620
嗜水气单胞菌(Aeromonas hydrophila,Ah)属于弧菌科(Vibrionaceae)气单胞菌属(Aeromonas),广泛分布于自然界的各种水体及土壤中[1, 2]。Ah是多种水生动物的原发性致病菌,也为条件致病菌,会导致水产动物的出血症,病势较猛,死亡率高,给水产养殖业造成严重的经济损失[3]。此外,Ah可通过接触被污染的水和水产动物性食品、伤口或摄入感染人类,引起人类腹泻、急性肠胃炎等,是典型的人-兽-鱼共患病病原菌[2, 4, 5]。近年来,随着水生实验动物的广泛应用,特别是国内外众多实验室以斑马鱼为模式动物进行大量科学研究,使Ah的检测与控制研究显得尤为重要,引起了生命科学界及水产学界科研工作者的广泛重视[6, 7]。
Ah可依据其是否具有致病性将其分为致病菌株与非致病菌株两大类,而Ah的致病性则与其毒力因子密切相关[8, 9]。现已有许多学者针对Ah病原的毒力因子开展了大量研究,证实Ah所分泌的溶血素、气溶素、胞外蛋白酶、丝氨酸蛋白酶等是Ah重要的毒力因子,与该菌是否具有致病性及致病性的强弱具有较高的相关性[10, 11]。本研究从发病的斑马鱼组织中分离病原菌,对其生物学性状、生理生化特性、致病力、保守基因、基于gyrB、16S rRNA基因序列的系统发育树,以及人工感染Ah后斑马鱼主要器官的组织病理变化进行研究,旨在为斑马鱼细菌质量控制和实验人员防护提供重要的理论指导和技术支持。
1 材料与方法 1.1 材料 1.1.1 实验动物选取本单位(实验动物使用许可证号:SYXK(沪)2013-0056)隔离饲养区的自然发病斑马鱼作为实验样本,其临床病理特征主要表现为鱼体消瘦,鳃部充血发红,严重者烂鳃烂尾,鱼侧身体表溃疡出血。此外,选取饲养于独立水生动物养殖系统(意大利TECNIPLAST公司)的体长约4 cm、体重在0.6-0.9 g范围内,健康活泼、无异样病症的10月龄AB系野生型斑马鱼(其中雌雄各半)用于分离菌的人工感染致病性试验。
1.1.2 主要试剂羊血琼脂平板、TSA、TSB、Rimler-Shotts(RS)培养基、MMA培养基,细菌基因组DNA提取试剂盒、Es Taq Master Mix、DNA纯化回收试剂盒,苏木素、伊红、NaOH、无水乙醇、丙三醇、二甲苯、冰乙酸等。
嗜水气单胞菌阳性对照菌株由中国普通微生物菌种保藏管理中心(CGMCC)提供,菌株编号为:CGMCC 1.2017,配置批号:2012.11.21。
1.2 方法 1.2.1 病原菌的分离培养以无菌操作方式解剖斑马鱼,取其体表病灶组织及腹腔器官团进行组织匀浆,接种于羊血琼脂平板,30℃培养10-24 h,取优势菌落进行纯化培养。本文分离的菌株为本实验室从斑马鱼体内分离出的第4个菌株,编号为ZF4。
1.2.2 分离菌株形态观察与生理生化特性鉴定将纯培养所获得的病原菌接种于TSA平板培养基,30℃条件下培养18-24 h,观察菌落形态、大小、颜色及边缘是否整齐、凸起等,并涂片进行革兰氏染色镜检,进行细菌的初步鉴定。根据染色结果,应用细菌生化微量鉴定管进行细菌的常规生理生化测定,并采用ID32E微量多项试验鉴定系统(ATB Expression 仪,法国生物梅里埃公司)进行细菌鉴定。
1.2.3 DNA提取及PCR扩增分离菌及阳性对照菌的DNA提取依细菌基因组DNA提取试剂盒的说明书进行。利用oligo 6软件设计并合成4对保守基因引物(表 1),PCR反应条件为94℃ 5 min,94℃ 45 s,退火45 s,72℃ 1 min,35 C,72℃ 10 min。
用DNA纯化回收试剂盒对gyrB和16S rRNA的扩增产物进行回收,并送上海生工生物工程技术服务有限公司进行测序。获得序列采用Blast进行相似性比较,采用MEGA 5软件进行系统发育树的构建。
1.2.5 分离菌株致病性实验 1.2.5.1 平板计数将阳性菌株与ZF4同时进行菌种复苏,待传代、培养至稳定状态时对其进行计数实验。菌液按1∶100比例分别接种于TSB液体培养基中30℃培养,在1、2、2.5、3、3.5、4、5和6 h八个时间点各取出对应试管测OD值,并选取处于细菌生长对数期的中间6个时间点进行平板计数。
1.2.5.2 人工感染实验开始前2日将健康的斑马鱼随机分为7组(6实验组+1对照组),每组6尾,雌雄各半,分别饲养于7个饲养缸内,以适应环境,感染实验开始前禁食24 h。按1∶100比例分别转接阳性菌株和分离菌株ZF4,30℃培养至3.5 h时,采样测量两种菌株的OD值,按平板计数所得的拟合曲线得出菌液浓度,并分别稀释成3个梯度浓度的菌液。利用腹腔注射的方法分别对6个实验组中的每尾受试斑马鱼注射不同浓度梯度的菌液各10 µL,对照组每尾注射10 µL PBS,观察7 d内受试斑马鱼的活力、摄食、发病症状和死亡情况。
1.2.6 组织切片的制作与病理学变化的观察选取人工感染后具有典型发病症状的濒死斑马鱼,在立体显微镜(SZX7,Olympus)下进行解剖,摘取感染病鱼的鳃丝直接置于显微镜下观察病理变化,取内脏器官组织固定于10%甲醛溶液24 h后,脱水后以石蜡包埋,切片厚4 µm,采用常规方法进行HE染色,光学显微镜(DP80,Olympus)下观察拍照。
1.2.7 再次分离鉴定致病菌将人工感染致死的斑马鱼在无菌条件下剖开腹部,用接种环沾取腹腔积液接种至TSA培养基平板,30℃培养过夜后,挑选优势菌落进行分离纯化后,转接至RS、MMA培养基继续培养,菌落鉴定的形态观察、生理生化鉴定及分子生物学等方法,再次进行分离菌落和分析鉴定。
2 结果 2.1 菌落形态特征取优势菌株ZF4的纯培养物接种于TSA培养基分别培养18-24 h后,菌落边缘光滑整齐,中央凸起,有光泽,带特殊芳香气味,β溶血。革兰氏染色镜检结果为阴性短杆菌。
2.2 分离菌株生理生化指标分离菌株ZF4在所测项目中,葡萄糖、蔗糖、麦芽糖、甘露醇、阿拉伯糖和吲哚试验等项目为阳性反应,鸟氨酸脱羧酶、酚红、α-半乳糖苷酶、鼠李糖、肌醇、山梨醇等项目的反应为阴性。常规生理生化测定方法结合ATB系统细菌自动鉴定仪初步鉴定ZF4为Ah。
2.3 基因扩增结果将ZF4及阳性对照菌株进行菌种复苏并培养至稳定状态后,针对Ah的保守基因AHA_0438、ASP、gyrB、16S rRNA的引物进行了PCR扩增,结果(图 1)显示以上4对引物均可在ZF4及阳性对照菌株上扩增出目的条带,且与对应的目标产物大小相符。
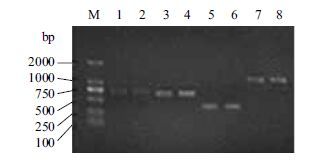
|
| 图 1 嗜水气单胞菌PCR检测结果 M:DNA marker;1、3、5、7:分别显示ZF4的AHA_0438、gyrB、ASP和16S rRNA的PCR扩增结果;2、4、6、8:分别显示阳性对照菌株的AHA_0438、gyrB、ASP和16S rRNA的PCR扩增结果 |
为进一步从分子水平上确认ZF4在气单胞菌属中的分型位置,将Ah的保守基因进行测序、同源性分析。结果显示,ZF4的gyrB基因扩增产物同源性与GenBank中登录的Ah(KAE13、KY07)同源性最高(98.5%),与其他Ah的同源性在93.4%以上(图 2-A);16S rRNA基因扩增产物的同源性与GenBank中登录的其他Ah的均具有高同源性(97.7%以上),并与NQY1、S5-41、Ah-13等Ah菌株同源性最高达99.6%(图 2-B)。从构建的系统发育树上可以看出,无论是基于gyrB基因还是16S rRNA基因的序列,结果均显示ZF4与Ah聚为一簇。

|
| 图 2 基于gyrB基因(A)和16S rRNA(B)序列的系统发育树 |
将分离菌株ZF4和Ah阳性菌株于30℃培养箱进行培养,根据不同时间点取出对应试管测得OD值绘制线性拟合曲线所对应的关系式(图 3),培养至3.5 h时菌体生长活性较好。阳性对照菌株和ZF4对应OD分别为0.607、0.731时,其所对应的菌落形成单位分别为8.16×1010 CFU/mL、7.66×1010 CFU/mL。然后,将阳性对照菌株稀释成8.16×1010、8.16×109和8.16×108 CFU/mL,ZF4稀释成7.66×1010、7.66×109和7.66×108 CFU/mL注射,每尾注射菌液10 µL,对照组注射10 µL PBS。

|
| 图 3 两种菌株的线性拟合曲线 A:阳性对照菌株;B:分离菌株ZF4 |
斑马鱼在经人工感染病原菌后,斑马鱼雌雄个体表现差异不明显,ZF4感染组和阳性对照组的表现症状基本一致,并且发病症状与自然发病症状也基本一致。初期均表现为食欲不振,游动缓慢,体表粘液分泌增多,后期出现身体侧翻,失去平衡、腹部红肿及鳍条基部充血(图 4-A)等病症,解剖可见肝脏肿大,腹腔积水(图 4-B)。将感染病鱼的鳃丝置于显微镜下观察发现,病鱼鳃丝呈灰白色,末端弯曲伴有缺损现象,且附有大量粘液,鳃丝之间发生相互粘连现象,并有许多黑色附着物(图 4-D)。阳性对照菌株感染的斑马鱼中,8.16×1010 CFU/mL组,在实验3 d内死亡率为50%;其他浓度注射组在实验周期内未出现死亡,但部分鱼体出现了食欲不振,腹部红肿等病理症状。ZF4感染的斑马鱼中,7.66×1010 CFU/mL组,在实验3 d内死亡率为50%;其他浓度注射组在实验周期内未出现死亡,亦有个体出现相似的病症表现。对照组在7 d内活动正常,未出现明显的临床症状和死亡。

|
| 图 4 人工感染后斑马鱼临床症状和鳃的变化 A:鳍条基部充血;B:腹腔积水;C:对照组斑马鱼的鳃;D:病鱼的鳃 |
将斑马鱼肝脏、肠道、脾脏等内脏器官组织固定后进行HE染色切片,从病理切片来看,感染Ah阳性菌株和分离菌株ZF4病鱼的器官组织均发生了较为明显的变化,其中肝脏变化最为普遍和明显。肝脏中均可见肝细胞肿胀变形,在血管周围可见较多的含铁血黄素沉积(图 5-B),部分细胞胞质消失,结构模糊,细胞间界限不明显,实质中出现空泡变性甚至气球性变性(图 5-C),在肝脏的边缘可见明显的炎性细胞增生(图 5-D)。与斑马鱼正常肠道结构(图 6-A)相比,感染病鱼肠黏膜上皮细胞变性(图 6-B),严重者肠绒毛萎缩、上皮细胞大量坏死并脱落(图 6-C)。脾脏表现为组织充血、水肿(图 6-E),正常结构消失,部分感染者脾实质存在增生性结节(图 6-F)。胰腺的变化主要有内外分泌部分界不清晰、正常结构消失,出现大量的炎性细胞(图 6-H),个别个体出现胰腺间质纤维组织增生(图 6-I)。
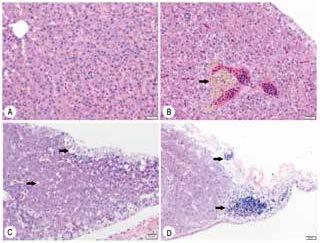
|
| 图 5 人工感染后斑马鱼肝脏的组织病理变化 A:对照组肝脏的组织学形态;B:肝脏血管周围含铁血黄素沉积(→);C:肝实质中出现空泡变性(→);D:肝脏炎性细胞增生(→);标尺:20 µm |

|
| 图 6 人工感染后斑马鱼肠道、脾脏和胰腺的组织病理变化 A、D、G:分别为对照组斑马鱼肠道、脾脏和胰腺的组织学形态;B:肠粘膜上皮细胞变性(→);C:肠绒毛萎缩、上皮细胞大量坏死并脱落(→);E:脾脏表充血、水肿;F:脾实质增生性结节(→);H:胰腺内外分泌部分界不清晰、炎性细胞增生(→);I:胰腺间质纤维组织增生(→);A-C标尺:50 µm,D-I标尺:20 µm |
将ZF4人工感染实验发病致死的斑马鱼置于无菌条件下,从肠道中再次分离细菌,并进行细菌培养和菌落鉴定,获得与原感染菌ZF4形态及生理生化特征一致的细菌。
3 讨论嗜水气单胞菌(Aeromonas hydrophila,Ah)是气单胞菌属细菌中较早的成员,是一种在水体中广泛存在的细菌,可引起鱼类及其他水产动物的多种病害,尤其对密集型养殖的水生生物危害更为严重[12]。而在实验室条件下,水生实验动物(以斑马鱼为代表)正是以密集方式养殖,微生物质量控制是评价实验动物质量的重要指标,如何有效进行微生物的检测和控制已引起科研人员的广泛关注。本研究中从发病斑马鱼体内分离到1株β溶血的革兰氏阴性短杆菌ZF4,其菌落为光滑、微凸、圆整、无色或淡黄色,有特殊芳香气味,与GB/T 18652-2002描述的一致[13]。经生物学特性和生化特性分析,初步鉴定为Ah。
Ah物种的异质性对用传统生化方法来鉴别提出了挑战[14],分子生物学方法已被普遍应用于Ah的鉴定。根据嗜水气单胞菌的16S rDNA、外膜蛋白、溶血素及丝氨酸蛋白酶基因,凌空等[15]建立了一种检测大鲵致病性嗜水气单胞菌的四重PCR法。本研究对分离菌ZF4进行了Ah的气溶素基因AHA_0438、胞外丝氨酸蛋白酶基因ASP、gyrB、16S rRNA的PCR鉴定,结果显为阳性,目的条带与阳性对照菌株的结果相符。识别Ah最准确的方法是管家基因测序[16],一般选用gyrB基因和16S rRNA[17, 18]。gyrB即促旋酶(gyrase)的B亚单位基因,普遍存在于各种细菌中,其序列具有保守性和变异性,可作为系统发育的靶标,广泛应用于以核苷酸序列为基础的细菌分类及鉴别研究中[19]。此外,gyrB基因是否发生突变是在进行研制Ah有效的疫苗时重点关注的[20]。以16S rRNA为目的基因的PCR鉴定方法最为成熟,Ah能在16S rRNA基因扩增区得到有效扩增,而非气单胞菌属的菌株,在此扩增区都为阴性[21]。本研究选取了保守基因gyrB及16S rRNA对分离菌株ZF4进行同源性分析。结果显示,gyrB基因及16S rRNA基因扩增产物的同源性与GenBank中登录的其他Ah的同源性在分别在93.4%与97.7%以上。从构建的系统发育上可以看出,无论是基于gyrB基因还是16S rRNA基因的序列,聚类分析结果均显示分离菌株ZF4与Ah聚为一簇。由此可以从分子水平确定分离的ZF4为Ah。
Ah感染临床上以急性出血性败血症为主要特征,慢性感染则主要表现为皮肤溃疡或肠炎[13]。杜雄伟等[22]通过人工感染实验表明,嗜水气单胞菌可使剑尾鱼产生败血症,组织病理学变化以全身溶血性贫血和广泛的组织细胞变性、坏死为主,各脏器均发生变质性病变。徐祥等[23]对Ah感染的杂交鲟进行了组织病理学研究,患病杂交鲟鳃丝腐烂、色浅或呈紫黑色,腹腔壁及内脏器官可见出血斑;肝、肾、脾等内脏器官均有组织病理变化。本研究选取健康的野生型斑马鱼进行了Ah人工感染致病性实验,旨在确定Ah对斑马鱼的致病力以及组织病理学变化。Ah人工感染的斑马鱼出现病变、死亡,组织病理学研究发现,斑马鱼的主要器官(包括肝脏、肠道、脾脏、胰腺)均有明显的病理变化,典型症状为肝脏组织变性、肠道内膜脱落、脾脏充血。由此可见,斑马鱼对Ah菌株敏感,易病变。
4 结论从患病斑马鱼体内分离的致病菌株鉴定为致病性嗜水气单胞菌,且人工感染后致病力和组织病理学研究显示斑马鱼对该菌敏感,因此斑马鱼可作为研究嗜水气单胞菌的动物模型。
| [1] | 陆承平. 致病性嗜水气单胞菌及其所致鱼病综述. 水产学报 , 1992, 16 (3) : 282–288. |
| [2] | 杨守明, 王民生. 嗜水气单胞菌及其对人的致病性. 疾病控制杂志 , 2006, 10 (5) : 511–514. |
| [3] | Natrah FM, Pawar S, Alam MI, et al. The impact of quorum sensing on the virulence of Aeromonas hydrophila and Aeromonas salmonicida towards burbot(Lota lota L. )larvae. Vet Microbiol , 2012, 159 (1-2) : 77–82. DOI:10.1016/j.vetmic.2012.03.014 |
| [4] | Meng S, Wang Y, Liu D, et al. Development of cross-priming amplification assays for rapid and sensitive detection of Aeromonas hydrophila. Lett Appl Microbiol , 2015, 61 (2) : 171–178. DOI:10.1111/lam.2015.61.issue-2 |
| [5] | Sechi LA, Deriu A, Falchi MP, et al. Distribution of virulence genes in Aeromonas spp. isolated from Sardinian waters and from patients with diarrhoea. J Appl Microbiol , 2002, 92 (2) : 221–227. DOI:10.1046/j.1365-2672.2002.01522.x |
| [6] | Janda JM, Abbott S L. Evolving concepts regarding the genus Aeromonas: an expanding Panorama of species, disease presentations, and unanswered questions. Clin Infect Dis , 1998, 27 (2) : 332–344. DOI:10.1086/cid.1998.27.issue-2 |
| [7] | Wang G, Clark G, Liu C, et al. Detection and characterization of the hemolysin genes in Aeromonas hydrophila and Aeromonas sobria by multiplex PCR. J Clin Microbiol , 2003, 41 (3) : 1048–1054. DOI:10.1128/JCM.41.3.1048-1054.2003 |
| [8] | 饶静静, 李寿崧, 黄克和, 等. 致病性嗜水气单胞菌多重PCR检测方法的建立. 中国水产科学 , 2007, 14 (5) : 749–755. |
| [9] | 付乔芳, 邱军强, 胡鲲, 等. 嗜水气单胞菌国内分离株的毒力因子分布与致病性相关性分析. 生物学杂志 , 2011, 28 (6) : 53–57. |
| [10] | Chopra AK, Houston CW, Peterson JW, et al. Cloning, expression, and sequence analysis of a cytolytic enterotoxin gene from Aeromonas hydrophlia. Canadian Journal of Microbiology , 1993, 39 (5) : 513–523. DOI:10.1139/m93-073 |
| [11] | 李莲瑞, 罗红斌, 卢强, 等. 嗜水气单胞菌Aer毒素的研究进展. 塔里木大学学报 , 2004, 16 (3) : 46–50. |
| [12] | 张晓君, 陈翠珍, 房海. 草鱼肠炎嗜水气单胞菌分离株的主要特性及系统发育学分析. 中国人兽共患病学报 , 2006, 22 (4) : 334–337. |
| [13] | 中华人民共和国农业部. GB/T 18652-2002, 致病性嗜水气单胞菌检验方法[S]. 北京: 中华人民共和国国家标准出版社, 2002. |
| [14] | Persson S, Al-Shuweli S, Yapici S, et al. Identification of clinical aeromonas species by rpoB and gyrB sequencing and development of a multiplex PCR method for detection of Aeromonas hydrophila, A. caviae, A. veronii, and A. media. J Clin Microbiol , 2015, 53 (2) : 653–666. DOI:10.1128/JCM.01963-14 |
| [15] | 凌空, 诗华, 金娟, 等. 一种检测大鲵致病性嗜水气单胞菌的四重PCR法. 生物技术通讯 , 2014, 9 : 201–207. |
| [16] | Shin HB, Yoon J, Lee Y, et al. Comparison of MALDI-TOF MS, housekeeping gene sequencing, and 16S rRNA gene sequencing for identification of Aeromonas clinical isolates. Yonsei Med J , 2015, 56 (2) : 550–555. DOI:10.3349/ymj.2015.56.2.550 |
| [17] | Abu-Elala N, Abdelsalam M, Marouf S, et al. Comparative analysis of virulence genes, antibiotic resistance, and gyrB based phylogeny of motile Aeromonas species isolates from Nile tilapia and domestic fowl. Lett Appl Microbiol , 2015, 61 (5) : 429–436. DOI:10.1111/lam.12484 |
| [18] | Ghenghesh KS, Ahmed SF, Cappuccinelli P, et al. Genospecies and virulence factors of Aeromonas species in different sources in a North African country. Libyan J Med , 2014, 9 : 25497. |
| [19] | 侯晓丽, 陈智. 分类及鉴别细菌的新靶标——gyrB基因. 国外医学(流行病学传染病学分册) , 2005, 32 (1) : 38–41. |
| [20] | Pridgeon JW, Yildirim-Aksoy M, Klesius PH, et al. Identification of gyrB and rpoB gene mutations and differentially expressed proteins between a novobiocin-resistant Aeromonas hydrophila catfish vaccine strain and its virulent parent strain. Vet Microbiol , 2013, 166 (3-4) : 624–630. DOI:10.1016/j.vetmic.2013.07.025 |
| [21] | 潘晓艺, 沈锦玉, 郝贵杰, 等. 气单胞菌和嗜水气单胞菌双重PCR检测方法的建立. 华中农业大学学报 , 2011, 30 (6) : 759–763. |
| [22] | 杜雄伟, 常藕琴, 王晓辉, 等. 嗜水气单胞菌对剑尾鱼的致病性及组织病理学研究. 长江大学学报: 自然科学版 , 2005, 2 (2) : 53–56. |
| [23] | 徐祥, 李华, 叶仕根, 等. 杂交鲟嗜水气单胞菌病的组织病理学研究. 大连海洋大学学报 , 2014, 29 (3) : 227–231. |





