原生质体的制备是丝状真菌遗传操作中较为重要的环节[1]。原生质体广泛应用于菌株生理、生化研究[2];应用原生质体融合技术可进行遗传育种和菌种改造[3, 4];原生质体转化技术可用于基因敲除和外源基因的导入等遗传操作[5]。而这些技术的关键是制备一定数量再生率较高的原生质体。
随着丝状真菌在工业酶生产中的应用及其基础研究的快速发展,丝状真菌高效原生质体制备方法的研究也与日俱增。通常情况下,酶解细胞壁所用的酶组成[6]、酶浓度和酶解时间[7],菌丝的菌龄、渗透压稳定剂[8]等都是制备高质量原生质体需优化的因素。获得一定数量(≥1.0×106个/mL)原生质体后,其高效再生率对于原生质体转化和原生质体融合等遗传操作也至关重要。系统优化原生质体制备或(和)再生条件后,立枯丝核菌(Rhizoctonia solani)[9]原生质体再生率不到50%,短密青霉(Penicillium brevicompactum)[10]和深黄被孢霉(Mortierella isabellina)[11]原生质体再生率只达到约25%,大部分真菌原生质体再生率都较低,一定程度上制约了其在遗传操作中的应用。而应用较为广泛的木霉,其原生质体再生率也较低,哈茨木霉(Trichoderma harzianum)[12, 13]最适菌龄为15 h以上且再生率低于50%,绿色木霉(Trichoderma viride)[13-15]最适菌龄则多为24 h,原生质体再生率不到35%。因此,优化木霉原生质体制备条件,提高其再生率并缩短原生质体制备周期,对木霉进行遗传改造显得极其重要。
深绿木霉(Trichoderma atroviride)菌株HP35-3是本实验室从原始森林筛选获得的对结晶纤维素(Avicel)降解能力与美国工业生产菌株Trichoderma reesei Rut-C30相当的丝状真菌[16]。为了便于对T. atroviride HP35-3进行遗传改造以进一步提高其纤维素酶产量,本研究对深绿木霉的原生质体制备条件进行了优化并建立了其高效的PEG介导原生质体转化体系。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒深绿木霉(Trichoderma atroviride HP35-3)菌株[16]为本实验室保存,为广西花坪自然保护区采集得到的野生深绿木霉菌株。
用于验证原生质体转化效率的质粒pESAY-kanr,具有kanr筛选标记,转化后使得转化子具有G418抗性,该质粒由本实验室构建和保存。
1.1.2 工具酶和试剂工具酶:蜗牛酶(Snailase),溶菌酶(Lysozyme enzyme),纤维素酶(Cellulase)购自solarbio公司,裂解酶(Lysing enzyme)购自Sigma公司。试剂:抗生素G418购于Solarbio公司。培养基PDA购自碧迪医疗器械(上海)有限公司。其他培养基配制及原生质体制备所需试剂均为国药分析纯。
1.1.3 培养基和所需溶液(1)产孢培养基:称取200 g马铃薯,切碎后煮沸约40 min,使用8层纱布过滤取滤液,定容至1 L,分装每200 mL至加有4 g葡萄糖、0.2 g酵母提取物和1.5 g琼脂的500 mL三角瓶中,121℃,20 min灭菌备用。(2)菌丝生长液体培养基CM:50 mL 20×硝酸盐(NaNO3 120 g/L,KCl 10.4 g/L,MgSO4.7H2O 10.4 g/L,KH2PO4 30.4 g/L),微量元素1 mL(ZnSO4.7H2O 22 g/L,H3BO3 11 g/L,MnCl2.4H2O 5 g/L,FeSO4.7H2O 5 g/L,CoCl2.6H2O 1.7 g/L,CuSO4.5H2O 1.6 g/L,Na2MoO4.2H2O 1.5 g/L,Na4EDTA 50 g/L),复合维生素1 mL(Biotin 0.1 g/L,PABA 0.1 g/L,Pyridoxin 0.1 g/L,Riboflavin 0.1 g/L,Thiamine 0.1 g/L,Nicotinic 0.1 g/L),D-葡萄糖10 g,蛋白胨2 g,酵母提取物1 g,酸水解酪蛋白1 g,水补足1 L,自然pH。(3)原生质体再生培养基OCM:酸水解酪蛋白1 g,酵母提取物1 g,蔗糖342 g,琼脂15 g,水补足1 L,自然pH。(4)筛选培养基PDA:主要成分为马铃薯淀粉4 g/L,葡萄糖20 g/L,琼脂15 g/L。
溶液参照相关文献[17]配制:(1)0.6 mol/L MgSO4.7H2O,用于收集菌丝后清洗菌丝。(2)OM(1.2 mol/L MgSO4.7H2O,10 mmol/L NaH2PO4,pH 5.8),用于溶解所选用的酶,形成所需酶解液。(3)Trapping Buffer(0.4 mol/L Sorbitol,0.1 mol/L Tris-HCl,pH7.0),在菌体形成原生质体后,滴加至酶解液中,离心时形成密度梯度使得原生质体悬浮于酶解液与Trapping Buffer之间。(4)1 mol/L Sorbitol,清洗原生质体。(5)STC(1 mol/L Sorbitol,0.1 mol/L Tris-HCl,0.1 mol/L CaCl2,pH8.0),清洗并保存原生质体。(6)PTC(40% PEG6000,0.1 mol/L Tris-HCl、0.1 mol/L CaCl2,pH8.0),保存原生质体
1.2 方法 1.2.1 菌丝的培养深绿木霉菌株T. atroviride HP35-3在产孢培养基上28℃培养6-7 d,收集孢子并用0.1%(W/V)Tween-80的灭菌水制备孢子悬浮液(108个/mL)。接种2 mL浓度为1×108个/mL新鲜孢子悬浮液于200 mL CM中,在28℃,180 r/min振荡培养。
1.2.2 酶解液的配制称取适量的蜗牛酶、溶解酶、裂解酶、纤维素酶及其互配的酶组分,溶解于6 mL体积的OM中,振荡摇匀约30 min,0.22 μm滤膜过滤除菌备用。
1.2.3 原生质体制备将在CM中培养10 h的深绿木霉通过离心收集菌丝,使用0.6 mol/L MgSO4.7H2O清洗两次,称取0.1 mg湿重菌丝放入5 mL酶解液中,使用50 mL三角瓶盛放(加入少许的玻璃球用来打散菌丝),并使用移液器吹打使得菌丝尽量分开,在28℃,180 r/min振荡酶解。酶解结束后,使用血球计数板计算原生质体产量。将酶解液倒入灭菌的50 mL离心管中,置于冰上,用巴氏吸管逐滴滴加Trapping Buffer至2倍体积的酶解液,在4℃,3 500 r/min离心30 min。离心结束后用巴氏吸管将悬浮于酶解液与Trapping Buffer之间的原生质体层吸出并放入干净的15 mL离心管,加入15 mL的1 mol/L Sorbitol清洗原生质体,重复一次。接着使用STC清洗两次后,按STC∶PTC为4∶1(V/V)比例重悬原生质体,吸取每100 μL分装于1.5 mL EP管中,即为深绿木霉原生质体悬浮液,可用于原生质体的再生与转化。
1.2.4 原生质体再生原生质体再生采用涂布法,首先在显微镜下用血球计数板对原生质体悬浮液进行计数,取100 μL原生质体悬浮液用STC进行适当稀释,以OCM作为再生培养基,吸取100 μL稀释好的悬浮液涂布于培养基上。置于28℃培养箱培养36 h,对形成的菌落进行计数(A)。为消除未除尽的菌丝片段或是萌发较晚的孢子再生出菌落所造成的误差,同时采用涂布法,将原生质体悬浮液用灭菌水进行等梯度稀释,并涂布于PDA培养基,其再生菌落数作为对照(B)。显微镜下观察的原生质体数计为(C)。再生率计算:原生质体再生率=[(A-B)/C]×100%[18]。
1.2.5 原生质体转化取100 μL原生质体悬浮液,加入适量的DNA,加入6 μL100 mmol/L的亚精胺混匀,冰浴30 min,然后缓缓加入1 mL PTC,混匀后,室温放置25 min,再加入2 mL STC并混匀,最后将混合物倒入20 mL已融化并于55℃温浴的OCM中,上下轻轻颠倒混匀后,按每个2-3 mL量倒到干净的培养皿中,室温放置1 h。
1.2.6 转化子的筛选及验证将上述在培养皿中再生约1 h的原生质体,在其OCM上层覆盖含200 μg/mL G418的PDA。在28℃培养箱中静置培养约3 d,培养基表面生长的菌落即为转化子。
使用牙签将培养基表面的单菌落挑取适量的菌丝于1.5 mL EP管中,加入适量的液氮并研磨成粉末,使用酚氯仿抽取的方法提取转化子的基因组DNA,并使用引物G418F(5'AGAAGATGATATTGAAGGA-GCATT3')和G418R(5'CTAGAAAGAAGGATTAC-CTCT3')进行PCR验证。
PCR体系及参数设置:2×Easy Tag Mix 12.5 μL,引物G418F和G418R各1 μL,DNA模板1 μL,ddH2O 9.5 μL,共25 μL体系。参数为95℃,预变性5 min;95℃,变性30 s;55℃,退火15 s;72℃,延伸90 s;25个循环后,72℃延伸10 min。
2 结果 2.1 不同酶组分对T. atroviride HP35-3原生质体产量影响选常用的商业化水解酶蜗牛酶、裂解酶、纤维素酶和溶菌酶来制备不同酶组分的酶解液。取生长10 h湿重为1 mg菌丝至5 mL酶解液中,28℃,180 r/min酶解2 h,检测所产生的原生质体数量,结果如表 1所示。单独使用纤维素酶(c组)酶解菌丝无原生质体产生,其他组的酶解液酶解菌丝后都能产生原生质体,其中3 mg/mL蜗牛酶、3 mg/mL溶菌酶和3 mg/mL裂解酶(i组)产生的原生质体量最多,因此选用i组酶解液进行后期的原生质体制备。
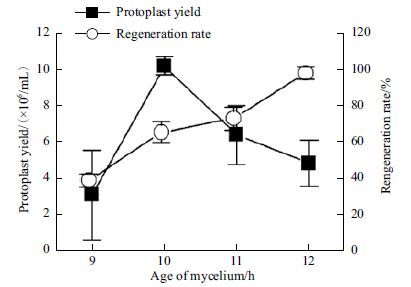
为了考察菌龄对原生质体产量和再生率的影响,接种2 mL浓度为1×108个/mL的T. atroviride HP35-3孢子悬浮液至200 mL的CM培养基中,置于28℃,180 r/min的恒温摇床培养24 h,取9、10、11、12和24 h的培养液镜检以观察菌丝生长情况,并用i组酶解液酶解不同菌龄的菌丝(湿重为1 mg)。图 1所示,随着培养时间的延长,孢子萌发、菌丝变长分叉、菌丝量不断增加;经酶解后,菌龄为9、10 h的菌丝完全被酶解并释放出原生质体;菌龄为11、12 h的菌丝还残余部分菌丝;24 h菌龄的菌丝几乎没有被酶解,基本无原生质体产生。菌龄为10 h的菌丝经酶解后释放的原生质体数量最多,再生率达到了60%以上(图 2),故产生原生质体数量和质量最适的菌丝菌龄为10 h。

|
| 图 1 菌龄对原生质体制备的影响 a:菌龄9 h的菌丝;b:菌龄9 h菌丝酶解2 h产生的原生质体;c:菌龄10 h的菌丝;d:菌龄10 h菌丝酶解2 h产生的原生质体;e:菌龄11 h的菌丝;f:菌龄11 h菌丝酶解2 h产生的原生质体;g:菌龄12 h的菌丝;h:菌龄12 h菌丝酶解2 h产生的原生质体;i:菌龄24 h的菌丝;j:菌龄24 h菌丝酶解2 h产生的原生质体 |
|
| 图 2 菌龄对原生质体产量及再生的影响 |
利用i组酶解液对菌龄为10 h的菌丝(1 mg湿重)分别进行1 h、2 h、3 h和4 h酶解,结果如图 3所示。酶解1 h时,有较多的原生质体产生,但菌丝体并没有完全酶解;酶解2 h时,反应体系中基本没有菌丝体,原生质体数量最多;酶解3 h和4 h时,原生质体数量锐减,部分原生质体已被降解。菌丝酶解2 h时,制备的原生质体产量(1.5×107个/mL)和再生率均达到最高(69%)(图 4)。因此,制备T.atroviride HP35-3原生质体的最佳酶解反应条件为:利用3 mg/mL蜗牛酶、3 mg/mL溶菌酶、3 mg/mL裂解菌酶组分,取菌龄10 h的菌丝,酶解2 h。

|
| 图 3 酶解时间对原生质体制备的影响 a:菌龄10 h菌丝酶解1 h产生的原生质体;b:菌龄10 h菌丝酶解2 h产生的原生质体;c:菌龄10 h菌丝酶解3 h产生的原生质体;d:菌龄10 h菌丝酶解4 h产生的原生质体 |

|
| 图 4 酶解时间对原生质体产量及再生的影响 |
原生质体只有具备高效再生率才便于遗传转化。将优化条件下酶解得到的原生质体置于再生培养基OCM中培养36 h,其再生率达到69%。
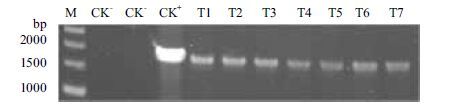
2.4 原生质体的转化效率为了验证所制备原生质体的转化效率,将带有kanr筛选标记的外源DNA片段经PEG介导转化至T. atroviride HP35-3的原生质体中。当原生质体数量为108个/mL,外源DNA片段为5 μg时,转化率最高达到35个转化子/μg DNA(表 2)。随机挑选其中7个转化子提取基因组DNA并PCR验证外源DNA片段是否整合至转化子的基因组中,这7个转化子基因组中均有目的片段的扩增条带(图 5),为阳性转化子。将其中3个阳性转化子在无抗性培养基中连续传代5次,PCR验证均检测到目的片段,表明外源DNA进入深绿木霉原生质体并得到稳定传代。
|
| 图 5 PCR验证转化子 M:DNA Marker;CK-:分别以ddH2O和野生型深绿木霉DNA为模板扩增产物;CK+:以质粒pESAY-kanr为模板扩增产物;T1-T7:以转化子DNA为模板扩增产物 |
原生质体的制备是丝状真菌遗传操作中较为重要的环节[1]。丝状真菌原生质体的制备技术虽然比较成熟,相关的文献报道也较多[19, 20],但由于菌株间细胞壁成分存在差异,即便使用同一方法制备原生质体,对于不同菌株取得的效果也不尽相同。因此,针对不同的丝状真菌,必须对酶解反应体系pH、渗透压稳定剂、酶组分、酶浓度、酶解时间和菌龄等条件进行优化[7, 21, 22],以确定原生质体制备的最佳条件。通常情况下,较中性或碱性条件,弱酸性(pH5.8)环境更有益于高质量真菌原生质体的制备[22]。渗透压会影响原生质体的释放、再生率及其结构的完整性,而对丝状真菌原生质体而言,无机盐溶剂0.6 mol/L MgSO4.7H2O是较好的渗透压稳定剂[20]。因此,将酶解体系中的缓冲体系和渗透压稳定剂分别定为OM溶液(1.2 mol/L MgSO4.7H2O,10 mmol/L NaH2PO4,pH 5.8)和0.6 mol/L MgSO4.7H2O,检测了不同酶组分、菌龄、酶解时间对深绿木霉原生质体制备产量和再生率的影响。
相对于单一酶,几种酶配合使用时酶解T. atroviride HP35-3菌丝产生原生质体的数量较多,最佳的酶组分为:3 mg/mL蜗牛酶、3 mg/mL溶菌酶、3 mg/mL裂解酶。张晓立等[23]的研究也发现类似结果,黑曲霉原生质体得率与酶解体系组成及配比关系密切,利用酶的混合液制备原生质体比单独使用一种酶的效果好。优化酶组分后,一定程度上减少了原生质体制备过程中酶的添加量,本研究中用于制备T. atroviride原生质体的酶浓度均较低为3 mg/mL,Feng等[9]制备立枯丝核菌(Rhizoctonia solani)原生质体所用酶的最低浓度为5 mg/mL,You等[14]制备绿色木霉(Trichoderma viride)原生质体所用酶量为10 mg/mL。
丝状真菌菌龄对于原生质体的制备至关重要,酶解过程中,年轻的菌丝体比较老的菌丝体能更有效的释放原生质体,这可能是因为年轻菌丝对细胞壁裂解酶的作用更敏感[24],且减少菌丝培养时间可利于缩短原生质体的制备周期。Tmova等[25]发现,选用菌龄为15-18 h的绿色木霉(Trichoderma viride)菌丝制备原生质体所得的数量最多。哈茨木霉(Trichoderma harzianum)和长梗木霉(Trichoderma longibrachiatum)[26]制备原生质体的最适菌龄分别为18和24 h。也有报道发现水稻纹枯病菌(Rhizoctonia solani)[7]、普尔顶粘束孢(Graphium putredinis)和哈茨木霉(T. harzianum)[22]制备原生质体的最适菌龄均为24 h,而刺糙青霉(Penicillium echinulatum)[3]的为48 h。这些研究表明,不同真菌尽管同是木霉属,菌种间制备原生质体的最适菌龄也存在较大差异。本研究发现,对于T. atroviride HP35-3而言,菌龄10 h的菌丝体制备的原生质体效果最佳,超过该菌龄(特别是菌龄为24 h)的菌丝原生质体产量下降,这可能是因为培养时间过长菌丝较长分叉较多易于结团,导致酶解液无法充分接触结球菌丝,酶解不完全;也可能是由于菌丝老龄化其细胞壁组成成分比例发生变化,酶解液无法有效降解细胞壁。相较于哈茨木霉(T. harzian-um)[13, 26]最适菌龄为16 h和18 h、绿色木霉(Tr-ichoderma viride)[14, 15]最适菌龄为24 h,T. atrovi-ride HP35-3最适菌龄则为10 h,时间缩短6 h以上,并且原生质体产量提高了约2倍,再生率也提高了约30%。
酶解菌丝的时间,会影响原生质体的产量及质量,酶解时间太短,菌丝酶解不完全,释放的原生质体数量少,而原生质体的浓度又会影响其转化效率;酶解时间太长,释放的原生质体会被酶解破裂,导致原生质体的质量较差,影响原生质体的再生。本研究发现,对于菌龄10 h的T. atroviride HP35-3菌丝,酶解2 h制备的原生质体产量和再生率最高,酶解时间比Balasubramanian 等[13]、You等[14]和Savitha等[23]制备木霉原生质体至少缩短1 h。
4 结论本研究确立了深绿木霉T. atroviride HP35-3原生质体制备和转化最佳条件:利用3 mg/mL蜗牛酶、3 mg/mL裂解酶和3 mg/mL溶菌酶酶组分酶解菌龄10 h的菌丝2 h,获得的原生质浓度达到3.5×107个/mL以上,原生质体再生率为61%。当原生质体数量为108个/mL,外源DNA片段为5 μg时,PEG介导转化率达到35个转化子/μg DNA。因此,所建立的高效原生质体制备及转化体系可用于深绿木霉的遗传转化及菌株改造。
| [1] | 刘士旺, 王政逸, 郭泽建. 绿色木霉的原生质体制备与转化条件. 农业生物技术学报 , 2004, 12 (1) : 96–101. |
| [2] | Prabavathy VR, Mathivanan N, Sagadevan E, et al. Self-fusion of protoplasts enhances chitinase production and biocontrol activity in Trichoderma harzianum. Bioresource Technology , 2006, 97 (18) : 2330–2334. DOI:10.1016/j.biortech.2005.10.031 |
| [3] | Dillon AJP, Camassola M, Henriques JAP, et al. Generation of recombinants strains to cellulases production by protoplast fusion between Penicillium echinulatum and Trichoderma harzianum. Enzyme and Microbial Technology , 2008, 43 (6) : 403–409. DOI:10.1016/j.enzmictec.2008.07.009 |
| [4] | Lee KM, Yu J, Son M, et al. Transmission of Fusarium boothii mycovirus via protoplast fusion causes hypovirulence in other phytopathogenic fungi. PLoS One , 2011, 6 (6) : e21629. DOI:10.1371/journal.pone.0021629 |
| [5] | Jiang D, Zhu W, Wang Y, et al. Molecular tools for functional genomics in filamentous fungi: recent advances and new strategies. Biotechnology Advances , 2013, 31 (8) : 1562–1574. DOI:10.1016/j.biotechadv.2013.08.005 |
| [6] | De BC, Wiebenga A, Aguilar G, et al. An enzyme cocktail for efficient protoplast formation in Aspergillus niger. Journal of Microbiological Methods , 2009, 76 (3) : 305–306. DOI:10.1016/j.mimet.2008.11.001 |
| [7] | Liu TH, Lin MJ, Ko WH. Factors affecting protoplast formation by Rhizoctonia solani. New Biotechnology , 2010, 27 (1) : 64–69. DOI:10.1016/j.nbt.2009.08.009 |
| [8] | Patil NS, Jadhav JP. Penicillium ochrochloron MTCC 517 chitinase: An effective tool in commercial enzyme cocktail for production and regeneration of protoplasts from various fungi. Saudi Journal of Biological Sciences , 2015, 22 (2) : 232–236. DOI:10.1016/j.sjbs.2014.09.022 |
| [9] | Feng HT, Sun ZG, Li HJ, et al. Preparation, purification and regene-ration optimizing research of protoplasts from Rhizoctonia solani. African Journal of Microbiology Research , 2012, 6 (13) : 3222–3230. |
| [10] | 任志红, 苏彩云, 闫敬, 等. 霉酚酸产生菌原生质体转基因方法的建立. 微生物学 , 2013, 53 (11) : 1226–1232. |
| [11] | 徐新丽, 谢必峰. 深黄被孢霉3. 3410原生质体的制备和再生研究. 生物技术 , 200+, 19 (2) : 46–48. |
| [12] | Tschen SM, Li IF. Optimization of formation and regeneration of protoplasts from biocontrol agents of Trichoderma species. Mycoscience , 1994, 35 (3) : 257–263. DOI:10.1007/BF02268447 |
| [13] | Balasubramanian N, Lalithakumari D. Characteristics of protoplast inter, intra-fusant and regeneration of antagonistic fungi Trichoderma harzianum and Trichoderma viride. African Journal of Biotechnology , 2008, 7 (18) : 3235–3243. |
| [14] | You YR, Liu SW, Wu YF, et al. The Transformation in Trichoderma viride protoplasts by restriction enzyme mediated integration(RE-MI). Advanced Materials Research , 2012, 518-523 : 545–548. DOI:10.4028/www.scientific.net/AMR.518-523 |
| [15] | 黄玉茜, 刘根, 程根武, 等. 木霉菌T23菌株原生质体制备及再生研究. 上海交通大学学报: 农业科学报 , 2005, 23 (3) : 303–307. |
| [16] | Zhang Z, Liu JL, Lan JY, et al. Predominance of Trichoderma and Penicillium in cellulolytic aerobic filamentous fungi from subtropical and tropical forests in China, and their use in finding highly efficient beta-glucosidase. Biotechnology for Biofuels , 2014, 7 (1) : 1–14. DOI:10.1186/1754-6834-7-1 |
| [17] | Churchill ACL, Ciuffetti LM, Hansen DR, et al. Transformation of the fungal pathogen Cryphonectria parasitica with a variety of heterologous plasmids. Current Genetics , 1989, 17 (1) : 25–31. |
| [18] | 吕天晓, 徐凤花, 李世贵, 等. 生防木霉菌原生质体的制备及再生研究. 生物技术通报 , 2009 (4) : 130–134. |
| [19] | Cartwright GM, Tanaka A, Eaton CJ, et al. Formation of arthrocon-idia during regeneration and selection of transformed Epichloe festucae protoplasts. Fungal Biology , 2014, 118 (5-6) : 462–471. DOI:10.1016/j.funbio.2014.03.004 |
| [20] | 卢明, 张月杰. 丝状真菌AL18的原生质体制备和再生条件的优化. 生物技术 , 2012, 22 (3) : 86–89. |
| [21] | Balasubramanian N, Juliet GA, Srikalaivani P, et al. Release and regeneration of protoplasts from the fungus Trichothecium roseum. Canadian Journal Microbiology , 2003, 49 (4) : 263–268. DOI:10.1139/w03-034 |
| [22] | Savitha S, Sadhasivam S, Swaminathan K. Regeneration and mole-cular characterization of an intergeneric hybrid between Graphium putredinis and Trichoderma harzianum by protoplasmic fusion. Biotechnology Advances , 2010, 28 (3) : 285–292. DOI:10.1016/j.biotechadv.2009.12.007 |
| [23] | 张晓立, 郑小梅, 满云, 等. 黑曲霉柠檬酸工业菌株原生质体制备与转化. 生物技术通报 , 2015, 31 (3) : 171–177. |
| [24] | Villanueva JR, Acha G. Chapter XXIV Production and use for fungal protoplast. Methods in Microbiology , 1971, 4 : 666–718. |
| [25] | Tamova G, Betina V, Farkas V. An efficient method for the preparation of protoplasts from Trichoderma viride. Folia Microbiologica , 1993, 38 (3) : 214–218. DOI:10.1007/BF02814380 |
| [26] | Mrinalini C, Lalithakumari D. Integration of enhanced biocontrol efficacy and fungicide tolerance in Trichoderma spp. by electrofusion. Journal of Plant Diseases and Protection , 1998, 105 (1) : 34–40. |






