2. 东北林业大学盐碱地生物资源环境研究中心,哈尔滨 150040
2. Alkali Soil Natural Environmental Science Center, Northeast Forestry University, Harbin 150040
芥子油苷是一种广泛存在于十字花科植物中的次级代谢产物[1],目前已发现的种类数量超过120种[2]。一般是由β-D-硫葡萄糖基、硫化肟基团和一源自氨基酸的侧链组成[3],其水解产物具有抵御病虫害、形成独特风味以及阻遏癌症等作用[4-6]。但由于其本身是一种相对稳定的物质,故其大部分生物功能都是靠硫代葡萄糖苷酶—黑芥子酶系统经降解作用来实现的[7]。这一系统又被称为芥子油弹[8],通常情况下芥子油苷与黑芥子酶存储在植物细胞的不同位置,芥子油苷储存于液泡内,而黑芥子酶则储存于细胞质基质。当植物遭受到外来损伤时,两者之间的隔离遭到破坏继而两者相遇发生反应[9],无毒的芥子油苷被黑芥子酶降解成不稳定的中间产物硫代氢肟酸磺酸酯,在不同的条件下转化成不同的终产物[10],由这些产物行使不同的生物学功能[11]。
黑芥子酶是一类内源性β-葡萄糖苷酶,是一种典型的糖基化酶,属于目前已知的135个糖苷水解酶家族之一[12]。根据已有的报道,拟南芥体内编码黑芥子酶的基因主要包括7种:TGG1、TGG2、TGG3、TGG4、TGG5、TGG6及PEN2。通过氨基酸序列的对比分析,发现TGG1与TGG2相似性很高,而TGG4与TGG5相似性极高,PEN2与经典黑芥子酶基因(TGGs)差异较大,相似性都低于50%,其中TGGs主要响应机械损伤对植物带来的伤害,而PEN2则主要负责应对病原菌的入侵[13],且只作用于吲哚族芥子油苷[14]。目前拟南芥基因组中6个经典黑芥子酶基因所在的染色体位置已得到确认,其中,TGG1、TGG2和TGG3位于染色体V上,TGG4、TGG5和TGG6三个基因则位于染色体I上[15]。宏观组织定位结果显示,TGG1和TGG2在植物的地上部分表达,TGG4和TGG5则在地下部位表达[16],TGG3与TGG6是在花中特异性表达的假基因[17-19]。在黑芥子酶基因家族中,TGG1的表达量最多且表达范围最广,是最为重要的一个黑芥子酶基因。近年来有研究指出,TGG1的功能并不仅仅局限于水解芥子油苷,还与气孔的发育和调控有关[20],气孔是调节植物体内水分运动和保存的关键因素[21, 22],气孔的闭合与开度的减小能降低植物体内水分的损失从而增强植物对干旱胁迫的承受能力[23]。当植物受到干旱胁迫时,脱落酸(ABA)被干旱诱导而大量积累[24],作为激素信号调控气孔开度[25, 26],有研究表明TGG1处于脱落酸(ABA)和茉莉酸甲酯(MeJA)调控气孔关闭的信号途径的下游,且与TGG2存在功能冗余,在tgg1tgg2双缺失的情况下气孔不能闭合[27]。因此推测,TGG1也有可能参与调节植物对干旱胁迫的应答,尽管已有研究证实TGG1处于ABA诱导气孔关闭信号途径的关键位置,但过量表达TGG1在植物对干旱胁迫的耐受性方面的影响尚没有实验证明。为了验证这个假设,本研究构建了35S:TGG1过表达载体,利用农杆菌介导法转化拟南芥获得TGG1过表达植株,同时以野生型植株和35S:TGG1植株为实验材料,进行了干旱胁迫处理,分析了不同基因型植物对干旱胁迫的抗性差异。以往对于芥子油苷的研究往往局限在抗病抗虫的方面,而对其在非生物胁迫中所起的作用缺失直接的证据,本研究旨在证明芥子油苷的水解酶基因TGG1参与植物的干旱应答,以期为TGG1参与干旱胁迫的假设提供数据支持。
1 材料与方法 1.1 材料 1.1.1 植物材料野生型拟南芥(哥伦比亚型)种子。
1.1.2 菌株与试剂大肠杆菌DH5α、农杆菌LBA4404;植物总RNA提取试剂盒(OMEGA biotek公司)、反转录试剂盒(大连宝生物工程公司)、胶回收试剂盒(Bioteke公司)、Not I和Pst I限制性内切酶、pCambia 2300 6号User载体、其余DNA Marker DL2000、dNTP、Hotmaster Taq DNA Ploymerase等购自TIANGEN公司。
1.2 方法 1.2.1 拟南芥叶片总RNA的提取和cDNA的合成取3周龄的拟南芥叶片,加入液氮充分研磨后利用OMEGA biotek公司生产的植物总RNA提取试剂盒进行叶片总RNA的提取,提取完成后用大连宝生物工程公司的反转录试剂盒将提取出的RNA反转录为cDNA,操作参看说明书。
1.2.2 拟南芥TGG1基因的克隆及测序以上述获得的cDNA为模板,5'-GGCTTAAUATGAAGCTTCTTATGCTCG-3'为上游引物序列,5'-GGTTTAAUTCATGCATCTGCAAGACTC-3'为下游引物序列进行扩增,PCR反应条件为:95℃预变性10 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min,28次循环;72℃延伸10 min。PCR产物经纯化回收后按照Nour-Eldin等[28]的方法与User载体连接,连接产物转入DH5α大肠杆菌感受态细胞中,37℃过夜培养,取PCR检测呈阳性的菌落扩大培养送交测序。
1.2.3 根癌农杆菌的转化与拟南芥的浸染选取测序结果正确的大肠杆菌菌落扩大培养,利用试剂盒提取质粒,使用冻融法将其转入感受态农杆菌。细胞悬浮液涂布在含卡那霉素100 mg/L、链霉素50 mg/L、利福平50 mg/L的YEB固体培养基上,28℃培养48 h,长出菌落后挑取菌落进行PCR验证,以检验目的基因是否转入农杆菌。选取检验呈阳性的农杆菌菌落进行扩大培养,运用花序侵染法侵染拟南芥,收获种子。
1.2.4 转化子的筛选及PCR检测收获的种子于4℃春化3 d后,对种子进行表面消毒:用6%的NaClO与无菌水以4:6的比例混合配制出消毒剂,加入盛有种子的EP管中振动4 min,倒出消毒剂并用无菌水洗涤6次,消毒后的种子播种于含卡那霉素50 mg/L的1/2MS固体培养基上,16 h光照/8 h黑暗培养5 d[光强为90 µmol/(m2·s),相对湿度为70%]后将抗性幼苗转移至蛭石与黑土比为1:1的混合土中继续培养3周,分别用相应的试剂盒提取其DNA及RNA进行分子水平的检测,利用半定量RT-PCR方法筛选TGG1过量表达的转基因植株,纯合两代后获得35S:TGG1纯合子。
1.2.5 35S:TGG1转基因幼苗抗旱性的鉴定为模拟干旱胁迫,在1/2 MS培养基中加入甘露醇,设置两个浓度,分别含150 mmol/L和250 mmol/L甘露醇。将WT,35S:TGG1两种基因型的种子经表面消毒后种在1/2 MS固体培养基上培养8 d,然后将幼苗转移到含150 mmol/ L甘露醇和250 mmol/L甘露醇的1/2 MS固体培养基上,8 d后,采用电导法测量3种幼苗的相对电导率[29]。
将消毒后的野生型与35S:TGG1的种子分别播在含0 mmol/ L和150 mmol/ L甘露醇的1/2MS固体培养基上,统计相对发芽率并比较其生长情况。
1.2.6 35S:TGG1转基因成株的抗旱性鉴定将WT,35S:TGG1两种基因型的种子消毒后种在1/2 MS固体培养基上培养8 d后移栽至黑土与蛭石比例为1:1的土壤环境中培养,每盆移5颗,培养3周后,取叶片进行离体叶片相对失水率的统计,8片叶子为一组,3次重复,统计失水速率;对干旱处理组进行停止浇水14 d的处理,至叶片呈萎缩干瘪状,复水培养7 d,观察表型,统计幼苗存活率。
1.2.7 35S:TGG1气孔的开度观察分别剪取同为3周龄的过表达植株和野生型同等位置的莲座叶,浸泡于配方为30 mmol/L KCl,0.1 mmol/L EGTA,10 mmol/L MES-KOH(pH6.15)的opening buffer中,光照2.5 h后转移至含10 μmol/L ABA,30 mmol/L KCl,0.1 mmol/L CaCl2,10 mmol/L MES-KOH(pH6.15)的溶液之中浸泡2.5 h[30]。用95%酒精定型,叶片上表面帖附于透明胶上,刀片刮去叶肉,置于光学显微镜下10倍目镜×40倍物镜进行观察。用软件Image J测量气孔长宽比,取100个气孔进行统计,以长宽比为依据衡量气孔开度的大小。
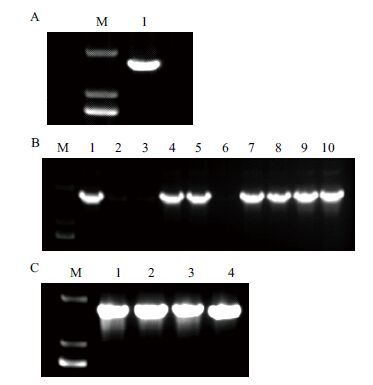
2 结果 2.1 拟南芥TGG1基因的克隆与过表达植株的获得利用RT-PCR方法扩增获得TGG1基因的CDS序列(图 1-A),经1%琼脂糖凝胶电泳检测,确定得到一段约1 600 bp长短的条带,与目的基因长度相符。扩增产物经胶回收进行纯化后,与pCambia 2300 User载体连接,获得TGG1的过表达载体,转入大肠杆菌感受态DH5α,涂布到含有100 mg/L卡那霉素的LB平板上过夜后,选取菌落进行PCR验证(图 1-B)。挑取PCR检测呈阳性的1、4、5、7、8、9、10菌落扩大培养,送交测序,测序结果用软件DNAMAN进行比对分析。将序列完全正确的7号菌落扩大培养,提取质粒转入农杆菌中,挑取菌落进行PCR验证(图 1-C),条带大小约1 600 bp,与预期结果一致。花序侵染法浸染拟南芥收获种子,经含卡那霉素50 mg/L的1/2MS固体培养基筛选,获得TGG1基因过表达植株幼苗。
|
| 图 1 TGG1的克隆 A:TGG1的克隆;1:目的条带;B:TGG1转大肠杆菌的鉴定,其中除2、3、6外均为阳性;C:TGG1转农杆菌的鉴定,1-4皆为阳性;M:DNA分子量标准(DL2000) |
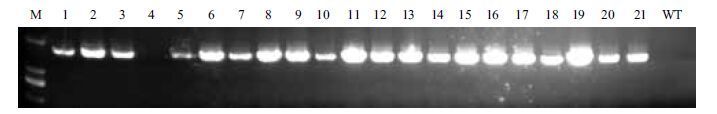
对得到的抗性苗进行分子水平上的检测,结果(图 2)显示,除4号样品为假阳性外,其余20株皆为成功转基因的植株。在载体上选取一段序列设计一端引物,在目的基因TGG1上选取一段序列设计另一端引物,提取抗性苗的总DNA进行PCR检测。
|
| 图 2 35S:TGG1转基因植株的DNA检测 M:DNA分子量标准(DL2000);1-21:样品为过表达植株;WT:同龄野生型对照, |
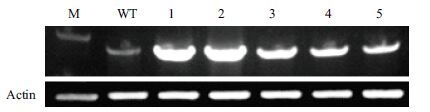
选取5株DNA水平检测呈阳性的植株进行mRNA水平上的检测,取同样生长环境下、同龄的野生型(WT)作为对照组,提取样品和对照的总RNA反转录成cDNA,用内参基因Actin进行调平,调平后进行PCR检测。结果(图 3)显示,1-5号样品亮度均显著大于野生型,证明转入的TGG1基因在拟南芥体内被成功的过表达,其中1号和2号样品表达量最高。
|
| 图 3 拟南芥TGG1基因过表达植株的RT-PCR检测 M:DNA分子量标准(DL2000);WT:同龄野生型对照,1-5:样品为过表达植株 |
将野生型和35S:TGG1的种子分别播在含有0 mmol/L 和150 mmol/L甘露醇的1/2MS培养基中,结果发现,在不含甘露醇的培养基中,两种植株均能良好地萌发,且发芽率没有显著差别。但在150 mmol/L甘露醇胁迫下,野生型几乎完全不能萌发,而35S:TGG1虽然萌发速度降低,但90%以上种子均能萌发(图 4-A)。

|
| 图 4 35S:TGG1抗旱性的变化 35S:TGG1在干旱胁迫下的相对发芽率;B:干旱胁迫下35S:TGG1与野生型幼苗的相对电导率;C:35S:TGG1离体叶片相对失水率的变化;D:离体叶片失水表型的对比;E:干旱胁迫下转基因植株的生长状况;F:干旱胁迫处理下转基因幼苗的存活率;G:10 μmol/L ABA处理后转基因叶片气孔开度的变化;H:气孔长/宽比的统计(气孔长宽/比用了代表气孔开度的大小) |
在150 mmol/L和250 mmol/L两种浓度的甘露醇模拟的干旱胁迫下,35S:TGG1幼苗的相对电导率显著低于野生型。在150 mmol/L甘露醇胁迫下35S:TGG1的相对电导率为野生型的79%;250 mmol/L甘露醇胁迫下35S:TGG1的相对电导率为野生型的90.3%(图 4-B),这说明在甘露醇模拟的干旱胁迫下,35S:TGG1幼苗的损伤程度低于野生型。
2.5 35S:TGG1成株离体叶片的相对失水率变化选取长势一致的4周龄拟南芥植株,8片叶子为一组样品测量鲜重,样品置于空气中进行自然风干,每组进行3次重复,计算失水速率。统计结果显示(图 4-C),35S:TGG1植株的离体叶片的相对失水速率显著低于野生型,5 h后叶片的干瘪程度也显著低于野生型叶片(图 4-D)。
2.6 35S:TGG1成株干旱复水后的恢复干旱处理14 d后,两种基因型的植株皆呈萎缩干瘪状,复水处理7 d之后,两种基因型中皆有一部分植株复活(图 4-E),经统计,基因型35S:TGG1的平均存活率为72%,而WT的平均存活率为42%(图 4-F),表明在干旱胁迫复水后,35S:TGG1恢复正常生长的能力明显提高。
2.7 过表达TGG1促进ABA诱导的气孔关闭未经ABA处理的情况下,野生型与35S:TGG1的气孔长/宽比没有差别,而经过ABA处理之后,35S:TGG1植株气孔的长/宽比明显大于野生型(如图 4-G,4-H),即35S:TGG1植株的气孔关闭程度显著大于野生型,由此可知过表达TGG1提高了气孔对ABA的敏感性,使ABA诱导的气孔关闭更加强烈。
3 讨论芥子油苷的代谢一直以来被认为主要与病虫害抗性相关,与非生物胁迫关系的报道较少,本研究证明了芥子油苷的降解与植物的抗旱性密切相关。以野生型及超量表达TGG1的拟南芥为实验材料,进行干旱胁迫处理,多种生理指标均显示35S:TGG1的抗旱能力强于野生型,证明超量表达TGG1可增强拟南芥对干旱的抗性。
前人研究认为,TGG1的主要作用是降解脂肪族芥子油苷,将无毒稳定的芥子油苷水解成有毒物质参与到植物对病虫害的抵御过程中去[31],而对其在非生物胁迫中所起的作用研究相对较少。以往有研究表明短链脂肪族芥子油苷能影响植物体内水的平衡与运输,从而在盐胁迫的情况下减少水分的流失起到抵御非生物胁迫的作用[32]。而本实验证明了芥子油苷的代谢不仅仅参与盐胁迫的抵御,还与植物的抗旱性密切相关,通过统计过表达植株的发芽率、相对电导率和耐旱性的变化,证明了TGG1与植物抗旱性有关的推测,得到了过表达TGG1可提高拟南芥抗旱性的结论。结合前人的研究结果,我们推测过量表达TGG1提高拟南芥抗旱性的机制有3个方面:(1)芥子油苷被降解后释放的各级水解产物可能作为渗透物质增加了细胞液的浓度,从而提高了植物的渗透势,增强了抗旱能力;(2)芥子油苷是一种富含氮硫的重要次级代谢产物[33],被TGG1水解后释放出氮硫等营养元素,而氮营养元素含量的增加会使植物体内Na+和K+等渗透调节物质含量的升高[34],进而提高植物的抗干旱能力;(3)减少失水率是提高植株耐旱性的一个主要因素,植物体内水分的散失主要通过气孔的蒸腾作用,大量证据显示,在干旱状况下,ABA会在植物体内大量积累,并引起气孔的关闭。本研究发现35S:TGG1植株的叶片经ABA处理后,气孔的关闭程度显著高于野生型,说明35S:TGG1对于ABA信号的响应更加敏感,很可能是因为在干旱胁迫下能更加迅速地关闭气孔从而表现出更高的抗旱能力。
芥子酶家族在芥子油苷代谢和植物抗病性方面发挥着重要作用,但不同芥子酶基因的功能尚未被完全认知,TGG1作为拟南芥黑芥子酶中最为重要的一种,在抵御自然界生物及非生物胁迫的过程中都起着至关重要作用,本研究证明了TGG1与植物的抗旱性有关,但具体机制尚不明确,还有待进一步的研究与证明。
4 结论本研究构建了TGG1基因的过表达载体,并成功转入拟南芥获得了稳定遗传的过表达植株纯合子,证明了TGG1基因与拟南芥抗旱能力有关,过表达TGG1可以提高植物的抗旱能力,且这种抗旱性的提高可能与气孔敏感性有关。
| [1] | Halkier BA, Gershenzon J. Biology and biochemistry of glucosinola-tes. Annu Rev Plant Biol , 2006, 57 (57) : 303–333. |
| [2] | S?nderby IE, Geu-Flores F, Halkier BA. Biosynthesis of glucosino-lates-gene discovery and beyond. Trends in Plant Science , 2010, 15 (5) : 283–290. DOI:10.1016/j.tplants.2010.02.005 |
| [3] | Wittstock U, Halkier BA. Glucosinolate research in the Arabidopsis era. Trends in Plant Science , 2002, 7 (6) : 263–270. DOI:10.1016/S1360-1385(02)02273-2 |
| [4] | Yuan P, Chen BA, Liu DL. Anticancer mechanisms and researches of isothiocyanates. Chinese Journal of Natural Medicines , 2008, 6 (5) : 325–332. |
| [5] | Navarro SL, Li F, Lampe JW. Mechanisms of action of isothiocyanates in cancer chemoprevention: an update. Food & Function , 2011, 2 (10) : 579–587. |
| [6] | Fuentes F, Paredes-Gonzalez X, Kong AT. Dietary glucosinolates sulforaphane, phenethyl isothiocyanate, Indole-3-Carbinol/3, 3'-Diindolylmethane: Antioxidative stress/inflammation, Nrf2, epigenetics/epigenomics and in vivo cancer chemopreventive efficacy. Curr Pharmacol Rep , 2015, 1 (3) : 179–196. DOI:10.1007/s40495-015-0017-y |
| [7] | 钟海秀, 陈亚州, 阎秀峰. 植物芥子油苷代谢及其转移. 生物技术通报 , 2007 (3) : 44–48. |
| [8] | Matile PH. The mustard oil bomb-compartmentation of the myrosinase system. Biochemie und Physiologie der Pflanzen , 1980, 175 (8-9) : 722–731. DOI:10.1016/S0015-3796(80)80059-X |
| [9] | Rask L, Andréasson E, Ekbom B, et al. Myrosinase: gene family evolution and herbivore defense in Brassicaceae. Plant Molecular Biology , 2000, 42 (1) : 93–114. DOI:10.1023/A:1006380021658 |
| [10] | Chen S, Halkier BA. Functional expression and characterization of the myrosinase MYR1 from Brassica napus in Saccharomyces cerevisiae. Protein Expr Purifi , 1999, 17 (3) : 414–420. DOI:10.1006/prep.1999.1158 |
| [11] | Natarajan S, Thamilarasan SK, Park JI, et al. Molecular modeling of myrosinase from Brassica oleracea: A structural investigation of sinigrin interaction. Genes , 2015, 6 (4) : 1315–1329. DOI:10.3390/genes6041315 |
| [12] | Lombard V, Ramulu HG, Drula E, et al. The carbohydrate-active enzymes database(CAZy)in 2013. Nucleic Acids Research , 2014, 42 (1) : 490–495. |
| [13] | Wittstock U, Burow M. Glucosinolate breakdown in Arabidopsis: mechanism, regulation and biological significance. Arabidopsis Book , 2010, 2010 (8) : 134–134. |
| [14] | Bednarek P, Piślewska-Bednarek M, Svatoš A, et al. A glucosinolate metabolism pathway in living plant cells mediates broad-spectrum antifungal defense. Science , 2009, 323 (5910) : 101–106. DOI:10.1126/science.1163732 |
| [15] | Xu Z, Escamilla-Trevi?o L, Zeng L, et al. Functional genomic analysis of Arabidopsis thaliana glycoside hydrolase family 1. Plant Molecular Biology , 2004, 55 (3) : 343–367. DOI:10.1007/s11103-004-0790-1 |
| [16] | Andersson D, Chakrabarty R, Bejai S, et al. Myrosinases from root and leaves of Arabidopsis thaliana have different catalytic properties. Phytochemistry , 2009, 70 (11) : 1345–1354. |
| [17] | Zhang J, Pontoppidan B, Xue J, et al. The third myrosinase gene TGG3 in Arabidopsis thaliana is a pseudogene specifically expressed in stamen and petal. Physiologia Plantarum , 2002, 115 (1) : 25–34. DOI:10.1034/j.1399-3054.2002.1150103.x |
| [18] | 汪萌, 伍祚斌, 李定琴, 等. 拟南芥芥子酶基因 TGG6 是花特异表达的假基因. 生命科学研究 , 2007, 11 (4) : 316–322. |
| [19] | Fu L, Han B, Tan D, et al. Identification and evolution of functional alleles of the previously described pollen specific myrosinase pseudogene AtTGG6 in Arabidopsis thaliana. International Journal of Molecular Sciences , 2016, 17 (2) : 262–275. DOI:10.3390/ijms17020262 |
| [20] | Zhao Z, Zhang W, Stanley BA, et al. Functional proteomics of Arabidopsis thaliana guard cells uncovers new stomatal signaling pathways. The Plant Cell , 2008, 20 (12) : 3210–3226. DOI:10.1105/tpc.108.063263 |
| [21] | Hamanishi ET. Drought induces alterations in the stomatal development program in Populus. Journal of Experimental Botany , 2012, 63 (13) : 4959–4971. DOI:10.1093/jxb/ers177 |
| [22] | Hetherington AM, Woodward FI. The role of stomata in sensing and driving environmental change. Nature , 2003, 424 (6951) : 901–908. DOI:10.1038/nature01843 |
| [23] | 曾兴权, 王玉林, 徐齐君, 等. 青稞 HbSnRK2. 4的克隆及其序列特征与表达特性分析. 生物技术通报 , 2015, 31 (2) : 116–121. |
| [24] | Finkelstein R. Abscisic acid synthesis and response. Arabidopsis Book , 2013, 2013 (11) : 166. |
| [25] | Gollan T, Passioura JB, Munns R. Soil water status affects the stomatal conductance of fully turgid wheat and sunflower leaves. Functional Plant Biology , 1986, 13 (4) : 459–464. |
| [26] | Zhang J, Davies WJ. Does ABA in the xylem control the rate of leaf growth in soil-dried maize and sunflower plants?. Journal of Experimental Botany , 1990, 41 (9) : 1125–1132. DOI:10.1093/jxb/41.9.1125 |
| [27] | IIslam MM, Tani C, Watanabe-Sugimoto M, et al. Myrosinases, TGG1 and TGG2, redundantly function in ABA and MeJA signaling in Arabidopsis guard cells. Plant and Cell Physiology , 2009, 50 (6) : 1171–1175. DOI:10.1093/pcp/pcp066 |
| [28] | Nour-Eldin HH, Hansen BG, N?rholm MHH, et al. Advancing uracil-excision based cloning towards an ideal technique for cloning PCR fragments. Nucleic Acids Res , 2006, 34 (18) : 122. DOI:10.1093/nar/gkl635 |
| [29] | 陈吉宝, 赵丽英, 毛新国, 等. 转PvP5CS1基因拟南芥植株对干旱和盐胁迫的反应. 作物学报 , 2010, 36 (1) : 147–153. |
| [30] | Luo X, Bai X, Sun X, et al. Expression of wild soybean WRKY20 in Arabidopsis enhances drought tolerance and regulates ABA signalling. J Exp Bot , 2013, 64 (8) : 2155–2169. DOI:10.1093/jxb/ert073 |
| [31] | Martinez-Ballesta MDC, Carvajal M. Myrosinase in Brassicaceae: the most important issue for glucosinolate turnover and food quality. Phytochemistry Reviews , 2015, 14 (6) : 1–7. |
| [32] | Martínez-Ballesta M, Moreno-Fernández DA, Castejón D, et al. The impact of the absence of aliphatic glucosinolates on water transport under salt stress in Arabidopsis thaliana. Frontiers in Plant Science , 2015, 2015 (6) : 524. |
| [33] | 刘庆霞, 国静, 阎秀峰. 拟南芥芥子油苷含量对外源茉莉酸的响应. 东北农业大学学报 , 2011, 42 (1) : 133–138. |
| [34] | 段德玉, 刘小京, 李存桢, 等. N素营养对NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响. 草业学报 , 2005, 14 (1) : 63–68. |




