抗冻蛋白(antifreeze protein,AFPs)是耐寒(freeze-avoidance)生物为适应冷环境而产生的小分子蛋白质,能非依数性的降低溶液冰点但不改变熔点,两者产生的差值即为热滞活性(Thermal hysteresis activity,THA),可以用来评价抗冻蛋白抗冻活性的强弱[1]。按照来源的不同可以分为鱼类抗冻蛋白、昆虫抗冻的蛋白、植物抗冻蛋白以及菌类抗冻蛋白。其中昆虫抗冻蛋白主要在甲虫(Tenebrio molitor)、云杉卷叶蛾(Choristoneura fumigerana)、美洲长椿(Oncopeltus fasciatus)和毛虫(Dendroides canadensis)等耐冻昆虫体内表达,其热滞活性可达鱼类抗冻蛋白的10-100倍[2]。一般认为抗冻蛋白吸附于冰晶表面,就需要外加一些推动力(如冰点下降),才能使冰继续生长,这就是吸附抑制理论认为冰点下降的原因[3]。吸附抑制理论认为抗冻蛋白的作用方式具有共性,它们都有一定的疏水性,表面较平坦的面可作为结合冰的位点[4]。
光滑鳖甲(Anatolica polita borealis)属拟步甲科鳖甲属昆虫,能适应新疆古尔班通古特沙漠-40℃的寒冷冬季。其产生的抗冻蛋白种类丰富且具有高度相似的一级结构,重复的TCT基序数量从4-8个不等,形成了每个螺环上的β平面,也形成了相似的冰结合区域和空间上的右手β螺旋结构[5]。这种结构与云杉卷叶蛾抗冻蛋白重复出现在每一螺圈当中的TXT序列十分吻合[6],与皮花天牛(Rhagium inquisitor)抗冻蛋白中出现的重复TxTxTxT序列相似[7]。由此推测这几种昆虫抗冻蛋白与冰晶的作用方式也十分相似[5]。在利用定点突变抗冻蛋白保守位点(TXT基序)使其抗冻活性显著降低的特性已经被广泛报道[8]。而Friis通过定点突变将皮花天牛抗冻蛋白保守位点上不规则的His或Lys替换为更为规则的Thr可以使其抗冻活性显著增强,说明TXT基序的规则排列可能影响抗冻活性的强弱[7]。
本研究利用定点突变将光滑鳖甲抗冻蛋白ApAFP914保守区域不规则的ACT序列替换为规则的TCT序列。同时将规则的TCT序列替换为不规则的TCF序列,打乱原有TXT基序的规则排列。通过差示扫描量热仪(DSC Q2000)法[9, 10]比较光滑鳖甲抗冻蛋白ApAFP914及其各突变体蛋白的热滞活性,旨在探讨在光滑鳖甲抗冻蛋白ApAFP914中TXT规则程度对抗冻活性的影响。
1 材料与方法 1.1 材料 1.1.1 质粒及菌株原核表达载体pET32a为新疆生物资源基因工程重点实验室保存载体,菌株DH5α及BL21(DE3)购自北京全式金生物技术有限公司。
1.1.2 主要试剂限制性内切酶Xho I,EcoR I,T4 DNA连接酶、异丙基-β-D-硫代半乳糖苷(IPTG)以及DNA标准品购于TaKaRa公司。Taq DNA聚合酶、胶回收试剂盒、质粒提取试剂盒均购自天根生化科技有限公司。Ni-NTA柱料和色谱柱购自QIAGEN公司。引物合成及序列测定由北京六合华大基因科技有限公司完成。其他常用试剂均为分析纯。
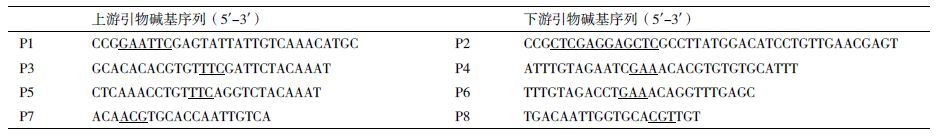
1.2 方法 1.2.1 定点突变TXT基序采用重叠延伸PCR法对光滑鳖甲抗冻蛋白基因apafp914(GenBank:GU358704.1)功能区域进行定点突变。根据apafp914全长序列设计4对引物(表 1),在P1和P2引物中插入EcoR I和Xho I酶切位点(划线部分)用于扩增apafp914全长;引物P3和P4中引入第33位Thr向Phe突变(划线部分),以apafp914为模板,P1与P4为引物扩增得到突变基因前半段,P3与P2为引物扩增得到突变基因后半段,将前后两段突变基因混合后再以P1与P2为引物扩增得到apafp914-T33F单点突变体基因;引物P5和P6中引入第45位Thr向Phe突变(划线部分),以apafp914-T33F为模板,扩增得到apafp914-T33&45F双点突变体基因;引物P7和P8中引入第19位Ala向Thr突变(划线部分)以apafp914为模板,扩增得到TXT基序排列更规则的apafp914-A19T突变体基因。如图 1所示,apafp914基因由264个碱基编码86个氨基酸。分别以蓝色字体表示上游引物,以紫色字体表示下游引物,划线部分表示限制性内切酶酶切位点以及拟突变的氨基酸位点。

|
| 图 1 光滑鳖甲抗冻蛋白apafp914基因与氨基酸序列比对及引物位置示意图 |
经Blast比对,选取与ApAFP914相似性最高的热滞蛋白YL-1型蛋白晶体结构(PDB NO. 1ezg.1.A)进行分子模拟;利用ExPASy蛋白分析程序的Swiss Model(http://swissmodel.expasy.org/)服务器在线分析构建apafp914基因推导蛋白质的三维结构,并用SwisS-PDB viewer软件展示ApAFP914蛋白的三级结构的分子模型。
1.2.3 apafp914及其突变体基因的表达及条件优化将测序正确的pET32a- apafp914;pET32a- apafp914-T33F;pET32a- apafp914-T33&45F;pET32a- apafp914-A19T质粒分别转化BL21(DE3)大肠杆菌感受态细胞。经氨苄青霉素抗性筛选后的阳性单克隆接种于5 mL含50 mg/L Amp的LB培养基,37℃、220 r/min培养12-14 h,按体积比1∶100转接入10 mL新鲜 LB(50 mg/L Amp)培养基中继续培养,当菌液OD600达到0.6-0.8时,收集2 mL诱导前菌液12 000 r/min离心10 min后备用,其余培养液中加入IPTG至终浓度为0.6 mmol/L,相同条件下诱导表达4 h,收集2 mL菌液12 000 r/min离心10 min,用1×SDS样品缓冲液100 μL分别重悬诱导前沉淀与诱导后沉淀,煮沸15 min,15% SDS-PAGE电泳分析表达结果。
1.2.4 融合蛋白的纯化6 000 r/min离心10 min收集1 L新鲜LB(50 mg/L Amp)培养基诱导表达后的菌液,用4%(V/V)预冷的1×Ni-NTA 洗涤缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L imidazole,pH8.0)重悬。超声破碎,12 000 r/min离心15 min收集上清液进行纯化,纯化步骤参见The QIAexpressionistTM说明书(QIAGEN公司)。利用SDS-PAGE凝胶灰度扫描确定蛋白纯度并用于实验。
1.2.5 差示扫描量热法测定各融合蛋白热滞活性经纯化的TrxA-914及其突变体TrxA-T33F、TrxA-A19T各取5 μL 于样品盘中密封后称重,以空铝盘为参比盘。待DSC Q2000仪器稳定后,以3℃/min的速度将温度降至-30℃ 再升温至10℃记录样品的过冷却点和熔点(Tm),计算体系的熔融焓(△Hm)。再匀速降温至-30℃保持5 min,待样品稳定后升温至体系处于冰水混合物状态的保持温度(Th),在Th温度下保持5 min待样品再次稳定后降低温度至-30℃;重复上述过程在不同的Th温度下停留,并分别记录不同Th下样品体系的结晶焓(△Hf)和结晶含量(结晶率Φ=(1-ΔHf/ΔHm)×100%)。热滞活性THA=Th-To(其中To为体系在保持温度下融化部分再次结冰时对应的温度)。TrxA-914及其突变体蛋白以0.1 mg/mL为测定浓度分别测量。每个样品重复3次。
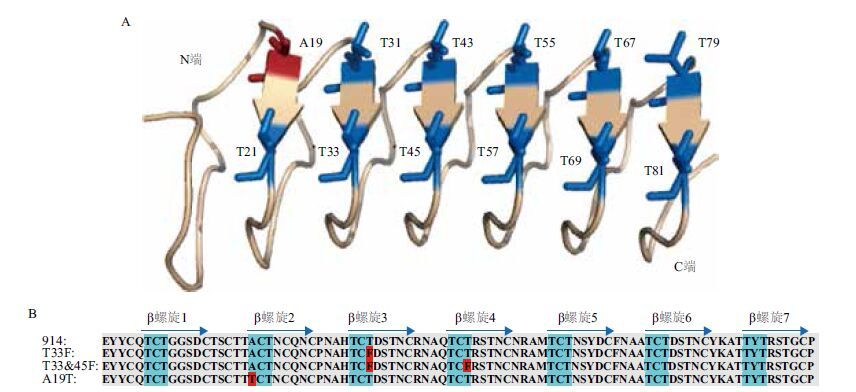
2 结果 2.1 ApAFP914蛋白三维结构的模拟根据同源建模的预测选取与ApAFP914一致性最高(71.95%)的热滞蛋白YL-1型蛋白晶体结构(PDB NO. 1ezg.1.A)进行分子模拟。如图 2-A所示,ApAFP914蛋白由6个规则的β片层组成环状的β螺旋结构,蓝色标记为冰结合域中的Thr,红色标记为的第19位Ala。由如图 2-B保守序列的分析可知,ApAFP914符合昆虫抗冻蛋白的一般结构规律,蓝色标记为预测的7个保守TXT基序,红色标记为重叠延伸PCR获得的三个突变氨基酸位点(A19,T33,T45)。
|
| 图 2 ApAFP914蛋白三维结构的模拟(A)及突变体氨基酸序列比对(B) A:ApAFP914的三维结构预测;B:ApAFP914及三个突变蛋白的序列比对及保守区预测 |
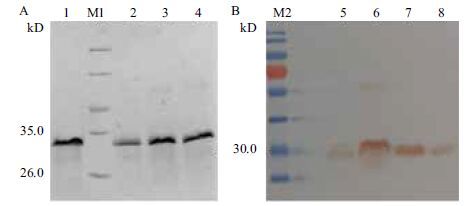
将pET32a-apafp914质粒转入BL21表达菌株中进行光滑鳖甲抗冻蛋白的原核表达。野生型融合蛋白TrxA-ApAFP914-WT(简称TrxA-914)的表达条件优化结果如图 3-A,由不同IPTG浓度诱导后的融合蛋白出现在分子量26.0-35.0 kD之间。从图中可以看出,加入0.6 mmol/L IPTG诱导4 h后的融合蛋白表达量最高。由图 3-B可以看出,突变蛋白TrxA-ApAFP914-T33F(简称TrxA-T33F);TrxA-ApAFP914-T33&45F(简称TrxA-T33&45F);TrxA-ApAFP914-A19T(简称TrxA-A19T)蛋白条带的分子量在30 kD左右,与TrxA-914分子量保持一致。

|
| 图 3 融合蛋白TrxA-ApAFP914表达条件优化(A)及其突变体蛋白表达(B) M:14.4-94.0 kD Protein Marker;1:诱导前;2:0.2 mmol/L IPTG 诱导后;3:0.4 mmol/L IPTG 诱导后;4:0.6 mmol/L IPTG 诱导后;5:0.8 mmol/L IPTG 诱导后;6:1.0 mmol/L IPTG 诱导后;7:诱导前;8:TrxA-T33F;9:TrxA-T33 & 45F;10:TrxA-A19T。A:融合蛋白TrxA-914表达条件优化;B:TrxA-T33F,TrxA-T33 & 45F,TrxA-A19T突变体融合蛋白表达< |
诱导后的pET32a-apafp914/BL21菌体经过超声破碎的上清和沉淀中均发现了带有Trx标签的融合蛋白Trx-914。为不影响4种融合蛋白之间的热滞活性比较,实验选取在上清中表达的融合蛋白进行热滞活性分析。利用His标签与Ni-NTA的亲和层析纯化融合蛋白,经SDS-PAGE检测及Western blot检测结果(图 4)显示,TrxA-914及其突变体的洗脱液发现条带分子量在30 kD左右,通过凝胶灰度扫描分析其纯度均在95%以上,认为已得到条带单一的融合蛋白。
|
| 图 4 融合蛋白 TrxA-914 及其突变体的纯化(A)及Western Blot检测结果(B) 1:TrxA-914蛋白SDS-PAGE纯化检测;M1:14.4-94.0 kDa Protein Marker;2:TrxA-T33F蛋白SDS-PAGE纯化检测;3:TrxA-T33 & 45F蛋白SDS-PAGE纯化检测;4:TrxA-A19T蛋白SDS-PAGE纯化检测;M2:Prestained Protein Marker 5:TrxA-914蛋白Western blot检测;6:TrxA-T33 & 45F蛋白Western blot检测;7:TrxA-T33F蛋白Western blot检测;8:TrxA-A19T蛋白Western blot检测 |
如图 5-A所示,采用DSC Q2000差示扫描量热法检测融合蛋白TrxA-914及其突变体的热滞活性时选用BSA作为阴性对照,溶液随箭头方向先升温后降温至Th温度停留后再降温则立即出现吸放热峰(即To=Th),说明BSA不能改变溶液冰点不具有热滞活性。而融合蛋白TrxA-914及其突变体在温度下降时均表现出热滞活性。如图 5-B所示,曲线a到e表示Th温度由低到高所形成的多条热流曲线。当Th温度越高时溶液冰晶含量越低,此时的Th温度也越接近熔点温度,To可反映出溶液再次因结冰而放热的温度即为冰点温度。

|
| 图 5 DSC热流曲线判断溶液热滞活性 A:BSA溶液的DSC热流曲线;B:TrxA- ApAFP914-WT的DSC热流曲线 |
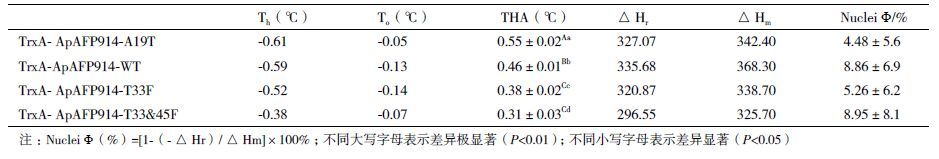
如图 6所示,实验均采取了结冰率为5%以下的热流曲线b作为最终热滞活性的计算依据;经DSC Q2000仪器最终测定了光滑鳖甲抗冻蛋白ApAFP914及其突变体在0.1 mg/mL浓度下的抗冻活性。表 2给出了各融合蛋白热流曲线b的相关参数,Th为保持温度,To为结冰温度,热滞活性THA=Th-To;曲线下方与x坐标轴围成的面积可表示为结晶放热焓△Hr,由融化曲线与x坐标轴围成的面积为熔化吸热焓△Hm,经冰核率(Nuclei,Φ)公式:Nuclei Φ(%)=[1-(-△Hr)/△Hm]×100% 可计算出溶液的冰核率。从表 2中可以看出抗冻活性依次为TrxA-A19T(0.55℃)>TrxA-914(0.46℃)>TrxA-T33F(0.38℃)>TrxA-T33&45F(0.31℃),恰好反映出TXT基序的规则程度,说明昆虫抗冻蛋白保守区的TXT基序规则程度显著影响了抗冻蛋白的热滞活性。

|
| 图 6 融合蛋白TrxA-914及其突变体TrxA-T33F;TrxA-A19T;TrxA-T33&45F的DSC热流曲线 A:TrxA-ApAFP914-A19T的DSC热流曲线;B:TrxA-ApAFP914-WT的DSC热流曲线;C:TrxA-ApAFP914-T33F的DSC热流曲线;D:TrxA-ApAFP914-T33&45F的DSC热流曲线 |
已知AFP的氨基酸残基、空间构象等虽然有一定差异,但都具一定的抗冻活性,都能有效地与冰晶进行不可逆结合,并进一步防止冰晶的生长,有的抗冻蛋白具有与冰晶表面结构互补的平面,如I型抗冻蛋白、II型抗冻蛋白、Ⅲ型抗冻蛋白;有的则通过锚定机制与冰晶结合;而稳定AFP-冰晶复合物的主要作用力为疏水相互作用和范德华力[11]。抗冻蛋白的热滞活性的影响因素主要包括:(1)同一物种产生的不同亚型抗冻蛋白之间的相互作用效果明显高于单一亚型的抗冻蛋白单独作用效果[12];(2)一些小分子量溶质可作为抗冻蛋白的增效剂如柠檬酸盐、甘油和山梨醇能显著阻止冰核的形成,提高昆虫的热滞活性;(3)抗冻蛋白自身的浓度和肽链长度,抗冻蛋白浓度越大,热滞活性越强,高分子量糖肽比低分子量糖肽热滞活性更强[13]。许多研究表明增加AFP的重复序列可增强其热滞活性,但β螺旋结构的抗冻蛋白随着螺旋重复数在一定范围内的增加其抗冻活性也会相应的增加[14],一般认为9个螺旋时抗冻活性最强,大于10-12个时抗冻活性反而会下降[15]。
本研究通过同源建模预测的蛋白的晶体结构可以看出,ApAFP914蛋白是由6个规则的β片层组成的β螺旋结构,推测其规则排列的7个保守TXT基序为冰结合面,符合昆虫抗冻蛋白的结构规律[16]。当以疏水氨基酸Phe替换33位和45位的保守氨基酸,改变了TXT基序中Thr位置的疏水性,或将第19位的Ala替换为更保守氨基酸后,均不影响蛋白质的三级结构,但改变了TXT基序的规则位点个数,从而使蛋白质的生物学活性也发生了变化。实验组融合蛋白TrxA-914及其突变体均表现出热滞活性,且TrxA-A19T的热滞活性显著高于野生型TrxA-914,而突变体TrxA-T33F和TrxA-T33&45F的热滞活性显著低于野生型TrxA-914。实验证明光滑鳖甲抗冻蛋白ApAFP914 TXT基序的规则位点个数可以直接影响到抗冻蛋白的热滞活性,且随TXT基序的规则程度增加/减少而增强/减弱。
溶液在平衡状态下的熔点温度和冰点温度是相等的,随着溶质的浓度增加二者会同时降低。而抗冻蛋白可以非依数性降低溶液的冰点温度而不改变熔点温度,因此直接测量溶液的冰点温度和熔点温度,相减即可算出抗冻蛋白的热滞活性。抗冻蛋白热滞活性的测量方法包括:(1)通过纳升渗透压系统显微观察冰晶缓慢生长或缩小时的温度可推测冰点和熔点温度[17];(2)通过差示扫描量热法(DSC)测定升温或降温过程中溶液的热焓变化情况也可判断冰点和熔点温度[10];(3)此外,还可以通过微升渗透压仪检测溶液的渗透压再换算出溶液的冰点温度,并将未添加抗冻蛋白的溶液冰点温度作为熔点温度,由此计算并推测抗冻蛋白的热滞活性[18]。本实验采用DSC法检测到融合蛋白TrxA-ApAFP914具有热滞活性,并通过多次稳定的测量数据(仪器误差仅0.01℃)可以说明ApAFP914蛋白结构的改变对热滞活性产生了影响。该方法在探究昆虫抗冻蛋白结构对热滞活性的影响时具有可行性。当溶液中冰核量高于10%时,降温过程中冰晶出现爆发性生长,说明此结冰率下ApAFP914的含量不足以完全抑制冰晶的生长。但当溶液的冰核量低于5%时再降温,溶液出现只降温不放热的现象即温度下降但不结冰,说明溶液冰点显著下降,并且THA随结冰率的下降而升高[9]。当实验选用冰核量最少的条件测定热滞活性时,结果显示TrxA-A19T突变体显著的表现出最高的热滞活性,并且TrxA-T33F和TrxA-T33&45F打乱TXT基序保守位点排列后的热滞活性显著减弱,这一结果说明光滑鳖甲抗冻蛋白ApAFP914 TXT基序中保守位点的数量显著影响了热滞活性。经重复实验得出TrxA-A19T突变体比野生型TrxA-914的抗冻活性显著增强,可以推断自然条件下的光滑鳖甲抗冻蛋白并非以单独作用时热滞活性最高的状态存在,而是有保留的替换了TXT基序中保守的Thr位点,其目的尚不清楚。由于实验材料限制,无法在ApAFP914再找到另一个自然条件下不规则的保守位点,所以这一现象还需要在其他昆虫抗冻蛋白中进一步研究。
4 结论差示扫描量热法显示突变蛋白TrxA-A19T具有最高的热滞活性,而突变体TrxA-T33F和TrxA-T33&45F的热滞活性显著低于未突变的TrxA-914。说明在0.1 mg/mL浓度下光滑鳖甲抗冻蛋白ApAFP914 TXT基序越规则抗冻活性越强。推测在一定范围内昆虫抗冻蛋白的TXT基序越规则其具有的热滞活性越高。
| [1] | Duman JG, Bennett V, Sformo T, et al. Antifreeze proteins in Alaskan insects and spiders. Journal of Insect Physiology , 2004, 50 (4) : 259–266. DOI:10.1016/j.jinsphys.2003.12.003 |
| [2] | Graham lA, Davies PL. Glycine-rich antifreeze proteins from snow fleas. Science , 2005, 310 (5747) : 461–465. DOI:10.1126/science.1115145 |
| [3] | Scotter AJ, Marshall CB, Graham LA, et al. The basis for hyperacti-vity of antifreeze proteins. Cryobiology , 2006, 53 (2) : 229–239. DOI:10.1016/j.cryobiol.2006.06.006 |
| [4] | Davies PL, Jason B, Kuiper MJ, et al. Structure and function of antifreeze proteins. Philosophical Transactions of the Royal Society of London , 2002, 357 (1423) : 927–935. DOI:10.1098/rstb.2002.1081 |
| [5] | Mao XF, Liu ZY, Ma J, et al. Characterization of a novel beta-helix antifreeze protein from the desert beetle Anatolica polita. Cryobiology , 2011, 62 (2) : 91–99. DOI:10.1016/j.cryobiol.2011.01.001 |
| [6] | Doucet D, Tyshenko MG, Kuiper MJ, et al. Structure-function relationships in spruce budworm antifreeze protein revealed by isoform diversity. Eur J Biochem , 2000, 267 (19) : 6082–60828. DOI:10.1046/j.1432-1327.2000.01694.x |
| [7] | Friis DS, Kristiansen E, Von solms N, et al. Antifreeze activity enhancement by site directed mutagenesis on an antifreeze protein from the beetle Rhagium mordax. FEBS Lett , 2014, 588 (9) : 1767–1772. DOI:10.1016/j.febslet.2014.03.032 |
| [8] | Bar M, Celik Y, Fass D, et al. Interactions of β-helical antifreeze protein mutants with ice. Crystal Growth and Design , 2008, 8 (8) : 2954–2963. DOI:10.1021/cg800066g |
| [9] | Mao X, Liu Z, Li H, et al. Calorimetric studies on an insect antifreeze protein ApAFP752 from Anatolica polita. Journal of Thermal Analysis & Calorimetry , 2011, 104 (1) : 343–349. |
| [10] | Liu ZY, Li HL, Pang H, et al. Enhancement effect of solutes of low molecular mass on the insect antifreeze protein ApAFP752 from Anatolica polita. J Therm Anal Calorim , 2015, 120 (1) : 307–315. DOI:10.1007/s10973-014-4171-y |
| [11] | 纪瑞庆, 刘爱国, 陈龙, 等. 鱼类抗冻蛋白结构与抗冻活性的关系. 食品科学 , 2015, 36 (05) : 274–282. |
| [12] | Halwani DO, Brockbank KGM, Duman JG, et al. Recombinant Dendroides canadensis antifreeze proteins as potential ingredients in cryopreservation solutions. Cryobiology , 2014, 68 (3) : 411–418. DOI:10.1016/j.cryobiol.2014.03.006 |
| [13] | 汪少芸, 赵琚, 吴金鸿, 等. 抗冻蛋白的研究进展及其在食品工业中的应用. 北京工商大学学报 , 2011, 29 (4) : 50–57. |
| [14] | Leinala EK, Davies PL, Doucet D, et al. A beta-helical antifreeze protein isoform with increased activity. Structural and functional insights. Journal of Biological Chemistry , 2002, 277 (36) : 33349–33352. DOI:10.1074/jbc.M205575200 |
| [15] | Graether SP, Kulper MJ, Gagn SM, et al. β-Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect. Nature , 2000, 406 (6793) : 325–328. DOI:10.1038/35018610 |
| [16] | Jiang M, Ma J, Qiu LG. Cryoprotective effect of an insect antifreeze protein MpAFP 698 and its mutants from the desert beetle Microdera punctipennis. Cryo Letters , 2011, 32 (5) : 436–446. |
| [17] | Kristiansen E, Wilkens C, Vincents B, et al. Hyperactive antifreeze proteins from longhorn beetles:Some structural insights. Journal of Insect Physiology , 2012, 58 (11) : 1502–1510. DOI:10.1016/j.jinsphys.2012.09.004 |
| [18] | Qiu L M, Ma J, Wang J, et al. Thermal stability properties of an an-tifreeze protein from the desert beetle Microdera punctipennis. Cryobiology , 2010, 60 (2) : 192–197. DOI:10.1016/j.cryobiol.2009.10.014 |