2. 天津农学院 动物科学与动物医学学院,天津 300384
2. College of Animal Science and Animal Medicine,Tianjin Agriculture College,Tianjin 300384
n-3多不饱和脂肪酸(n-3 PUFAs)与人类的健康密切相关。众多研究已报道,增加n-3 PUFAs的摄入能够降低心血管系统疾病、Ⅱ型糖尿病及许多癌症疾病的发生率[1-4]。尽管n-3 PUFAs对人类健康有众多有益作用,但人和哺乳动物自身不能合成 n-3 PUFAs,只能通过饮食获取的方式进行补充。1997年,Spychalla等[5]利用拟南芥中已知的去饱和酶基因序列首次在线虫基因组中进行扫描获得了一个脂肪酸脱氢酶基因,被命名为fat-1基因。进一步的研究发现,在转入fat-1基因的多种哺乳动物中均能显著提高体内n-3 PUFAs的含量,降低n-6 PUFAs/n-3 PUFAs的比值。Kang等[6]首次获得了第一批fat-1转基因小鼠,并发现转基因小鼠可以通过体内fat-1基因的持续表达可将n-6 PUFAs转化为n-3 PUFAs。同年,Lai等[7]利用fat-1基因又成功制备了转基因猪,并发现转基因猪的n-3 PUFAs,特别是二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)的含量分别提高4和15倍,总的n-6 PUFAs/n-3 PUFAs比率降低了5倍。随后,许多实验室又相继诞生了富含n-3 PUFAs的fat-1转基因牛[8]和羊[9],充分显示了fat-1基因使哺乳动物机体中n-6 PUFAs转化为n-3 PUFAs的功能。
fat-1基因具有使哺乳动物自身合成n-3 PUFAs的功能已毋庸置疑,但涉及其调控脂类代谢的深入机制仍缺乏理论依据。血浆中富含的蛋白最为丰富,其表达变化能真实的反映出机体的代谢状况。通过血浆差异蛋白研究基因的功能或机体某种疾病的患病机制在国内外已有众多报道。Ding等[10]研究发现转牛生长激素基因的小鼠随着年龄的变化血浆蛋白表达也发生变化,变化的蛋白与转基因小鼠的寿命降低存在重要联系。高昭辉等[11]利用血浆蛋白组学研究了奶牛蹄叶炎发病的可能机制。刘珊珊等[12]对不同环境条件下双峰驼的血浆差异蛋白进行了研究,发现高温环境能引起骆驼内分泌系统变化,从而改变了一些血浆蛋白的表达变化,并发现发生变化的血浆蛋白主要与机体的免疫反应、物质运输及物质代谢等密切相关。fat-1基因作为一种不饱和脂肪酸合成的重要基因,其必定参与机体脂类代谢的调控,通过血浆蛋白组学的研究对于揭示fat-1基因调控机体脂类代谢的潜在机理有重要的意义。
本实验拟先通过2D-双向电泳技术对fat-1转基因牛的血浆差异蛋白进行鉴定,利用生物信息学技术预测与差异蛋白互作的蛋白,分析其参与的脂类代谢生物学通路,同时结合血脂常规生化指标检测结果,分析fat-1基因参与调控转基因牛机体脂类代谢的可能方式,旨在为深入揭示fat-1基因参与脂类代谢的机制积累重要资料,同时为今后生产更安全、健康的fat-1转基因牛提供可参考的资料。
1 材料与方法 1.1 材料 1.1.1 主要仪器分光光度仪(UV1800,美谱达仪器公司)、纯水装置(摩尔公司)、超声波细胞破碎仪(宁波新芝)、IPGhor 等电聚焦仪(GE Healthcare)、Ettan DALT-SIX SDS-PAGE(GE Healthcare)、Ettan-DALT-Six系统水浴循环仪(GE Healthcare)、Image Scanner扫描仪(GE Healthcare)、PDquest分析软件(Bio-Rad)、全自动生化分析仪(Glamour3000)。
1.1.2 主要试剂17 cm非线性固相化梯度胶条(IPG,PH3-10)为GE公司产品;三羟甲基氨基甲烷(Tris-base)、尿素(Urea)、硫脲(Thiourea)、3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸(CHAPS)、二硫苏糖醇(DTT)、溴酚蓝(Bromophenol Blue)、十二烷基磺酸钠(SDS)、碘乙酰胺(IAA)、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Bis-acrylamide)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、甘氨酸(Gly)、2D 电泳样品提取缓冲液系列(PL039)、低熔点琼脂糖、乙醇(C2H5OH)、冰醋酸(CH3COOH)、2D 平衡缓冲液(SD6030)、非干扰型蛋白质浓度测定试剂盒(SK3071)、Protein Stains K 质谱用快速银染试剂盒(BSP021)、柱式血清白蛋白/免疫球蛋白清除试剂盒(BSP064)均为上海生工生物工程有限公司;载脂蛋白A1(APOA1)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)检测试剂盒均为英科新创科技有限公司;其余药品均为国产分析纯试剂。
1.2 方法 1.2.1 样品采集实验选择由实验室先前通过体细胞克隆转基因技术获得的3头fat-1转基因成年牛及3头野生型成年牛,于试验前2个月饲养于同一个圈舍,饮食及饲养方式相同。2个月后,颈静脉采集6头牛的血液置于加抗凝剂的采血管中,4 000 r/min 离心收集血浆,将3头转基因牛和3头野生型牛血浆分别等量混样后,立即冻存于-80℃冰箱备用,剩余血浆以同样方式单独保存备用。
1.2.2 血浆蛋白提取使用柱式血清白蛋白/免疫球蛋白清除试剂盒,按试剂盒推荐的方法去除血浆中的高丰度蛋白,将收集管中的滤液转移至新的离心管中,加入 5 倍体积丙酮,-20℃过夜。离心收集沉淀,冷冻干燥,加入适量的蛋白裂解液溶解蛋白,使用非干扰型蛋白质浓度测定试剂盒定量蛋白浓度。
1.2.3 双向电泳吸取2组制备好的蛋白样品各150 μg与上样缓冲液混合后进行第一向等点聚焦,等电聚焦程序为50 V 12 h(主动水化);500 V(线性)1 h;1 000 V(线性)1 h;9 000 V(线性)5 h;9 000 V(快速)8 000 Vh;500 V(快速)任意时间。将第一向聚焦完成的胶条加 2D 平衡缓冲液(加1% DTT)10 mL,摇床平衡15 min。清洗胶条,加入2D平衡缓冲液(加2.5% IAA),摇床平衡15 min。将平衡后的胶条放入凝胶板中,加入低熔点琼脂糖封胶液(0.5%低熔点琼脂糖+电泳缓冲液),室温静置20 min后开始第二向电泳。第二向SDS-PAGE凝胶浓度为12.5%,电泳参数设定为:100 V/胶,电泳45 min;200 V/胶,至溴酚蓝离胶下沿0.5 cm处停止;冷循环设定温度为15℃。
1.2.4 凝胶染色及图像扫描使用Protein Stains K 质谱用快速银染试剂盒(BSP021)进行染色。染色后的胶经脱色处理后进行扫描,分辨率为300 dpi。使用PDquest 8.0软件对同一样品3次重复的图像进行分析,选取转基因牛与野生型牛表达量>1.5倍且 P<0.05的差异蛋白点用于质谱鉴定。
1.2.5 质谱鉴定切取差异蛋白点,送上海生工生物工程有限公司完成差异蛋白的质谱鉴定。基本步骤为:将差异点酶切后,用MAL-DI-TOF/TOF-MS分析,用Mascot软件搜索NCBInr蛋白数据库,根据样品的物种判定差异蛋白。
1.2.6 差异蛋白互作蛋白预测与分析鉴定出的差异蛋白通过http://string-db.org/ 网站进行互作蛋白的预测,合并差异蛋白及互作蛋白信息,继续利用http://string-db.org/ 网站进行GO和KEGG富集分析,筛选出与脂类代谢密切相关的生物学通路。
1.2.7 血浆APOA1及血脂生化指标检测及关联分析用全自动生化分析仪及相应试剂盒,分别检测3头转基因牛与3头野生型牛血浆中APOA1及血脂生化水平(TG、TC、HDL-C、LDL-C)。所得数据通过t检验进行分析,P<0.05被认为差异显著。应用Excell中Pearson相关性分析函数,分析血浆中APOA1水平与显著变化血脂生化指标的相关性,相关系数r=0.00为无相关性,0.00<r≤±0.30为微正负相关,0.30<r≤±0.50为实正负相关,0.50<r≤±0.80为显著正负相关,0.80<r≤±1.00为高度正负相关。
2 结果 2.1 双向电泳结果分析转基因牛与野生型牛血浆样品3次重复的2-DE图谱中具有1.5倍以上表达,且P<0.05的差异蛋白点共有16个,如图 1所示。其中在fat-1转基因牛上调的点有13个,下调的点有3个。
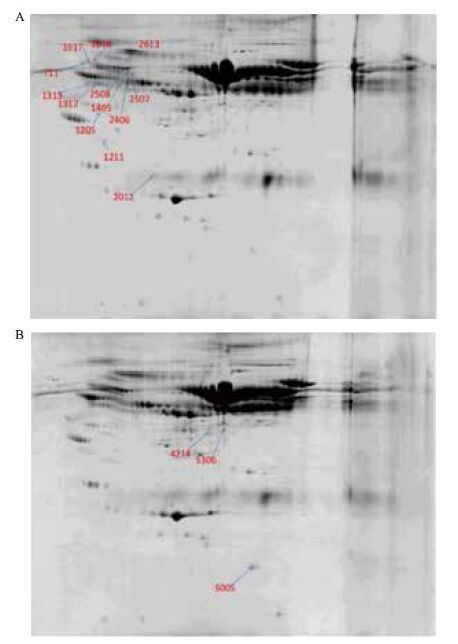
|
| 图 1 血浆差异蛋白点表达图谱 A:转基因组(箭头和数字标出的是上调的差异蛋白点);B:野生型组(箭头和数字标出的是下调的差异蛋白点) |
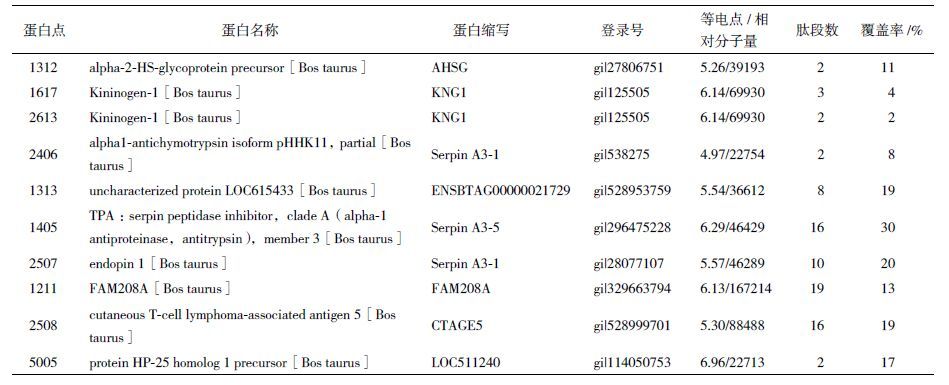
16个差异蛋白点的质谱鉴定结果见表 1。其中10个差异蛋白点鉴定成功,其余6个鉴定失败。10个得到鉴定的点为8种不同的蛋白,分别是AHSG,KNG1,Serpin A3-1,ENSBTAG00000021729,serpin A3-5,FAM208A,CTAGE5和LOC511240,除LOC511240外,其余蛋白在fat-1转基因牛均呈上调表达。
为分析鉴定出的8种差异蛋白所具有潜在功能,本研究首先对这8种差异蛋白分别进行互作蛋白预测,最终获得71个互作蛋白(包括8种差异蛋白),其互作调控关系如图 2所示,除ENSBTAG00000021729、CTAGE5和CCDC68外,其余蛋白均存在良好的互作关系,互作网络中节点颜色相同的蛋白表示互作关系密切。图 2可见节点颜色主要有3类(粉色、黄色和绿色),显示这71个蛋白可能存在3类重要的调控生命活动的功能。

|
| 图 2 差异蛋白互作蛋白调控网络 |
为进一步挖掘差异蛋白与互作蛋白对机体发挥的可能分子功能,本研究继续对这71个蛋白进行GO和KEGG富集分析,结果(图 3)显示,发现有11个与脂类代谢密切相关的生物学通路,主要包括脂类运输、脂类结合、脂类定位、脂类应答等。11个脂类代谢的生物学通路中共有12互作蛋白被富集,并发现APOA1出现的频率最高。

|
| 图 3 脂类代谢富集的生物学通路 |
基于上述研究结果,研究选择出现频率最高的互作蛋白APOA1,比较其在fat-1转基因牛与野生型牛血浆中的表达情况。如图 4所示,转基因牛血浆中APOA1表达显著高于野生型牛(P<0.05)。
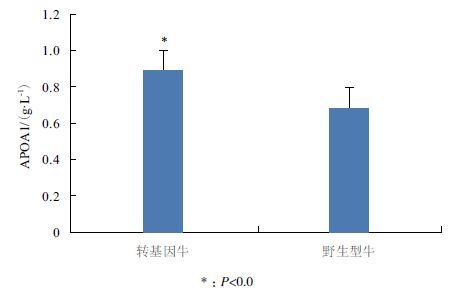
|
| 图 4 转基因牛与野生型牛APOA1血浆表达情况比较 |
表 2可见,3项指标在转基因牛与野生型牛中发生了显著的变化。其中转基因牛的TC和LDL-C的含量均显著低于野生型牛(P<0.05)。同时发现,转基因牛的HDL-C/TC比值显著高于野生型牛(P<0.05)。
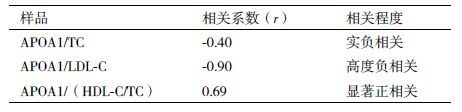
如表 3所示,Spearman 相关性分析显示APOA1与显著变化的血脂均存在一定的相关性。其中APOA1与LDL-C高度负相关,与TC也存在负相关,但相关性较低,而与HDL-C/TC比值显著正相关。
由于2D-双向电泳检测灵敏度的局限性,本研究只鉴定了8种差异蛋白,为了深入挖掘这8种差异蛋白对机体所起的作用,本研究运用生物信息学技术获得了这8种差异蛋白的63种互作蛋白,进一步的分析发现差异蛋白与互作蛋白主要参与了11个与脂类代谢密切相关的生物学通路,其中APOA1被发现在11个脂类代谢通路中出现的频率最高,表明fat-1基因参与对脂类代谢的调控可能与APOA1 有密切关系。众所周知,APOA1是HDL-C的主要成分,对脂类代谢和脂类运输起着重要作用,其水平增高时可降低胆固醇的含量,与冠心病的发生呈负相关关系[13, 14]。本研究发现fat-1转基因牛血浆蛋白中APOA1的含量显著高于野生型牛,暗示了fat-1基因的表达可以通过升高APOA1的表达降低机体发生冠心病的可能性。Ahmed等[15]报道,增加n-3 PUFAs的饮食可以提升APOA1的表达,这一报道更加支持了本研究的结果。
机体血脂水平的变化不仅是脂类代谢变化状况的反映,也与机体的健康状况密切相关。TG主要参与机体的能量代谢,TG的升高与肥胖发生密切相关,肥胖可以导致多种代谢性疾病,比如糖尿病、胰岛素抵抗、心血管疾病、脂肪肝、高血压以及代谢综合症等[16, 17]。TC是动物细胞各种生物膜结构和神经髓鞘的组成部分,是类固醇激素、胆汁酸和维生素D3的前体,所以具有重要的生理功能。血液中TC含量过高,便会沉积在血管壁,造成血管变窄,容易引起血压升高和血管闭塞,导致动脉粥样硬化等疾病。HDL-C和LDL-C都是运输内源性的胆固醇酯,但它们的作用却截然不同。人类医学上,HDL-C是冠心病临床诊断的一个重要参考指标,它的升高可以降低冠心病发生的几率,并能防治和延缓动脉粥样硬化的发展,而LDL-C水平的升高会增加患冠状动脉心脏病和动脉粥样硬化的风险。研究表明,n-3 PUFAs可以通过降低HMG-CoA还原酶的活性,增强ACAT的活性从而抑制TC的生物合成,同时,n-3 PUFAs 可以促进TC代谢为胆酸和中性固醇,形成胆汁,经粪便排出,因此也能够有效降低TC的水平[18, 19]。n-3 PUFAs也能降低LDL-C的水平,升高HDL-C水平及HDL-C/TC的比值[19-21]。本研究结果与以上研究结果一致的是,fat-1基因的转入显著降低了牛血浆中TC与LDL-C的含量,而且显著升高了HDL-C/TC的比率。基于这些结果,本研究继续将血浆APOA1的表达与显著变化的TC、LDL-C含量及HDL-C/TC的比率进行了相关性分析,发现APOA1与LDL-C呈高度负相关,与HDL-C/TC呈显著正相关,进一步表明fat-1基因与APOA1在参与脂类代谢中的重要联系,特别是揭示了fat-1基因可能通过介导APOA1的表达调控脂类代谢进程的潜在机制,为后续开展更为深入的研究提供了理论依据。
4 结论本研究在3头fat-1转基因牛血浆蛋白中鉴定了8个差异蛋白,分析获得了63个蛋白与差异蛋白存在互作关系,而且发现差异蛋白和互作蛋白富集了11个与脂类代谢密切相关的生物学通路,其中APOA1在11个通路中富集的频率最高。进一步的研究也证实转基因牛血浆中APOA1的含量显著高于野生型牛,并发现APOA1与LDL-C高度负相关,而与HDL-C/TC比值显著正相关。本研究结果初步揭示了fat-1基因通过介导APOA1的表达对转基因牛脂类代谢调控的可能机制。
| [1] | Liu F, Li Z, Lv X, et al. Dietary n-3 polyunsaturated fatty acid intakes modify the effect of genetic variation in fatty acid desaturase 1 on coronary artery disease. PLoS One , 2015, 10 (4) : e0121255. DOI:10.1371/journal.pone.0121255 |
| [2] | Psota TL, Gebauer SK, Kris-Etherton P. Dietary omega-3 fatty acid intake and cardiovascular risk. Am J Cardiol , 2006, 98 (4A) : 3i–18i. |
| [3] | White PJ1, Arita M, Taguchi R, et al. Transgenic restoration of long-chain n-3 fatty acids in insulin target tissues improves resolution capacity and alleviates obesity-linked inflammation and insulin resistance in high-fat-fed mice. Diabetes , 2010, 59 (12) : 3066–3073. DOI:10.2337/db10-0054 |
| [4] | Algamas-Dimantov A, Yehuda-Shnaidman E, Hertz R, et al. Prevention of diabetes-promoted colorectal cancer by (n-3) polyunsaturated fatty acids and(n-3)PUFA mimetic. Oncotarget , 2014, 5 (20) : 9851–9863. DOI:10.18632/oncotarget |
| [5] | Spychalla JP, Kinney AJ, Browse J. Identification of an animal omega-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proc Nat1 A cad Sci USA , 1997, 94 (4) : 1142–1147. DOI:10.1073/pnas.94.4.1142 |
| [6] | Kang JX, Wang J, Wu L, et al. Transgenic mice: fat-1 mice convert n-6 to n-3 fatty acids. Nature , 2004, 427 (6974) : 504. DOI:10.1038/427504a |
| [7] | Lai L, Kang JX, Li R, et al. Generation of cloned transgenic pigs rich in omega-3 fatty acids. Nat Biotechnol , 2006, 24 (4) : 435–436. DOI:10.1038/nbt1198 |
| [8] | Wu X, Ouyang H, Duan B, et al. Production of cloned transgenic cow expressing omega-3 fatty acids. Transgenic Res , 2012, 21 (3) : 537–543. DOI:10.1007/s11248-011-9554-2 |
| [9] | Zhang P, Liu P, Dou H, et al. Handmade coned transgenic sheep rich in omega-3 fatty acids. PLoS One , 2013, 8 (2) : e55941. DOI:10.1371/journal.pone.0055941 |
| [10] | Ding J, Berryman DE, Kopchick JJ. Plasma proteomic profiles of bovine growth hormone transgenic mice as they age. Transgenic Res , 2011, 20 (6) : 1305–1320. DOI:10.1007/s11248-011-9499-5 |
| [11] | 高昭辉, 荔霞, 严作廷, 等. 蹄叶炎奶牛血浆蛋白质组学2D-图谱的构建及分析. 中国兽医学报 , 2013, 33 (7) : 1078–1082. |
| [12] | 刘珊珊, 陶金忠, 武小虎, 等. 不同环境温度条件下双峰驼血浆蛋白组学差异. 中国兽医学报 , 2014, 34 (11) : 1824–1828. |
| [13] | Sierra-Johnson J, Fisher RM, Romero-Corral A, et al. Concentration of apolipopr -teinB is comparable with the apolipoprtein B/apolipoprotein A-1 ratio and better than routine clinical lipid measurements in predicting coronary heart disease mortality: findings from a multiethnic US population. J Eur Heart , 2009, 30 (6) : 710–717. |
| [14] | Cho KH, Shin DG, Ba ek, et al. Myocardial infraction patients show altered lip-oproteins and function when compared with stable angina pectoris patients. J Exp Mol Med , 2009, 41 (2) : 67–76. DOI:10.3858/emm.2009.41.2.009 |
| [15] | Ahmed AA, Balogun KA, Bykova NV, Cheema SK. Novel regulatory roles of omega-3 fatty acids in metabolic pathways: a proteomics approach. Nutr Metab(Lond) , 2014, 11 (1) : 6. |
| [16] | Despres JP, Lemieux I. Abdominal obesity and metabolic syndrome. Nature , 2006, 444 (7121) : 881–887. DOI:10.1038/nature05488 |
| [17] | He Y, Li Y, Zhao T, et al. Ursolic acid inhibits adipogenesis in 3T3-L1 adipocytes through LKB1/AMPK pathway. PLoS One , 2013, 8 (7) : e70135. DOI:10.1371/journal.pone.0070135 |
| [18] | Ikeda I, Wakamatsu K, Inayoshi A, et al. alpha-Linolenic, eicosapentaenoic and docosahexaenoic acids affect lipid metabolism differently in rats. J Nutr , 1994, 124 (10) : 1898–1906. |
| [19] | Conquer JA, Holub BJ. Effect of supplementation with different doses of DHA on the levels of circulating DHA as non-esterified fatty acid in subjects of Asian Indian background. J Lipid Res , 1998, 39 (2) : 286–292. |
| [20] | Conquer JA, Holub BJ. Supplementation with an algae source of docosahexaenoic acid increases (n-3) fatty acid status and alters selected risk factors for heart disease in vegetarian subjects. J Nutr , 1996, 126 (12) : 3032–3039. |
| [21] | Davidson MH, Maki KC, Kalkowski J, et al. Effects of docosahexaenoic acid on serum lipoproteins in patients with combined hyperlipidemia: a randomized, double-blind, placebo-controlled trial. J Am Coll Nutr , 1997, 16 (3) : 236–243. DOI:10.1080/07315724.1997.10718680 |