由真菌引起的杨树溃疡病(Botryosphaeria dothidea)又叫做杨树水泡型溃疡病,是一种传染性疾病,一般在杨树生长衰弱时发生,严重危害杨树枝干部,发病时树皮上出现近圆形水渍状和水泡状病斑,具有传播速度快、分布面积广、危害状况严重等特点,目前对其有效的防治方法仍然较少[1]。我国从1955 年第一次在北京发现杨树水泡型溃疡病以来,到现在已经蔓延到我国西北、华北、华东、东北部等杨树栽培地区,严重影响杨树木材的生长量,成为部分地区发展杨树的一大障碍[2]。目前对杨树溃疡病防治方法仍然以化学防治为主,但化学农药对环境的污染不容忽视,因此采用环境友好型的生物农药是防治杨树溃疡病的必然方向。生防微生物因其具有抗病能力强、环境污染小的安全持效性成为植物病虫害防治研究的热点之一[3, 4]。生防微生物在植株上的定殖、扩散和生存竞争能力是显示生防作用的重要指标,对提高和稳定菌剂的生防效果、制定科学有效的施用技术具有重要意义[5, 6]。近年来研究者们将目光转向植物内生菌,特别是与药用植物共生的放线菌,发现其具有抑制或杀死多种有害微生物如病原细菌、真菌和线虫的能力,并且很多菌株还能产生植物促生物质,促进植物生长,具有很好的应用前景。目前对杨树溃疡病的研究主要集中在杨树感染溃疡病菌后使植物体内激发出对外来病原菌侵入的防御措施,但对于内生菌定殖植物后对溃疡病菌产生抑制效果的研究甚少。
发光标记系统等现代基因标记技术的兴起为探明拮抗微生物的定殖动态提供了有效的研究手段[7]。绿色荧光蛋白是应用最为广泛的标记分子[8],因其具有细胞无毒性、结构稳定、作用持久的特点[9],并且能方便可靠地用于活体组织及细胞内部转基因表达的直接检测[10],因而被越来越多的研究人员作为基因工程中跟踪外源基因定位和表达的标记基因[11]。本实验室从药用植物羊角拗中分离得到一株对杨树溃疡病病原菌(B. dothidea)具有较强抑制作用的生防链霉菌Streptomyces sp. SSD49菌株,该菌株对多种植物病原真菌均有较强的抑制效果,是非常有潜力的生防菌株。本研究通过构建能够在链霉菌中稳定表达的穿梭载体pIJ8660Ep(含有GFP基因片段),以E. coli ET12567/pUZ8002作为供体菌,将重组质粒pIJ8660Ep通过接合实验导入到链霉菌SSD49菌株中,并对其在毛白杨组培苗上的定殖能力进行初步研究,旨在为进一步明确SSD49菌株 对杨树溃疡病的生防价值以及该菌株的实际应用提供可行性依据。
1 材料与方法 1.1 材料 1.1.1 质粒、菌种与植株毛白杨品种:毛白杨无性系B341。本实验所用出发菌株为实验室分离得到的植物内生链霉菌SSD49菌株。实验所用到的菌株与质粒,见表 1。
细菌和真菌培养分别采用LB和PDA 培养基;链霉菌固体产孢子培养基用MS。卡那霉素、萘啶酮酸、氯霉素、潮霉素、氨苄青霉素和安普霉素购自北京拜耳迪生物科技有限公司,萘啶酮酸、潮霉素、氨苄青霉素和安普霉素使用浓度为50 μg/mL,卡那霉素和氯霉素使用浓度为25 μg/mL。DNA片段纯化试剂盒、凝胶回收试剂盒、Taq 酶试剂盒、T4 DNA 连接酶、限制性内切酶、DNA Marker DL15000均购自宝生物(大连)有限公司(TaKaRa);质粒小提试剂盒和革兰氏阳性菌DNA提取试剂盒购自Biomega公司;其它试剂均系进口分装或国产分析纯。
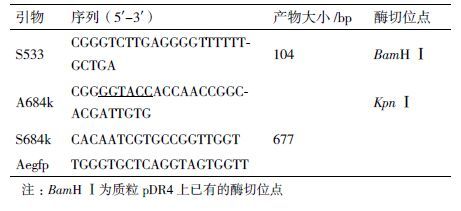
1.1.3 引物本实验所用引物如表 2,均由英潍捷基公司合成。根据启动子ermEp片段基因序列设计特异性引物S533和A684k,分别引入BamHⅠ和KpnⅠ酶切位点和保护碱基。
以现有的质粒pDR4为模板扩增出强启动子ermEp片段,用BamHⅠ和KpnⅠ进行双酶切;载体pIJ8660经过相同限制酶双酶切后与回收的ermEp片段连接成pIJ8660Ep质粒。
1.2.1.2 强启动子ermEp片段的纯化引物S533和A684k以质粒pDR4为模板进行PCR扩增强启动子ermEp片段。反应参数为:95℃ 10 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,30个循环;最后72℃延伸10 min。PCR 产物电泳后用胶回收试剂盒回收目的片段,并以BamHⅠ、KpnⅠ双酶切后用DNA片段纯化试剂盒进行片段纯化。
1.2.1.3 重组质粒pIJ8660Ep的构建与验证 pIJ8660质粒以BamHⅠ、KpnⅠ双酶切后回收约7 kb 的线性化载体片段;载体与强启动子ermEp片段按摩尔比1∶3的比例混合,加入T4 DNA 连接酶,于16℃ 连接过夜后转化Escherichia coli DH5α感受态细胞,在含安普霉素(50 μg/mL)的固体LB培养基培养过夜;挑取克隆子以引物S684k和Aegfp进行常规PCR检测,诺赛基因测序,使用软件DNAMAN 5.0分析测序结果。
1.2.2 pIJ8660Ep在大肠杆菌和链霉菌属间的接合转移采用细菌质粒抽提试剂盒提取穿梭表达质粒pIJ8660Ep,取培养至指数生长期的E. coli ET12567/pUZ8002菌液,用CaCl2方法制备感受态细胞,加入重组质粒pIJ8660Ep,混匀后以热激法进行细胞转化,转化后的细胞以37℃、250 r/min 培养,50 min后涂布含有卡那霉素、氯霉素和安普霉素的LB平板,37℃培养12 h筛选阳性菌株。
大肠杆菌和链霉菌属间接合转移参考链霉菌操作手册[12]。菌株SSD49在MS培养基上培养一个星期后,用2×YT培养基将孢子冲洗下来,加入到有玻璃珠的2×YT培养基,放入摇床中分散孢子,将孢子浓度调整为108/mL 50℃水浴,热激10 min。将携带重组质粒pIJ8660的E. coli ET12567培养至OD600为0.4-0.6之间,离心后用等体积LB冲洗去除残留的抗生素,再次离心后用1/10体积LB重悬。将500 μL热激后的链霉菌孢子悬液加入500 μL上述携带重组质粒pIJ8660的E. coli ET12567菌液中,混匀后离心,用残留100 μL液体重悬沉淀,将液滴滴在MS(加入MgCl2)培养基上,30℃培养16-20 h。用无菌水冲洗液滴,涂布到加有萘啶酮酸和安普霉素的MS平板上筛选可能的接合子,挑取单菌落纯化,确定菌株为链霉菌后用含50 μg/mL的安普霉素抗性平板培养,并将重组菌株命名为SSD49-pIJ8660Ep。
1.2.3 GFP的表达观察插片法培养链霉菌SSD49-pIJ8660Ep,用荧光显微镜(OLYMPUS,U-CMAD3,Japan)进行链霉菌的发光表型检测。
1.2.4 生防菌SSD49抑菌活性测定生防菌对杨树溃疡病病原菌生长的抑制作用采用抑菌圈法测定。接种菌株SSD49-pIJ8660Ep、SSD49和杨树溃疡病病原菌于PDA平板,28℃培养,1周后观察记录抑菌圈的大小。
1.2.5 生防菌株在毛白杨组培苗上的定殖以毛白杨组培苗作为实验材料进行生防菌株定殖实验。将菌株SSD49-pIJ8660Ep用ISP2培养基28℃培养1周后,用无菌水冲洗下平板上的孢子,血球计数板计算孢子浓度,最后用无菌水稀释到106 CFU/mL。用无菌剪刀剪毛白杨组培苗的顶芽,将下端浸泡在孢子液中2 min,立即接种到新的生根培养基中,以浸泡在无菌水中的顶芽作为对照。将接好的苗子放置在组培室中培养,1个月后取根、茎和叶徒手切下薄片制成临时装片,用荧光显微镜(Leica AF6000,Germany)观察生防菌株定殖情况。
2 结果 2.1 重组质粒pIJ8660Ep的构建与鉴定PCR 扩增获得了强启动子ermEp片段。扩增产物经胶回收后用BamHⅠ和KpnⅠ双酶切(图 1),与相应酶切的大肠杆菌-链霉菌穿梭载体pIJ8660连接,转化TOP10,以引物S684k和Aegfp进行常规PCR检测。从图 2中看出,ermEp片段已成功与载体pIJ8660连接并导入大肠杆菌。测序结果表明重组质粒未发生碱基突变,eGFP 编码序列未发生移码,至此成功构建了重组质粒pIJ8660Ep。

|
| 图 1 ermEp扩增片段双酶切并纯化 M:DNA分子量标准;1,2:PCR回收产物;3,4:酶切后;5,6:片段纯化 |

|
| 图 2 PCR扩增验证重组质粒 |
以E. coli ET12567/pUZ8002作为供体菌,将重组质粒pIJ8660Ep通过接合实验导入到链霉菌SSD49中,用萘啶酮酸和安普霉素的抗性平板筛选接合子,挑取单菌落进行纯化。获得接合菌株SSD49-pIJ8660Ep,插片法培养后用荧光显微镜观察自发荧光情况。接合菌株SSD49-pIJ8660Ep 在固体ISP2培养基中培养5 d后即可在荧光显微镜下观察到绿色荧光的出现(图 3)。

|
| 图 3 生防菌株SSD49-pIJ8660Ep发出的绿色荧光 A,C:荧光显微镜暗视野下观察SSD49-pIJ8660Ep 和SSD49;B,D:荧光显微镜明视野下观察SSD49-pIJ8660Ep和SSD49 |
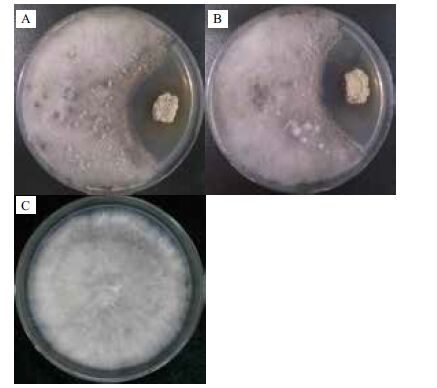
平板抑菌活性检测结果表明生防菌株SSD49-pIJ8660Ep与原始菌株SSD49对杨树溃疡病病原菌的抑菌活性无明显差异,抑菌带宽均为8 mm(图 4)。
|
| 图 4 A:接种生防菌株SSD49-pIJ8660Ep和病原菌;B:接种生防菌株SSD49和病原菌;C为仅接病原菌的对照 |
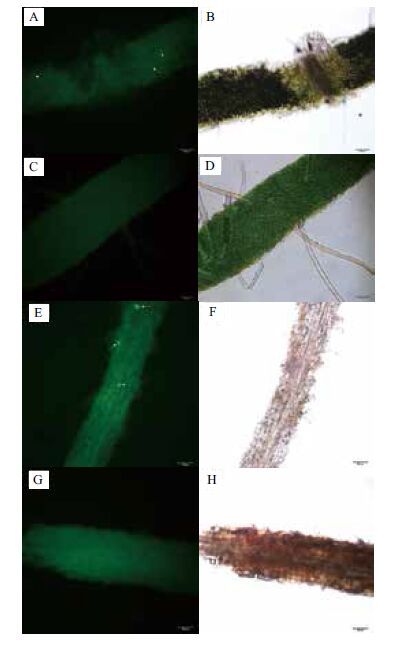
以毛白杨组培苗作为实验材料进行生防菌株定殖实验。生防菌株接种方式为将毛白杨组培苗顶芽浸泡在菌株SSD49-pIJ8660Ep孢子液中,培养一个月后取根、茎和叶徒手切下薄片制成临时装片,用荧光显微镜观察生防菌株定殖情况。实验结果表明,生防菌株SSD49-pIJ8660Ep能够定殖到毛白杨组培苗的茎和叶片中,植物组织本身有部分背景荧光(图 5-C,5-G),而接种SSD49-pIJ8660Ep后可以在茎段切片中可以看到明显的绿色荧光,较背景光强(图 5-E),在叶片中也能看到散布微弱的绿色荧光(图 5-A),在根中并未观察到绿色荧光。由于接种时是将茎段浸泡在孢子液中,因此菌株很有可能沿着伤口进入植物体内,在茎中分布较多,随后迁移至叶片中,而根是在培养基中重新生长出来,菌株可能难以进入根部。
|
| 图 5 生防菌株SSD49-pIJ8660Ep在毛白杨组培苗叶片和茎中的定殖 A,C:荧光显微镜暗视野下观察SSD49-pIJ8660Ep定殖的叶片组织和未接菌的叶片组织;B,D:荧光显微镜明视野下观察SSD49-pIJ8660Ep定殖的叶片组织和未接菌的叶片组织;E,F:荧光显微镜暗视野下观察SSD49-pIJ8660Ep定殖的茎组织和未接菌的茎组织;G,H:荧光显微镜明视野下观察SSD49-pIJ8660Ep定殖的茎组织和未接菌的茎组织 |
植物病害生物防治主要是应用生防菌株调控植物根(叶)围微生物的组成及数量分布,充分利用环境条件进行控制,达到抑制植物病害和促进植物生长的目的[12]。大量研究表明,影响生防菌能否起到持久稳定防病效果的重要因素是生防菌能否在植物体内有效定殖[14]。其定殖能力往往受菌株自身的特性和周围环境条件等因素的影响。文献已报道的影响细菌定殖的因子涉及细菌的性状如鞭毛介导的趋化性、游动性等以及环境条件如温度、pH、土壤类型、土壤微生物组成、土壤水势等[15]。通过对生防菌株进行定殖植物相关研究,可以进一步揭示生防菌侵入植物的方式和存在的障碍以及在植物体内发挥生防作用的机制,为应用生防菌株防治植物病害提供理论依据。
大肠杆菌-链霉菌属间接合转移是通过细胞之间的物理接触,将目的质粒转移到相应链霉菌中,重组质粒同时具备大肠杆菌和革兰氏阳性菌广宿主的复制起始位点,因此可以在较易操作的大肠杆菌中进行构建,避免了链霉菌原生质体构建和转化的繁琐程序,操作简单,宿主范围广,得到了广泛的应用[16]。本研究通过大肠杆菌-链霉菌属间接合转移成功将携带绿色荧光蛋白基因的重组质粒导入杨树溃疡病生防菌株SSD49,对其进行了绿色荧光蛋白标记,重组菌株能够发出较为稳定的绿色荧光,为研究其在植物中定殖奠定了基础。
目前大多数生防菌的筛选与鉴定都是在人为控制条件下进行的,与田间自然条件差别较大。生防菌株应用于田间试验时,由于环境中微生物与生防菌在营养和生态位的竞争,可能会导致生防菌定殖能力弱,难于形成足够的生物群体发挥作用从而降低防效的情况。研究表明,外源基因的高效表达可能会对菌株造成较大的代谢负担,使得生防菌株在环境竞争中处于劣势[15]。不过,本研究中测定了标记菌株和原始菌株的抑菌活性,实验结果表明,标记菌株的抑菌活性同出发菌株相比没有明显变化,外源基因gfp并没有对菌株的抑菌活性产生影响,因此标记菌株仍可以应用于杨树溃疡病的生物防治。该菌株在毛白杨组培苗茎和根中有一定的定殖能力,这可能与生防菌株分离自药用植物羊角拗,在与植物共存的长期进化中具有较好的定殖植物的能力有关。本研究为明确生防链霉菌SSD49 对杨树溃疡病的生防价值以及该菌株的实际应用提供可行性依据。
4 结论本研究成功将杨树溃疡病生防菌株SSD49进行了绿色荧光蛋白标记,重组菌株的抑菌活性同出发菌株相比没有明显变化,并且该菌株在毛白杨组培苗中具有一定的定殖能力。
| [1] | 崔晓琦, 蒋慧华, 刘翠鸽, 等. 我国杨树溃疡病研究现状. 农技服务 , 2013, 30 (5) : 500–501. |
| [2] | 郭徐鹏. 毛白杨叶际微生物多样性及对杨树溃疡病生物防治研究[D]. 杨陵: 西北农林科技大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10712-2010050957.htm |
| [3] | 吕雪鑫, 谢明杰, 姜健, 等. 海洋微生物防治农作物病虫害的研究进展. 中国农学通报 , 2014 (12) : 40–45. |
| [4] | 彭卫福, 李昆太, 曾勇军. 水稻病害的微生物防治研究进展. 江西农业大学学报 , 2015 (4) : 625–631. |
| [5] | 陈杰, 朱渭兵, 郭天文, 等. 放线菌定殖及其对马铃薯根区土壤微生物的影响. 西北农业学报 , 2015, 24 (10) : 150–158. |
| [6] | 杨秀荣, 田涛, 孙淑琴, 等. GFP标记生防细菌B579及其定殖能力检测. 植物病理学报 , 2013, 43 (1) : 82–87. |
| [7] | 姚震声, 陈中义, 陈志谊, 等. 绿色荧光蛋白基因标记野生型生防枯草芽孢杆菌的研究. 生物工程学报 , 2003, 19 (5) : 551–556. |
| [8] | 王震, 郭爱玲, 冯莉. 绿色荧光蛋白基因在植病研究中的应用. 中国农学通报 , 2007, 23 (6) : 493–496. |
| [9] | Rengpipat S, Wongtangprasert N, Palaga T. The use of green fluorescent protein as a marker for monitoring a probiotic Bacillus S11 in the black tiger shrimp Penaeus monodon. Aquaculture Nutrition , 2009, 15 (3) : 297–305. DOI:10.1111/anu.2009.15.issue-3 |
| [10] | Yin JF, Zhou XY, Li JQ, et al. A Study on the survival dynamics of Bacillus subtilis in water using green fluorescent protein labeling. Chinese Journal of Analytical Chemistry , 2007, 35 (10) : 1405–1409. DOI:10.1016/S1872-2040(07)60085-1 |
| [11] | Zimmer M. Green fluorescent protein(GFP): applications, structure, and related photophysical behavior. Chemical Reviews , 2002, 102 (3) : 759–782. DOI:10.1021/cr010142r |
| [12] | Kieser T, Bibb MJ, Buttner MJ, et al. Practical Streptomyces genetics[M]. Norwich: The John Innes Foundation, 2000. |
| [13] | 张丽, 孙书娥. 利用微生物防治植物病害研究进展. 农药研究与应用 , 2010 (6) : 10–13. |
| [14] | Sabaratnam S, Traquair JA. Formulation of a Streptomyces biocontrol agent for the suppression of Rhizoctonia damping-off in tomato transplants. Biological Control , 2002, 23 (3) : 245–253. DOI:10.1006/bcon.2001.1014 |
| [15] | 年洪娟, 陈丽梅. 土壤有益细菌在植物根际竞争定殖的影响因素. 生态学杂志 , 2010, 29 (6) : 1235–1239. |
| [16] | 全梅芳, 余凯, 夏立秋, 等. 大肠杆菌-链霉菌穿梭表达载体pMF的构建及其应用. 微生物学报 , 2010 (9) : 1251–1257. |