2. 河北省果品加工工程技术研究中心,秦皇岛 066600
2. Fruit Processing Engineering Technology Research Center of Hebei Province,Qinhuangdao 066600
纤维素酶是指能水解纤维素β-1,4-葡萄糖苷键的一类酶的总称,它不是单一的酶,而是由起协同作用的多个酶组成的复杂酶系,一般具有 3-1 0种或者更多组分[1]。国内外根据纤维素酶的作用位点、作用底物和释放的产物不同而将其分为三类[1-3]:(1)内切葡聚糖苷酶(endo-1,4-β-D-glucanase EC 3.2.1.4,来自真菌简称EG,来自细菌简称Len);(2)外切葡聚糖苷酶(1,4-β-D-glucancellobiohydrolas或 exo-1,4-β-D-glucanase,EC3.2.1.91,CBH),也称纤维二糖水解酶;(3) β-葡 萄糖苷酶(β-glucosidase,EC3.2.1.21,简称BG),纤维素的水解是这三种酶协同作用的过程,其中 β-葡 萄糖苷酶是纤维素酶系的关键酶,它可以解除产物纤维二糖对EG和CBH的抑制作用。此外,β-葡 萄糖苷酶在食品、医药和生物能源领域中具有重要的应用价值[4, 5]。
纤维素酶的来源十分广泛,包括微生物、植物及低等动物。迄今为止,用于生产的纤维素酶大多来源于真菌,如木霉属、曲霉属、根霉属和青霉 属等,这些微生物产生的纤维素酶为胞外酶,活性高、组分较齐全[6]。其中绿色木霉要求的生长环境粗放,适应性较强,易于控制,便于管理并且可以通过物理或化学诱变获得能够稳定用于生产的高产菌株[7]。因此,绿色木霉是目前用于纤维素酶生产的最普遍的菌种之一[8]。
酶的分离纯化是多步策略,常用的分离方法有沉淀法、透析法、层析法、电泳法和超速离心法[9]。随着一些新技术方法的日趋成熟,减少了纯化步骤并提高了回收率,传统方法与新颖方法的结合为酶分离纯化注入了新的活力[10]。杨晓东等[11]利用免疫亲和层析法成功地提取纯化了萝卜磷脂氢谷胱甘肽过氧化物酶,形成了一个简单、特异的一步法纯化方案。双水相萃取技术是近年发展起来的具有工业开发潜力的分离技术之一,在食品、医药中纯化生物活性分子有广泛应用[12, 13]。
纤维素酶系是一个动态变化的复合酶体系,不同来源,不同类型纤维素酶系中的 β-葡 萄糖苷酶糖基化程度、糖莲聚合度以及糖链分支均有差异,表现为分子质量的差别、酶学性质多样性[14-17]。 β-葡 萄糖苷酶来源不同,结构和组成不同,故分子量也有很大的差异,但一般分布在4 0-2 50 kD间,真菌 β-葡 萄糖苷酶的相对分子质量则大多集中在6 0-1 10 kD范围之内[18]。例如,从绿色木霉中提取纯化出的 β-葡 萄糖苷酶分子量为 66 kD[14];从黑曲霉培养液中分离出的 β-葡 萄糖苷酶酶测定其亚基分子量为127 kD[19]。大部分 β-葡 萄糖苷酶均为酸性蛋白,等电点在酸性范围,一般在3. 5-5 .5之间,最适pH大都在酸性范围内,而且酸碱耐受性强[20]。 β-葡 萄糖苷酶的最适反应温度分布在4 0-1 10 ℃ 范围内,大多数微生物来源的 β-葡 萄糖苷酶的最适反应温度在6 0-6 5 ℃ ,但分离自古细菌的 β-葡 萄糖苷酶,其最适温度高达 10 2-1 05 ℃ [21]。糖苷酶的抑制剂能够降低酶的活性,有时甚至使酶完全失活[10]。无机抑制剂,如某些金属离子和表面活性剂(Hg+、Cu2+、Ag+、SDS、EDTA)以及脲抑制 β-葡 萄糖苷酶活性;而 Mn2+、Co2+和 K+在一定程度上促进 β-葡 萄糖苷酶活性[22, 23]。
β-葡 萄糖苷酶在生物能源、食品工业、保健品行业、农业、医药等领域的广泛应用,加之快速有效地分离纯化发酵粗酶液中 β-葡 萄糖苷酶也是工业应用亟待解决的问题。因此,本研究旨在对绿色木霉GIM3.139发酵生产的 β-葡 萄糖苷酶采用Sephadex G-200凝胶层析进行分离纯化并研究其活性,加深对其胞外 β-葡 萄糖苷酶酶学性质的了解。
1 材料与方法 1.1 材料 1.1.1 菌种绿色木霉Trichoderma viride GIM3.139:购于广东省微生物菌种保藏中心。
1.1.2 仪器与试剂01J200 3-0 4型立式压力蒸汽高压灭菌锅(上海博讯实业有限公司);SPX-250B-Z型生化培养箱(上海博讯实业有限公司医疗设备厂);SW-CJ-1B型超净工作台(苏州净化设备有限公司);FE20K pH计(梅特勒·托利多仪器(上海)有限公司);HZQ-C型空气浴振荡器(哈尔滨市东联电子技术开发有限公司);GL-20M 高速台式冷冻离心机(湘仪离心机仪器有限公司);FLUO star Omega 多功能酶标仪(BMG LABTECH);AKTA Purifier100全自动层析仪(美国GE Healthcare公司);DYY-III9B型电泳仪(北京六一仪器厂);SIGMA 3k15 高速冷冻离心机(北京五洲东方科技发展有限公司);Amican Ultra 超滤管(30 kD)(美国Millipore公司)。
水杨苷[D-(-)-sallcin](99%)]进口分装;二硝基水杨酸(DNS)(国产分析纯);葡萄糖(分析纯)(天津市北方天医化学试剂厂)。
1.1.3 培养基PDA斜面培养基:马铃薯提取液1.0 L,葡萄糖20 g,琼脂20 g,磷酸二氢钾3 g,MgSO47H2O 1.5 g,VB1 8 mg,自然pH。种子培养基:PDA 500 mL,葡萄糖10 g,pH 6.8,121 ℃ ,灭菌20 min。发酵基础培养基:麸皮4.0%,玉米粉3.0%,硫酸铵0.1%,磷酸二氢钾0.2%,吐温-80 0.1%,自然pH,121 ℃ ,灭菌20 min。
1.2 方法 1.2.1 β-葡萄糖苷酶活性测定[24]β-葡 萄糖苷酶活性的测定:取1 mL经过适当稀释的酶液,加入0.5 mL水杨苷,55 ℃ 保温20 min后,加入1 mL 3,5-二硝基水杨酸(DNS)试剂,充分混合后在沸水中煮沸5 min,冷却后用蒸馏水稀释至10 mL,于540 nm处测吸光度值。
以100 ℃ 加热5 min灭活的酶液按同样的方法处理作空白,上述条件下定义:1 mL酶液1 min水解产生1 μmol葡萄糖的酶量为一个酶活力单位(U)[25]。公式如下:
U=(C×N)/(0.18×1×20)
其中,U:酶活力(U/mL);C:葡萄糖含量(mg);N:酶液倍数;0.18:1 μmol葡萄糖的质量(mg);20:反应时间为20 min。
1.2.2 蛋白质含量的测定采用考马斯亮蓝法测定蛋白质含量[26]
1.2.3 β-葡萄糖苷酶的分离纯化(1) 粗酶液的制备:从斜面上取一环(1.67×105)绿色木霉,接种于种子培养基,30 ℃ 恒温,150 r/min摇床培养60 h,再按10% 的接种量接入液体发酵培养基,30 ℃ 恒温,150 r/min摇床培养48 h,取发酵液,5 000 r/min离心15 min,收集上清液,即为粗酶液。
(2) 粗酶液的浓缩:将粗酶液用0.45 μm微孔滤膜过滤,再用30 kD Amican Ultra 超滤管将发酵液进行反复浓缩,浓缩后的酶液用0.2 μm微孔滤膜进行进一步过滤,得到蛋白质层析上样样品。
(3) Sephadex G-200凝胶层析分离纯化 β-葡 萄糖苷酶:使用聚丙烯葡聚糖凝胶Sephadex G-200,在AKTA purifier进行 β-葡 萄糖苷酶的分离。纯化工作站条件:洗脱液为0.1 mol/L Tris-HCl缓冲溶液(pH7.4),流速为0.5 mL/min,上样量为50 µL,紫外检测波长为280 mn,每管收集1 mL。
(4) β-葡 萄糖苷酶纯度的鉴定:对纯化的 β-葡 萄糖苷酶进行SDS-PAGE电泳检测。电泳条件为:分离胶浓度:6%,浓缩胶浓度:5%。初始电压为80 V,当样品进入分离胶后将电压调到120 V,当溴酚蓝指示剂达到距离电泳槽1 cm时停止电泳。上样量为15 µL。电泳结束后,凝胶用考马斯R-250染色4 h,倒除染色液,换 2-3 次脱色液,脱色一昼夜,脱色结束后使用Bio-Rad GS-900 Calibrated Densitometer 扫描得到电泳图谱。
1.2.4 β-葡萄糖苷酶酶学性质 1.2.4.1 温度对β-葡 萄糖苷酶活力的影响反应温度分别为65 ℃ 、70 ℃ 、75 ℃ 、80 ℃ 、85 ℃ 、90 ℃ ,保温20 min后,测定 β-葡 萄糖苷酶的活性,将最高酶活力定义为100%,分别计算 β-葡 萄糖苷酶在不同温度下的相对酶活力(即在不同温度条件下的剩余酶活力占其中酶活力的最高值的百分比),确定 β-葡 萄糖苷酶的最适温度。同时研究不同温度下,酶液保温20、40、60、80、100、120和140 min,在上述测得的最适温度下测定酶活性。
1.2.4.2 pH对β-葡 萄糖苷酶活力的影响在浓度为0.1 mol/L、不同pH值(4.19、4.69、5.09、5.48、5.80、6.16、6.53、6.86、7.19、7.68)的柠檬酸-磷酸氢二钠缓冲溶液,80 ℃ 反应20 min,测定 β-葡 萄糖苷酶的活性,将最高酶活力定义为100%,计算 β-葡 萄糖苷酶在不同pH条件下的相对酶活力。
pH稳定性:在浓度为0.1mol/L、不同pH值(5.53、5.74、5.91、6.16、6.37、6.55、6.79、7.19、7.68)的柠檬酸-磷酸氢二钠缓冲溶液中,4 ℃ 恒温24 h,80 ℃ 反应20 min,测定 β-葡 萄糖苷酶的活性,将未进行处理的酶液酶活定义为100%,计算 β-葡 萄糖苷酶在不同pH条件下的相对酶活力。
1.2.4.3 有机溶剂对酶活性的影响分别在酶液中添加不同种类(甲醇、无水乙醇、正丁醇、丙酮、乙酸乙酯)和不同浓度(终浓度分别为10%、20%、30%、40%、50%)的有机溶剂,80 ℃ 反应20 min,测定 β-葡 萄糖苷酶的活性。以不添加有机溶剂对照组,计算相对酶活力。
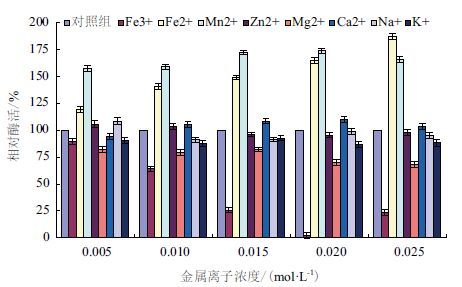
1.2.4.4 金属离子对酶活性的影响分别在酶液中添加不同种类(Fe3+、Zn2+、Na+、K+、Fe2+、Mn2+、Ca2+、Mg2+)和不同浓度(终浓度分别为0.005、0.010、0.015、0.020、0.025 mol/L)的金属离子溶液,80 ℃ 反应20 min,测定 β-葡 萄糖苷酶的活性,以不添加金属离子为对照组,计算相对酶活力。
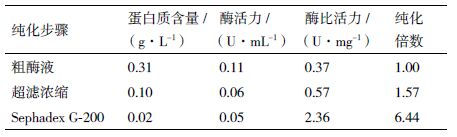
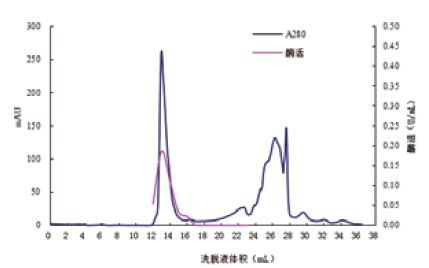
2 结果 2.1 绿色木霉 β-葡 萄糖苷酶的分离纯化 2.1.1 AKTA purifier-100蛋白分离纯化工作站分离 β-葡 萄糖苷酶经多次离心超滤浓缩的 β-葡 萄糖苷酶粗酶液,经AKTA purifier-100蛋白分离纯化工作站分离纯化后,得到洗脱曲线图(图 1),出现两个洗脱峰Ⅰ(左)和Ⅱ(右),通过测定每管收集液的 β-葡 萄糖苷酶酶活,发现峰I具有 β-葡 萄糖苷酶酶活,酶比活力达到2.36 U/mg。
|
| 图 1 Sephadex G-200分离纯化 β-葡 萄糖苷酶洗脱图 |
粗酶液经超滤离心浓缩粗酶液后,采用Sephadex G-200分离纯化,得到 β-葡 萄糖苷酶的纯化组分,纯化过程见表 1,纯化倍数达到6.44倍。
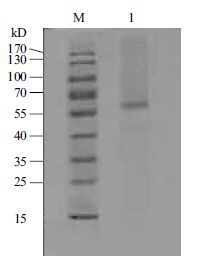
将上述分离纯化得到的 β-葡 萄糖苷酶纯化峰I进行SDS-PAGE电泳,结果如图 2,只有一条谱带,说明纯化的 β-葡 萄糖苷酶达到电泳纯,分子量约为66 kD。
|
| 图 2 β-葡 萄糖苷酶SDS-PAGE图谱 M:蛋白质分子质量标准;1:Sephadex G-200凝胶层析后浓缩样品 |
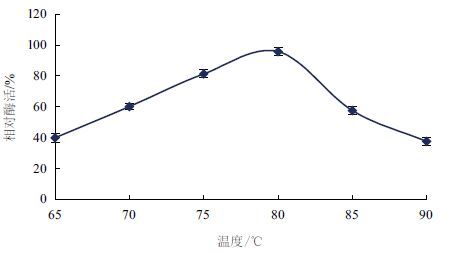
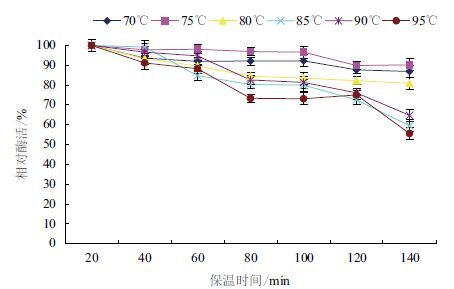
如图 3可知,β-葡 萄糖苷酶的最适温度为80 ℃ ,在6 5-8 0 ℃ 时,β-葡 萄糖苷酶的酶活力逐渐上升,8 0-9 0 ℃ 时,其酶活力显著下降。同时,研究了 β-葡 萄糖苷酶的热稳定性(图 4),在70 ℃ 、75 ℃ 、80 ℃ 、85 ℃ 、90 ℃ 、95 ℃ 条件下分别保温2 0-1 20 min,在80 ℃ 条件下测定酶活,发现在7 0-8 0 ℃ 条件下,随着反应时间的延长,酶活力稍有下降,但是维持在90%;在8 0-9 5 ℃ 条件下,随着反应时间的延长,酶活力有不同程度的显著下降趋势,但相对酶活仍保持在50%以上。由此可知,β-葡 萄糖苷酶具有较好的耐热性。
|
| 图 3 β-葡 萄糖苷酶的最适温度 |
|
| 图 4 β-葡 萄糖苷酶的热稳定性 |
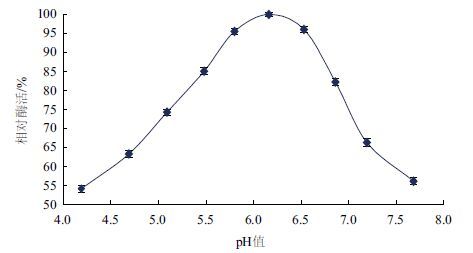
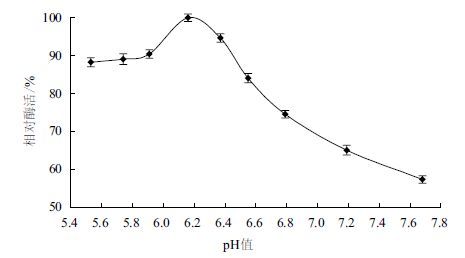
如图 5所示,β-葡 萄糖苷酶的反应最适pH值范围为6. 0-6 .5,pH值6.16时酶活达到最高。pH值在5. 5-6 .16或者是pH>6.16时,酶活性都急剧下降,确定 β-葡 萄糖苷酶的最适pH值为6.16。于不同pH值环境中,4 ℃ 处理24 h,80 ℃ 测定 β-葡 萄糖苷酶的酶活,结果(图 6)显示,在pH值5. 4-6 .4酸性环境中,其相对酶活均可保持80%以上。在pH7. 0-7 .8中性及碱性环境中,酶活显著下降,但是仍保持60%以上,由此可知,绿色木霉 β-葡 萄糖苷酶耐酸碱稳定性好。
|
| 图 5 β-葡 萄糖苷酶的最适pH值 |
|
| 图 6 β-葡 萄糖苷酶的pH值稳定性 |
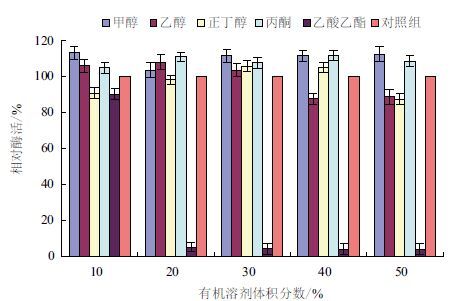
由图 7可知,乙酸乙酯对绿色木霉 β-葡 萄糖苷酶的活性有明显的抑制作用,且乙酸乙酯体积分数在10% - 20%时,酶的活性迅速降低,其体积分数在20% - 50%时,酶活性几乎完全丧失。而甲醇和丙酮对 β-葡 萄糖苷酶具有激活作用,甲醇激活作用较明显,但激活作用与甲醇和丙酮的终浓度无关。乙醇和正丁醇对 β-葡 萄糖苷酶的激活或抑制作用与其浓度有关系,乙醇的体积分数为10% - 30%时,对绿色木霉 β-葡 萄糖苷酶的活性具有激活作用,当乙醇的体积分数为40% - 50%时,该酶的活性稍有降低,但仍然保持较高活性。而正丁醇在不同浓度下对 β-葡 萄糖苷酶表现出不同程度的激活或抑制作用。
|
| 图 7 不同有机溶剂及体积分数对 β-葡 萄糖苷酶的影响 |
如图 8所示,Fe3+、Mg2+、K+对 β-葡 萄糖苷酶的活性有抑制作用,而Fe2+、Mn2+对 β-葡 萄糖苷酶的活性有激活作用,其中Fe3+对该酶的抑制作用最为明显。Fe3+对 β-葡 萄糖苷酶的抑制作用与其终浓度有关,终浓度在0.005 - 0.020 mol/L之间时,随着Fe3+浓度的增加,酶的活性逐渐降低,当终浓度0.020 mol/L时,酶活性几乎全部丧失。随着Mg2+浓度的增大,对 β-葡 萄糖苷酶抑制作用增强。而K+对该酶的抑制作用较小,相对酶活均维持在80% - 95%。激活剂中Mn2+对 β-葡 萄糖苷酶的活性的激活作用最为明显,随着Mn2+浓度(0.005 - 0.020 mol/L)的增加,酶活性逐渐升高,在终浓度0.020 mol/L 时,β-葡 萄糖苷酶相对酶活达到170%。Fe2+对 β-葡 萄糖苷酶活性的激活作用与其终浓度(0.005 - 0.025 mol/L)呈正相关,随着浓度的增大,激活作用增强。Na+对 β-葡 萄糖苷酶作用与其浓度有关,在浓度为0.005 mol/L时,对 β-葡 萄糖苷酶起到激活作用,随着浓度的增大,酶活性降低,但抑制作用不明显。Ca2+对 β-葡 萄糖苷酶作用与其浓度有关,在浓度为0.005 mol/L时,对 β-葡 萄糖苷酶起到抑制作用,随着浓度的增大,酶活性升高,但激活作用不明显。Zn2+对 β-葡 萄糖苷酶的活性几乎没有影响。
|
| 图 8 不同金属离子及浓度对 β-葡 萄糖苷酶活性的影响 |
纤维素酶来源广泛,而且组分较复杂,要得到单一组分 β-葡 萄糖苷酶,就需要根据不同组分的分子量以及等电点不同的特点,将不同的分离纯化方法结合起来,实现对 β-葡 萄糖苷酶的有效分离,国内外已经有较多的研究涉及 β-葡 萄糖苷酶的分离纯化。2010年,刁金山等[27]采用硫酸铵沉淀,阴离子交换层析对 β-葡 萄糖苷酶的分离纯化进行了初步研究,β-葡 萄糖苷酶的纯化倍数达到6.33。同年,王剑锋等[28]将黑曲霉Aspergillus niger 发酵豆渣的粗酶液依次经过乙醇沉淀和DEAE-Sepharose Fast Flow离子交换层析,获得了两种电泳纯的 β-葡 萄糖苷酶BGL1和BGL2,它们的相对分子质量分别为102 kD、97 kD。2011年,常军等[29]将黑曲霉发酵液经盐析,DEAE-Sepharose柱层析得到单一组分 β-葡 萄糖苷酶。2012年,侯红萍和杨盛[30]对黑曲霉Ⅲ与绿色木霉Ⅰ混合发酵所产纤维素酶进行了分离纯化通过硫酸铵分级沉淀、Sephadex G-100 凝胶柱层析得到1 种内切葡聚糖苷酶组分。2015年,徐星等[31]利用硫酸铵盐析、Superdex 200 凝胶柱层析等步骤,从黑曲霉发酵液中纯化得到两种 β-葡 萄糖苷酶蛋白,其相对分子质量分别为1.15×105 和7.0×104左右,比活力分别为62.1 U/mg(相对分子质量约为1.15×105)和53.0 U/mg(相对分子质量约为7.0×104),纯化倍数分别为1.54 和1.31。本研究中采用超滤浓缩以及Sephadex G-200凝胶层析分离纯化得到电泳纯的 β-葡 萄糖苷酶,相对分子质量约为66 kD,纯化倍数达到6.44,酶比活力达到2.36 U/mg,相比绿色木霉AS3.3711中β- 葡 萄糖苷酶的最终纯化倍数18.48,酶的比活力0.573 U/mg[14],本研究的酶比活力较高,但纯化倍数较低。
近年来许多嗜热菌来源的 β-葡 萄糖昔酶得到分离、鉴定或表征,耐热 β-葡 萄糖苷酶在工业上具有较高的应用价值。两步法生产天然蓝色素,首先将提取的栀子苷与 β-葡 萄糖苷酶在低温下反应,获得京尼平,再与初级氨基酸在高温下反应得到质量较好的蓝色素[32]。如果得到耐热的 β-葡 萄糖苷酶,在生产天然蓝色素的过程中无需先在低温下反应这一步骤,而可直接将酶加入到栀子苷和初级氨基酸的混合物中,在高温下一步获得质量较高的蓝色素。这是对两步法生产天然蓝色素的进一步改进,节约了生产成本,使工业化获得高质量天然蓝色素具有了极大的可能性[33]。乳糖不耐症是近年来引起广泛关注的一种疾病,由于乳糖是由一分子半乳糖和一分子葡萄糖构成的二糖,因此无论半乳糖苷酶或葡萄糖苷酶都可以将其水解成单糖。基于这一特点,许多科研人员都尝试利用外源性的半乳糖苷酶或葡萄糖苷酶水解牛奶中的乳糖。但是半乳糖苷酶基本上都存在一个明显的不足之处——耐热性不好,遇高温后会失活,故需要在巴氏消毒之后加入,增加了牛奶污染的几率,由于半乳糖苷酶以上的不足之处,人们逐渐将目光投向了葡萄糖苷酶,尤其是耐热的葡萄糖苷酶,耐热性极佳的 β-葡 萄糖苷酶,在100 ℃ 的高温下经过85 h还能具有一半以上的活性。这为其应用于巴氏消毒条件下低乳糖牛奶的生产奠定了基础[34]。除此之外,对于催化糖苷合成的 β- 葡 萄糖苷酶,尤其是催化逆水解合成反应的 β-葡 萄糖苷酶来说,由于逆水解反应通常速度较慢,只有催化剂具有良好的热稳定性,使得在更高温度下的反应得以实现,才能大大提高反应效率。因此,耐热 β-葡 萄糖苷酶在糖苷合成过程中具有巨大的应用潜力[35]。淀粉质原料(如玉米、木薯等)浓醪酒精发酵的醪液中残留有一定量不能被工业酒精酵母利用的纤维二糖[36],如果这部分糖能被酵母有效利用,将有可能提高出酒率、降低成本、减少污染,而在糖化过程中添加 β-葡 萄糖苷酶,使其与糖化酶协同作用水解产生纤维二糖的方法安全可靠,是比较理想的提高淀粉质原料利用率的一种途径。因此,获得一种高活力的且能够与糖化酶作用条件(55 - 60 ℃ )相匹配的耐热 β-葡 萄糖苷酶,对提高淀粉质原料乙醇生产中的原料利用率具有一定的研究价值[37]。由于酶的热稳定性在工业上具有诸多优势[38],近年来从嗜热菌中分离出 β-葡 萄糖酶逐渐引起人们的兴趣[37]。2009年Hong等[39]将来自嗜热细菌(Caldicellulosiruptor saccharolyticus)中的 β-葡 萄糖苷酶基因在酿酒酵母里表达,最适反应温度为70 ℃ ,在80 ℃ 还保持较高的活力。同年陈卫红等[40]从嗜热子囊菌光孢变种(Thermoscus aurantiacus var.levisporus)的RNA中克隆出 β-葡 萄糖苷酶基因,并将其在毕赤酵母中表达,重组酶最适反应温度为60 ℃ ,在70 ℃ 保温30 min还能保持80%的酶活力。刘颖等[14]从绿色木霉AS3.3711中分离得到的 β-葡 萄糖苷酶,最适温度为60 ℃ 。本研究中对绿色木霉GIM3.139发酵所产的 β-葡 萄糖苷酶的酶学基本性质进行研究,结果表明,该酶最适温度达到80 ℃ ,而且热稳定性较好,在8 0-9 5 ℃ 条件下,处理140 min,相对酶活仍保持在50%以上,属于耐热型酶,具有很高的工业应用价值。
除此之外,还研究了该酶的最适pH值以及激活剂抑制剂,该酶还具有较好的耐酸碱稳定性,为其在食品、医药、生物能源等方面的广泛应用奠定基础。但由于技术手段的限制,未能进一步确认该酶的耐热机理以及酶的蛋白结构。除此之外,该菌株产酶量并不高,通过改变培养基成分以及发酵条件的优化来提高酶产量,或者是采用目前技术手段比较成熟的基因工程的方法来提高酶的表达量,以得到高产耐热的 β-葡 萄糖苷酶的菌株,这方面的研究有待进一步进行。
4 结论经超滤离心浓缩粗酶液后,采用Sephadex G-200分离纯化,得到2个洗脱峰,其中峰I具有 β-葡 萄糖苷酶酶活力,酶活力为0.186 9 U/mL,蛋白质含量为0.019 8 g/L,比活力达到2.36 U/mg,纯化倍数6.44,经SDS-PAGE电泳检测峰I达到电泳纯,且分子量约为66 kD。
绿色木霉 β-葡 萄糖苷酶的酶学性质:最适反应温度为80 ℃ ,属于耐热酶,最适pH值为6.5,pH值稳定范围较宽。金属离子中,Fe3+、Mg2+、K+对 β-葡 萄糖苷酶的活性起抑制作用,其中Fe3+对该酶的抑制作用最为明显,Fe2+、Mn2+,对 β-葡 萄糖苷酶的活性起激活作用,其中Mn2+对 β-葡 萄糖苷酶的激活作用最为明显。有机溶剂中,甲醇、丙酮对该酶起到激活作用,其中甲醇的激活作用最明显,而乙酸乙酯对该酶具有明显的抑制作用。
| [1] | 张慧芳. 混菌发酵产纤维素酶的分离纯化及其酶学性质研究[D]. 晋中: 山西农业大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10113-1014416435.htm |
| [2] | Willis JD, Oppert B, Oppert C, et al. Identification, cloning, and expression of a GHF9 cellulase from Tribolium castaneum(Coleop-tera: Tenebrionidae). Journal of Insect Physiology , 2011, 57 (2) : 300–306. DOI:10.1016/j.jinsphys.2010.11.019 |
| [3] | Percival Z, Michael EH, Jonathan RM. Outlook for cellulase improv-ement screening and selection strategies. Biotechnology Advances , 2006 (24) : 452–481. |
| [4] | Himmel ME, Ruth MF, Wyman CE. Cellulase for commodity products from cellulosic biomass. Current Opinion in Biotechnology , 1999, 10 (10) : 358–64. |
| [5] | 朱凤妹, 彭丽莎, 李军. β-葡萄糖苷酶基因克隆及在丝状真菌中高效表达的研究进展. 食品安全质量检测学报 , 2014, 5 (10) : 3052–3058. |
| [6] | 张静茹. 康氏木霉内切β-葡聚糖苷酶的分离纯化及酶学性质[D]. 广西: 广西大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10593-1014378956.htm |
| [7] | 张继泉, 王瑞明. 绿色木霉生产纤维素酶的进展. 山东食品发酵 , 2001 (4) : 12–15. |
| [8] | 姜绪林. 绿色木霉固态发酵产纤维素酶的研究[D]. 无锡: 江南大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10295-2005104758.htm |
| [9] | 白利涛, 张丽萍. 酶及蛋白质分离纯化技术研究进展. 安徽农业科学 , 2012, 40 (14) : 8018–8020. |
| [10] | 董梅. 酒类酒球菌31MBRβ-D-葡萄糖苷酶的分离纯化及酶学性质研究[D]. 西安: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10712-1014430458.htm |
| [11] | 杨晓东, 刘进元. 用免疫亲和层析法纯化萝卜PHGPx天然蛋白. 生物化学与生物物理进展 , 2005, 32 (8) : 794–799. |
| [12] | 郭会灿. 双水相萃取技术及其在药物分离中的应用. 河北化工 , 2011, 34 (8) : 42–43. |
| [13] | 齐玉, 孙波, 等. 聚乙二醇/磷酸氢二钾双水相体系萃取蛋清溶菌酶方法的建立. 中国家禽 , 2013, 35 (5) : 22–26. |
| [14] | 刘颖, 韩春然, 张帅, 等. 绿色木霉β-葡萄糖苷酶的分离纯化及酶学性质. 食品科学 , 2014, 35 (5) : 150–155. |
| [15] | 张晓勇, 陈秀霞, 高向阳. 纤维素酶的蛋白质工程. 纤维素科学与技术 , 2006, 14 (2) : 55–58. |
| [16] | 杨盛, 侯红萍. 高效降解纤维素混合菌的筛选及其产酶条件的研究. 中国酿造 , 2008 (21) : 20–23. |
| [17] | Gunasekaran K, Nussinov R. How different are structurally flexible and rigid binding sites? Sequence and structural features discriminating proteins that do and do not undergo conformational change upon ligand binding. Journal of Molecular Biology , 2007, 365 (1) : 257–273. DOI:10.1016/j.jmb.2006.09.062 |
| [18] | 崔乐芳. 产β-葡萄糖苷酶菌株诱变选育及酶的分离纯化[D]. 大连: 大连理工大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10141-1013201851.htm |
| [19] | 马腾. 高产耐热β-葡萄糖苷酶的黑曲霉菌株选育及其基因克隆[D]. 秦皇岛: 河北科技师范学院, 2012. http://cdmd.cnki.com.cn/article/cdmd-10798-1012446214.htm |
| [20] | 宋晓青. 蜡梅花β-葡萄糖苷酶的活性分析、分离纯化与性质的初步研究[D]. 武汉: 华中农业大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10504-2005153360.htm |
| [21] | Kengen SW, Luesink EJ, Stams AJ, et al. Purification and characterization of an extremely thermostable beta-glucosidase from the hyperthermophilic archaeon Pyrococcus furiosus. European Journal of Biochemistry , 1993, 213 (1) : 305–312. DOI:10.1111/ejb.1993.213.issue-1 |
| [22] | 常军, 周斌, 胡娜. 黑曲霉葡萄糖苷酶的分离纯化及酶学性质研究. 安徽农业科 , 2011, 39 (19) : 11374–11376. |
| [23] | Michlmayr H, Schümann C, da Silva NM, et al. Isolation and basic characterization of a beta-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture. Journal of Applied Microbiology , 2010, 108 (2) : 550–559. DOI:10.1111/jam.2009.108.issue-2 |
| [24] | 张玉梅. 绿色木霉β-葡萄糖苷酶的酶学性质及其基因的体外扩增[D]. 秦皇岛: 河北科技师范学院, 2014. http://cdmd.cnki.com.cn/article/cdmd-10798-1014316448.htm |
| [25] | 刘畅, 李军, 等. 黑曲霉的紫外诱变及酸性蛋白酶缺陷株的选育. 河北科技师范学院学报 , 2012, 26 (1) : 72–76. |
| [26] | 甘淋, 李娟, 何涛, 等. 几种蛋白质含量测定方法的比较研究. 泸州医学院学报 , 2004, 27 (6) : 500–502. |
| [27] | 刁金山, 陈振, 王丽, 等. 黑曲霉诱变菌株产β-葡萄糖苷酶的酶学性质以及分离纯化的初步研究[C]. 第六届全国化学工程与生物化工年会, 2010. |
| [28] | 王剑锋, 陈今朝, 等. 黑曲霉水解京尼平苷β-葡萄糖苷酶的分离纯化及其酶学性质. 菌物学报 , 2010, 29 (5) : 683–690. |
| [29] | 常军, 周斌, 胡娜. 黑曲霉葡萄糖苷酶的分离纯化及酶学性质研究. 安徽农业科学 , 2011, 39 (19) : 11374–11376. |
| [30] | 侯红萍, 杨盛. 黑曲霉Ⅲ与绿色木霉Ⅰ混合发酵产纤维素酶的分离纯化及酶学性质研究. 酿酒科技 , 2014 (8) : 25–28. |
| [31] | 徐星, 肖华, 等. 黑曲霉胞外β-葡萄糖苷酶的纯化及酶学性质的研究. 天津科技大学学报 , 2015, 30 (5) : 15–19. |
| [32] | 章建国, 余顺火, 李先祥, 等. 两步法生产栀子蓝色素工艺条件的研究. 食品科学 , 2008, 29 (11) : 186–188. |
| [33] | 张慧, 邱日永, 刘明杰, 等. 极耐热性β-葡萄糖苷酶基因克隆、超量表达及其在天然蓝色素工业化生产中的应用. 江苏农业科学 , 2013, 41 (7) : 19–22. |
| [34] | 李斌. (一)耐热β-葡萄糖苷酶在毕赤酵母中的重组表达、纯化、性质分析和低乳糖巴氏牛奶的生产工艺研究(二)Dihydro-CDDO-trifluoroethyl amide通过靶向激活Nrf2负性调节LPS诱导的炎症反应[D]. 济南: 山东大学, 2014. |
| [35] | 邹争争. 耐热β -葡萄糖苷酶的基因挖掘和催化性能研究[D]. 上海: 华东理工大学, 2012. |
| [36] | 张梁, 洪剑辉, 石贵阳, 等. 在 GPD1 中整合表达 bglII 基因改善酒精发酵. 微生物学通报 , 2006, 33 (4) : 15–20. |
| [37] | 廖德芳. 耐热β -葡萄糖苷酶细菌的筛选、基因的克隆与表达[D]. 无锡: 江南大学, 2010. |
| [38] | 李淑彬, 陆广欣, 林如妹, 等. 嗜热菌—工业用酶的新来源. 中国生物工程杂志 , 2003, 23 (7) : 67–71. |
| [39] | Hong MR, Kim YS, Park CS, et al. Characterization of a recombi-nant β-glucosidase from the thermophilic bacterium Caldicellulosi-ruptor saccharolyticus. Journal of Bioscience and Bioengine-ering , 2009, 108 (1) : 36–40. DOI:10.1016/j.jbiosc.2009.02.014 |
| [40] | 陈卫红, 李多川. 嗜热子囊菌光孢变种β-葡萄糖苷酶的基因克隆、表达及酶学性质分析. 应用于环境生物学报 , 2009, 15 (4) : 549–553. |