细胞色素P450 CYP51又名甾醇14- α-去 甲基化酶(Sterol 14α-demethylase),是唯一广泛存在于动物、植物、真菌、细菌中的细胞色素P450家族成员,也是抗真菌剂、除草剂以及降胆固醇药物的重要靶标酶。Sanborn 和 Williams [1]首次从伞树科蚕幼虫中检测到细胞色素b5(Cyt b5)。Cyt b5是一种位于内质网上的膜结合蛋白,氧化还原电势约为20 mV,能够接受来自NAD H-细 胞色素b5还原酶或者NADP H-细 胞色素P450还原酶的一个电子。还原型的Cyt b5为脂类的生物合成提供还原当量并且为氧化酶类如细胞色素P4 50传递第二个电子[2]。Cyt b5和Cyt b5r蛋白广泛分布于各种生物体中,包括酵母、昆虫、种子植物和动物。这两种蛋白通常 参与NADH依赖的电子传递,Cyt b5r接受NADH的两个电子并传递给Cyt b5,Cyt b5的亚铁血红素辅基由于缺乏一个自由配位点,所以它可作为一种电子传递体促进多种反应,包括P450单加氧化、脂肪酸脱饱和、脂肪酸链的延伸,甾类生成等[2-5]。
哺乳动物及酵母的细胞色素b5与b5还原酶(Cyt b5-Cyt b5r)在细胞色素P450单加氧化反应中的作用有过报道[6-9]。这些研究或是通过纯化Cyt b5、Cyt b5r和P450蛋白重建P450反应,进而进行体外分析[7, 9];或是通过敲除P450氧化还原酶(POR)进行体内实验分析[8, 10, 11]。还有的研究通过细菌共表达策略来探究这一现象[8]。Dong等[12]将人CYP3A4与Cyt b5共表达,发现CYP3A4表达水平比其单独表达高出20% - 60%。但是在细菌系统中很难对膜结合的哺乳动物蛋白进行评估,所以这些实验缺乏蛋白表达水平的定量分析[6]。研究发现,子囊菌中一株POR缺失突变株具有低水平的NADH依赖的P450单加氧酶活性,这表明在子囊菌体内还存在一种辅助性机制以还原P450[10]。随后Syed等[13]通过酵母共表达策略定量分析了白腐真菌黄孢原毛平革菌(Phanerochaete chrysosporium)Cyt b5r-Cyt b5复合物与P450功能的关系,研究发现在真菌中Cyt b5r-Cyt b5复合物可以向P450单加氧酶传递电子。
本研究通过多基因串联克隆载体pPICZαA构建指状青霉共表达质粒ppbrA(pPIC-Pdcyp51A-cyt b5-cyt b5r),首次从指状青霉中克隆表达HS-PdCyt b5和HS-PdCyt b5r蛋白,并通过共表达的方式研究cyp51A基因的功能,旨在探究指状青霉中Cyt b5-Cyt b5r系统对CYP51A转录表达水平的影响。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒指状青霉菌株HS-F6由本实验室分离并保存;大肠杆菌DH5α、毕赤酵母X-33、质粒pPICZαA本实验室保存。
1.1.2 试剂克隆载体pMD18-T、T4 DNA连接酶、限制性内切酶、DEPC、Trizol试剂,酵母RNA提取试剂盒、反转录试剂盒及荧光定量PCR试剂盒购自TaKaRa公司;真菌基因组提取试剂盒购自BioFlux公司;Taq-mix及DNA Marker DS5000购自东盛生物公司。引物合成和测序委托南京金斯瑞生物工程有限公司完成。
1.1.3 基因表达分析根据指状青霉转录组分析结果筛选到cyt b5和cyt b5r特异性序列[14],通过实时定量RT-PCR(qRT-PCR)测定cyp51A、cyt b5和cyt b5r的基因转录水平;使用的基因转录分析特异性引物列于表 1;gap作为荧光定量内参基因。
采集在PDB培养基中培养4 d的指状青霉菌丝,参照真菌基因组DNA提取试剂盒(Biospin)的说明提取指状青霉基因组DNA,cyt b5和cyt b5r的DNA全长序列以基因组DNA为模板PCR扩增获得。
1.2.2 指状青霉Cyt b5和Cyt b5r蛋白在E.coli中的异源表达克隆得到HS-Pdcyt b5,HS-Pdcyt b5r全长序列并测序验证后,通过特异性引物P1/P2、P3/P4插入酶切位点。采用BamH I和Xho I酶切HS-Pdcyt b5 cDNA;BamH I和Hind III酶切HS-Pdcyt b5r cDNA并克隆至pET28表达载体。酶切验证重组质粒正确后,转化E.coli BL21衍生菌株Rosetta Blue DE3(EMD Biosciences,Inc.,USA)。37 ℃ ,1 mol/L IPTG条件下诱导表达。
1.2.3 DNA序列的生物信息学分析采用NCBI BLAST分析HS-Pdcyt b5和HS-Pdcyt b5r的DNA序列。氨基酸序列或推定的氨基酸序列的多重比 对通过BioEdit进行分析;采用MEGA4构建系统树。HS-PdCyt b5,HS-PdCyt b5r的氨基酸序列在GenBank中的登录号分别为EKV18889.1、EKV08484。
1.2.4 重组共表达质粒pPIC-Pdcyp51A-cyt b5 -cyt b5r(ppbrA)的构建通过In-Fusion克隆技术将HS-Pdcyt b5和HS-Pdcyt b5r cDNA分别亚克隆至pPICZαA表达载体EcoRⅠ和KpnⅠ酶切位点之间,命名为pPI-b5和pPI-b5r(即pPIC-cyt b5、pPIC-cyt b5r)(引物为P7/P8、P9/P10)。Bgl II-BamHⅠ双酶切pPI-b5重组质粒,将HS-Pdcyt b5 cDNA序列连同启动子(AOX)和终止子(TT)序列一起亚克隆至pPICZαA的BamHⅠ位点处,成功构建了ppb(图 1)。Bgl II-BamHⅠ双酶切pPI-b5r重组质粒,将HS-Pdcyt b5r cDNA序列连同启动子(AOX)和终止子(TT)序列一起亚克隆至ppb质粒的BamHⅠ位点处,成功构建ppbr(图 1)。为成功构建三元重组子,将Pd cyp51A cDNA序列通过PmlⅠ位点插入ppbr中(引物为P5/P6),即得到重组共表达质粒ppbrA(pPIC-Pdcyp51A-cyt b5-cyt b5r,图 1)。分别以不含cyt b5-cyt b5r系统的重组质粒pPI-Pdcyp51A作为阳性对照,空载体pPICZαA为阴性对照。

|
| 图 1 重组共表达质粒ppbrA(pPIC-Pdcyp51A-cyt b5-cyt b5r)的构建 |
经SmaⅠ单酶切线性化重组质粒pPICZαA、ppbr、ppbrA,电击转化(1.5 kV,200 Ω,25 μF,4.0 ms)线性化的重组质粒,并整合到毕赤酵母(P. pastoris)X-33细胞基因组中。转化涂布含有博来霉素(Zeocin ,100 μg/mL)的YPDS平板,30 ℃ 培养 2-4 d,观察转化子的生长。将阳性克隆子依次转接至含高浓度Zeocin(1 000 μg/mL)的YPDS平板,筛选高浓度下正常生长的菌落即为高拷贝整合菌株。提取酵母基因组,通过PCR检测酵母中重组质粒的整合情况。将重组转化子和对照菌株接种于50 mL BMGY培养液中,30 ℃ 、200 r/min振荡培养1 6-2 0 h至OD600为 2-6 ,离心收集菌体,加BMMY培养基稀释至OD600为1.0。每隔24 h补加甲醇使其终浓度为1%(V/V)进行诱导表达。每隔24 h取样1 mL,8 000×g,4 ℃ 离心2 min,小心弃去上清,然后按照Yeast RNAiso Kit( TaKaRa 9751)操作要求提取酵母总RNA。
1.2.6 荧光定量PCR(qRT-PCR)分析荧光定量PCR在Bio-Rad CFX96荧光定量PCR仪上完成,荧光染料为SYBR Premix Ex Tag(Tli RnaseH Plus)(TaKaRa),特异性引物分别为P11/P12、P13/P14、P15/P16、P17/P18。热循环程序为:95 ℃ 3 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 20 s,42个循环;最后溶解梯度是从65 ℃ 升至95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。通过PCR产物的溶解曲线可以确定引物特异性。不同基因mRNA的Ct值采用管家基因gap进行标准化,用2-ΔΔCt计算方法来计算基因的相对表达量。每个基因做3个重复,整个实验重复3次。
2 结果 2.1 指状青霉cyt b5和cyt b5r基因克隆及系统进化分析根据指状青霉转录组结果分析,筛选到cyt b5基因和cyt b5r基因序列,设计特异性引物P3/P4、P5/P6并通过P CR克隆目的基因。测序分析表明,HS-Pdcyt b5和HS-Pdcyt b5r基因全长分别为846 bp和1 482 bp,均不含内含子,基因的GC含量分别为53.07%、53.78%。HS-PdCyt b5和HS-PdCyt b5r分别编码281个和493个氨基酸的蛋白质。
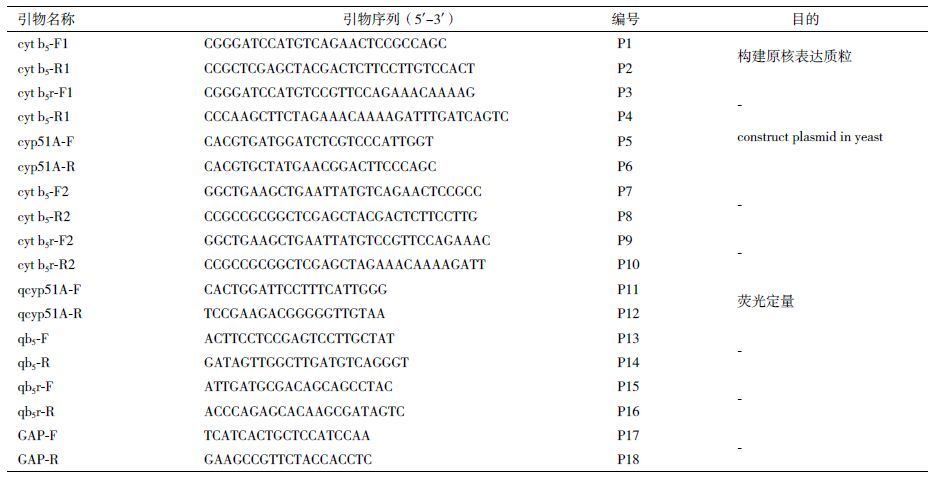
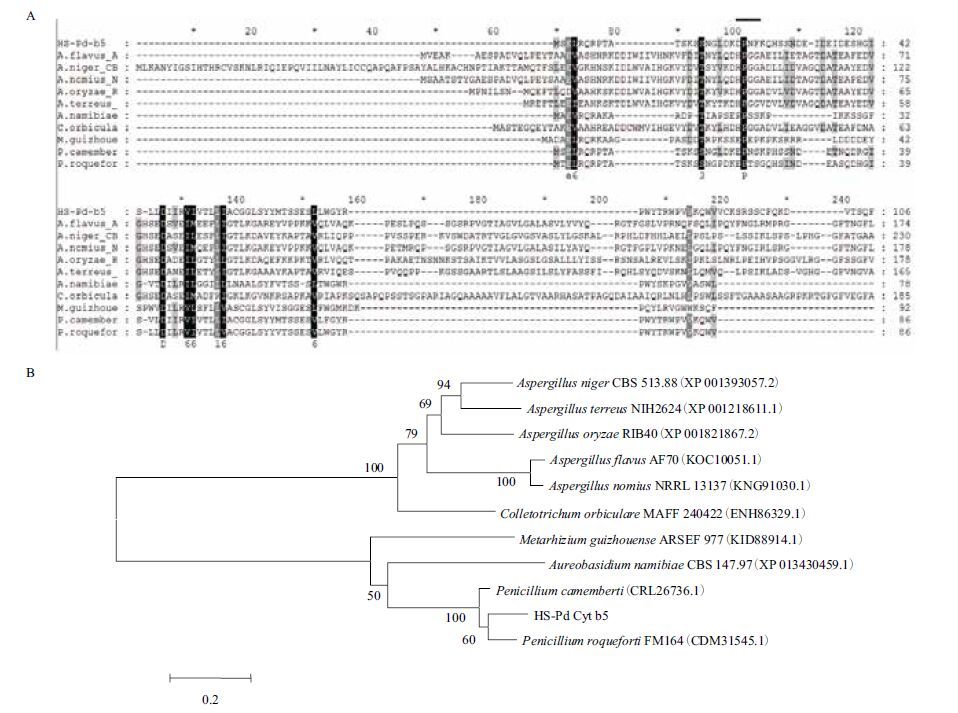
指状青霉Cyt b5蛋白与来自其他生物体种的同种蛋白分别进行多重序列比对,发现11种菌中只有6种菌的Cyt b5蛋白的亚铁血红素结合区有保守型残基HPGG(His、Pro、Gly、Gly);HS-PdCyt b5及另外4种蛋白不含此保守序列(图 2-A)。这表明HS-PdCyt b5不含此保守区并不是特例,在众多的细胞色素b5蛋白中,尚未研究的还很多,这一现象目前还不能地好地解释。系统进化分析发现主要分为两个分支,HS-PdCyt b5与罗克福尔青霉菌(Penicillium roqueforti)同源,一致性为75%(图 2-B)。
|
| 图 2 HS-PdCyt b5与各类菌种Cyt b5蛋白序列多重比对(A)及进化树(B) |
细胞色素b5还原酶蛋白的多重序列比对结果(图 3-A)显示,HS-PdCyt b5r具有典型的核黄素结合域RXY(T/S)XX(S/N),在推测蛋白中对应位置是R301至S307。指状青霉Cyt b5r蛋白序列与其他菌属中的Cyt b5r蛋白序列同源性极高,表明它们可能拥有相同的功能特征。通过构建系统进化树可以发现主要分为两个分支,HS-PdCyt b5r蛋白与卡孟培尔青霉菌(Penicillium camemberti)同源,一致性为85%(图 3-B)。

|
| 图 3 HS-PdCyt b5r与各类菌种Cyt b5r蛋白序列多重比对(A)及进化树(B) |
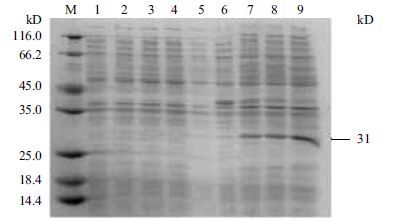
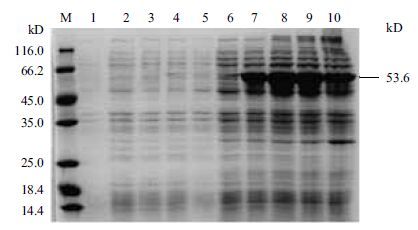
指状青霉Cyt b5和Cyt b5r蛋白在E.coli中均成功表达。SDS-PAGE分析(图 4)显示,37 ℃ 培养条件下,1.0 mmol/L IPTG诱导6 h后,指状青霉Cyt b5蛋白表达量达到最大;特异性表达蛋白分子量约为31 kD。随着诱导时间的延长指状青霉Cyt b5r蛋白表达量逐渐增加,诱导6 h后Cyt b5r蛋白表达量达到最大,蛋白分子量约为53.6 kD(图 5)。
|
| 图 4 指状青霉Cyt b5蛋白在E.coli中的异源表达 M:标准蛋白分子量;1 - 4:带有pET28质粒的E. coli分别诱导0、3、6、9 h;5 - 9:含重组质粒pETcytb5的工程菌分别诱导0、3、6、9、12 h |
|
| 图 5 指状青霉Cyt b5r蛋白在E.coli中的异源表达 M:标准蛋白分子量;1-5:带有pET28质粒的E. coli分别诱导0、3、6、9、12 h;5-9:含重组质粒pET-cytb5r的工程菌分别诱导0、3、6、9、12 h |
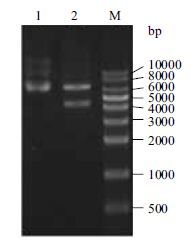
重组质粒经BamHⅠ单酶切鉴定,分别得到一条7.0 kb的基因片段及一条4.5 kb的基因片段(图 6),片段大小与预期一致。测序结果表明构建的重组共表达质粒ppbrA序列无突变及其他错误。
|
| 图 6 重组质粒ppbrA的酶切验证 M:DNA分子量;1:重组质粒ppbrA;2:BamH I酶切重组质粒ppbrA |
经SmaⅠ单酶切线性化pPICZαA、ppbr及共表达质粒ppbrA,电击转化线性化的重组质粒,并整合到毕赤酵母X-33细胞基因组中。转化涂布含有Zeocin(100 μg/mL)的YPDS平板,30 ℃ 培养 2-4 d,观察转化子的生长。将阳性克隆子依次转接至含高浓度Zeocin(1 000 μg/mL)的YPDS平板,筛选阳性重组酵母工程菌P. pastoris-ppbrA(即含有重组共表达质粒ppbrA);获得了2株高拷贝整合菌株P. pastoris-ppbrA1和P. pastoris-ppbrA2。
重组酵母工程菌经1%(V/V)甲醇诱导,荧光定量分析P. pastoris-ppbrA1共表达对cyp51A在酵母中表达水平的影响。qRT-PCR分析结果(图 7)表明,诱导不同时间后,在共表达系统ppbrA/P.pastoris及其单独表达系统pPI-cyp51A/P.pastoris中,cyp51A基因表达水平均发生上调,但在共表达系统中cyp51A转录表达水平上调显著。与cyt b5/cyt b5r共表达后cyp51A转录表达水平比其单独表达水平高54%-97%,并维持较长时间(4 8-7 2 h)各组数据之间差异及其显著。由于数据值较大,纵坐标为表达比率取log2之后的值。

|
| 图 7 指状青霉cyp51A基因的qRT-PCR分析 **P<0.01 |
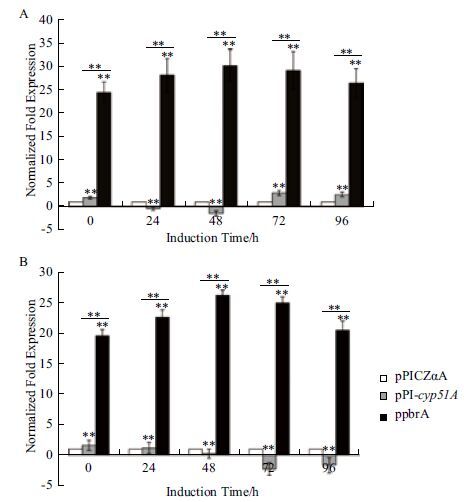
在ppbrA/P.pastoris系统中,各个取样时间点cyt b5基因转录表达水平均发生上调,而在pPI-cyp51A/P.pastoris系统中,cyt b5基因转录表达趋势是先下调再上调,且上调幅度显著低于共表达系统(图 8-A)。就cyt b5r基因而言,在ppbrA/P.pastoris系统中,各个取样时间点cyt b5r基因转录表达水平均发生上调,相反在pPI-cyp51A/P.pastoris系统中,cyt b5基因转录表达水平呈缓慢下调趋势;同样的共表达系统中cyt b5r基因表达上调幅度显著高于pPI-cyp51A/P.pastoris系统(图 8-B)。由于数据值较大,纵坐标为表达比率取log2之后的值。
|
| 图 8 指状青霉cyt b5(A)及cyt b5r(B)基因的qRT-PCR分析 **P<0.01 |
肝脏中小的外源性或异生型物质的氧化是通过一系列蛋白质传递电子给细胞色素P450超家族而完成的。NADPH和NADH是电子的主要来源,NADPH和NADH的电子可分别还原Cyt P450还原酶、Cyt b5r,而这两个酶又将电子分别传递给细胞色素P450及Cyt b5。Cyt P450还原酶还可以还原Cyt b5。氧化态的Cyt P450获得电子后就可用于催化其底物的氧化。
研究表明,膜结合的全长Cyt b5可以与微粒体Cyt P450s相互作用。Cyt P450与Cyt b5的结合非常牢固,例如Cyt P450 2B4与Cyt b5的Kd值为0.0 7-0 .2 μmol/L[15,16]。基于对Cyt P450亚型和底物特异性的研究,发现Cyt b5有时可以提高Cyt P450的代谢更新速度,有时不起作用,有时甚至抑制Cyt P450的酶促作用。Zhang等[17]的研究阐述了Cyt b5对于Cyt P450酶活力的多样性作用的原因。该研究认为当Cyt b5与Cyt P450还原酶的摩尔比较低时,Cyt b5促进Cyt P450 2B4的活性,因为在Cyt b5存在条件下产物的合成速率是Cyt P450还原酶条件下合成速率的10倍甚至100倍,而这反过来也使得NADPH更多的用于代谢而非合成副产物。当Cyt b5与Cyt P450还原酶的摩尔比较高时,Cyt b5与CYP 2B4结合从而抑制了Cyt P450还原酶的活性。Zhang等[18]运用核磁共振技术研究了兔Cyt b5与CYP2B4的关系,发现与Cyt b5-CYP2B4(未结合底物)复合物相比,Cyt b5-CYP2B4(已结合底物)复合物对离子强度的依赖性更低,表明已结合了底物的CYP2B4可以形成一个大片段的立体定向复合物,而CYP2B4的底物可能具有促进Cyt b5与CYP2B4特异性相互作用的功能。最新研究发现,人肝脏微粒体(HLM)中Cyt b5蛋白含量与CYP1A2、2B6、2E1总活性密切相关,而且Cyt b5蛋白对多形态CYP1A2、2B6、2E1的影响作用依赖于单核苷酸多态性(SNP),表明Cyt b5蛋白在CYP介导的活动中具有重要作用,而且可能是导致个体CYP酶活性变异的影响因素[19]。
体外实验中,加入肝脏微粒体后,可观察到NADH具有促进P450介导的药物代谢的功效,这一现象表明Cyt b5r-Cyt b5电子传递途径也可能参与P450介导的反应。Vishwesh等[20]的研究证明Cyt b5r-Cyt b5电子传递途径可维持人CYP2E1在细菌细胞中的活性,而Cyt b5r或Cyt b5单独存在时则不具有此作用。Cyt b5-Cyt b5r复合物在细胞色素P450单加氧化反应中的作用在酵母中有过报道。Lamb 等[9]纯化得到了白色念珠菌(Candida albicans)CYP51的蛋白及酵母菌NADPH 细胞色素P450还原酶(CPR)、Cyt b5、Cyt b5r蛋白,发现Cyt b5-NADH Cyt b5r电子运输系统能够完全地并有效地增强由真菌CYP51介导的甾醇14 α-去 甲基化作用;在酵母CPR缺失突变株中,依然可以检测到麦角甾醇,是因为Cyt b5-NADH Cyt b5r可以传递第一和第二个电子,从而形成催化循环,起到代替CPR的作用。随后Syed 等[13]通过酵母共表达策略定量分析了白腐真菌黄孢原毛平革菌(P.chrysosporium)中Cyt b5r-Cyt b5复合物与P450功能的关系,研究发现在P.chrysosporium中Cyt b5r-Cyt b5复合物可以代替P450氧化还原酶(POR)向Pc-P450 CYP63A2传递电子用于苯并芘的单加氧化反应,而且其作用效率与POR相当。在体外实验中,Cyt b5r以NADH为电子供体还原Cyt b5的结果表明这两种蛋白有可能通过形成一种活性复合物而起作用[11]。根据cyt b5和cyt b5r基因的转录表达水平,以及它们作为一个复合物发挥功能的能力来看,可以大胆推测此复合物可以为指状青霉(P.digitatum)的P450传递电子,本实验验证了该设想。
4 结论本研究以指状青霉为材料,克隆得到了cyt b5与 cyt b5r基因,并且在原核中成功表达。接着以多基因串联克隆载体pPICZαA为骨架构建了指状青霉共表达质粒ppbrA,电转化法将重组质粒ppbrA导入毕赤酵母X-33中。qRT-PCR分析结果显示,CYP51A与Cyt b5-Cyt b5r共表达后,其基因表达水平升高54% - 97%,并维持较长时间(4 8-7 2 h)。表明Cyt b5-Cyt b5r系统可将电子高效转移给CYP51A,从而增强cyp51A基因的转录表达。
| [1] | Sanborn RC, Williams CM. The cytochrome system in the Cecropia Silkworm, with special reference to the properties of a new component. Journal of General Physiology , 1950, 33 (5) : 579–588. DOI:10.1085/jgp.33.5.579 |
| [2] | Hildebrandt A, Estabrook RW. Evidence for the participation of cytochrome b5 in hepatic microsomai mixed-function oxidation reactions. Archives of Biochemistry and Biophysics , 1971, 143 (1) : 66–79. DOI:10.1016/0003-9861(71)90186-X |
| [3] | Shimakata T, Mihara K, Sato R. Reconstitution of hepatic microsomal stearoyl-coenzyme A desaturase system from solubilized components. Journal of Biological Chemistry , 1972, 72 (5) : 1163–1174. |
| [4] | Keyes SR, Alfano JA, Jansson I, et al. Rat liver microsomal elongat-ion of fatty acids. Possible involvement of cytochrome b5. Journal of Biological Chemistry , 1979, 254 (16) : 7778–7784. |
| [5] | Storbeck KH, Swart AC, Goosen P, et al. Cytochrome b5: Novel roles in steroidogenesis. Molecular and Cellular Endocrinology , 2013, 371 (1-2) : 87–99. DOI:10.1016/j.mce.2012.11.020 |
| [6] | Mokashi V, Li L, Porter TD. Cytochrome b5 reductase and cytochrome b5 support the CYP2E1-mediated activation of nitrosamines in a recombinant Ames test. Archives of Biochemistry and Biophysics , 2003, 412 (1) : 147–152. DOI:10.1016/S0003-9861(03)00040-7 |
| [7] | Kurian JR, Bajad SU, Miller JL, et al. Trepanier LA. NADH cytochrome b5 reductase and cytochrome b5 catalyze the microsomal reduction of xenobiotic hydroxylamines and amidoximes in humans. Journal of Pharmacology and Experimental Therapeutics , 2004, 311 (3) : 1171–1178. DOI:10.1124/jpet.104.072389 |
| [8] | Li L, Porter TD. Chlorzoxazone hydroxylation in microsomes and hepatocytes from cytochrome P450 oxidoreductase-null mice. Journal of Biochemical and Molecular Toxicology , 2009, 23 (5) : 357–363. DOI:10.1002/jbt.v23:5 |
| [9] | Lamb DC, Kelly DE, Manning NJ, et al. Biodiversity of the P450 catalytic cycle: Yeast cytochrome b5/NADH cytochrome b5 reductase complex efficiently drives the entire sterol 14-demethylation(CYP51)reaction. Febs Letters , 1999, 462 (3) : 283–288. DOI:10.1016/S0014-5793(99)01548-3 |
| [10] | Troncoso C, Carcamo J, Hedden P, et al. Influence of electron transport proteins on the reactions catalyzed by Fusarium Fujikuroi gibberellin monooxygenases. Phytochemistry , 2008, 69 (3) : 672–683. DOI:10.1016/j.phytochem.2007.08.026 |
| [11] | Subramanian V, Doddapaneni H, Syed K, et al. P450 redox enzymes in the white rot fungus Phanerochaete chrysosporium: gene transcription, heterologous expression, and activity analysis on the purified proteins. Current Microbiology , 2010, 61 (4) : 306–314. DOI:10.1007/s00284-010-9612-7 |
| [12] | Dong MS, Lee SB, Kim HJ. Co-expression of human cytochrome b5 increases expression of cytochrome P450 3A4 in Escherichia coli by stabilizing mRNA. Protein Expression and Purification , 2013, 89 (1) : 44–50. DOI:10.1016/j.pep.2013.02.010 |
| [13] | Syed K, Kattamuri C, Thompson TB, et al. Cytochrome b5 reductase-cytochrome b5 as an active P450 redox enzyme system in Phanerochaete chrysosporium: atypical properties and in vivo evidence of electron transfer capability to CYP63A2. Archives of Biochemistry and Biophysics , 2011, 509 (1) : 26–32. DOI:10.1016/j.abb.2011.02.023 |
| [14] | Liu J, Wang SQ, Qin TT, et al. Whole transcriptome analysis of Penicillium digitatum strains treatmented with prochloraz reveals their drug-resistant mechanisms. BMC Genomics , 2015, 16 (1) : 855. DOI:10.1186/s12864-015-2043-x |
| [15] | Bridges A, Gruenke L, Chang YT, et al. Identification of the binding site on cytochrome P450 2B4 for cytochromeb5 and cytochrome P450 reductase. Journal of Biological Chemistry , 1998, 273 (27) : 17036–17049. DOI:10.1074/jbc.273.27.17036 |
| [16] | Clarke TA, Im SC, Bidwai A, et al. The role of the length and sequence of the linker domain of cytochrome b5 in stimulating cytochrome P450 2B4 catalysis. Journal of Biological Chemistry , 2004, 279 (35) : 36809–36818. DOI:10.1074/jbc.M406055200 |
| [17] | Zhang H, Im SC, Waskell L. Cytochrome b5 increases the rate of product formation by cytochrome P450 2B4 and competes with cytochrome P450 reductase for a binding site on cytochrome P450 2B4. Journal of Biological Chemistry , 2007, 282 (41) : 29766–29776. DOI:10.1074/jbc.M703845200 |
| [18] | Zhang M, Le Clair SV, Huang R, et al. Insights into the role of substrates on the interaction between cytochrome b5 and cytochrome P450 2B4 by NMR. Scientific Reports , 2015, 5 : 8392. DOI:10.1038/srep08392 |
| [19] | Zhang H, Gao N, Liu TT, et al. Effect of cytochrome b5 content on the activity of polymorphic CYP1A2, 2B6, and 2E1 in human liver microsomes. PLoS ONE , 2015, 10 (6) : e0128547. DOI:10.1371/journal.pone.0128547 |
| [20] | Vishwesh M, Li L, Todd DP. Cytochrome b5 reductase and cytochrome b5 support the CYP2E1-mediated activation of nitrosamines in a recombinant Ames test. Archives of Biochemistry and Biophysics , 2003, 412 (1) : 147–152. DOI:10.1016/S0003-9861(03)00040-7 |