目前研究认为,癌症发生的主要原因是细胞增殖和细胞死亡失调,后者包括程序性死亡(如细胞凋亡)和非程序性死亡。当前存在许多治疗各种癌症的化学药物[1],但因其毒副作用大,以及肿瘤细胞易对其产生耐药性而在临床上受到限制[2]。抗菌肽(AMPs)是一组在先天免疫防御中发挥重要作用的天然分子[3]。与目前广泛使用的化疗药物相比,抗菌肽具有抗肿瘤细胞活性而对正常细胞几乎无毒害作用,而且尚未发现肿瘤细胞对其产生耐药性[4]。例如LL-37,唯一一个来自人的免疫防御肽,可以诱导结肠癌细胞凋亡[5]。因此,抗菌肽有望成为一种新型的抗肿瘤药物。
在许多亚洲国家,少棘蜈蚣毒液及机体被广泛用来治疗神经、呼吸道和心血管疾病。然而,来自蜈蚣且已报道的蛋白或多肽类却寥寥无几[6]。其中scolopendin 1 和 scolopendin 2是分别来自于少棘蜈蚣毒液的同源抗菌肽,分子量分别为5.270 kD和1.781 kD[7, 8]。本研究所涉及到的另一种来自于少棘蜈蚣毒液的新型AMP-scolopin 2也已被分离出来,氨基酸序列为GILKKFMLHRGTKVYKMRTLSKRSH,分子量为3.018 kD,具有广谱抗菌活性,对多种革兰氏阳性菌、阴性菌和真菌都有抗菌活性[9]。
由于大肠杆菌具有表达水平高、培养简单和成本低廉等特点,常被作为首选的重组蛋白表达的宿主。然而,重组蛋白在大肠杆菌中的表达常以包涵体的形式存在,可溶性很低。SUMO是一种可以共价连接到其它特定靶蛋白上的修饰蛋白,具有亲水表面和疏水核心,这样它可以通过类似于去污剂效应来增强靶蛋白的可溶性[10]。此外,SUMO蛋白裂解酶能识别SUMO标签蛋白序列,并能高效且完整地把SUMO从融合蛋白上切割下来[11]。家蚕AMP-CM4已通过SUMO融合表达纯化系统成功地进行了表达[12, 13]。本实验尝试利用该表达体系对少棘蜈蚣AMP-scolopin 2进行表达并研究其活性,旨在探究一种新型抗菌肽AMP-scolopin 2的抑制肿瘤细胞增殖和促进肿瘤细胞凋亡的活性功能及其作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物、菌株与细胞株实验小鼠购自南京大学模式动物研究中心;大肠杆菌E. coli BL21(DE3)、K12D31、DH5α、pSUMO、肝癌细胞株Hep-G2和白血病细胞株K562均由本实验室保存。
1.1.2 试剂和耗材凝胶回收试剂盒、质粒小提试剂盒购自Axygen公司;限制性内切酶Hind Ⅲ和Stu I、T4 DNA ligase、Taq DNA聚合酶、DNA Marker和蛋白质Marker购自TaKaRa Biotech 公司;碱性磷酸酶和磷酸激酶购自Fermentas公司;Tyrptone和Yeast Extract购自OXOID公司;鼠His6一抗和羊抗鼠IgG购自TIANGEN公司;FITC标记的羊抗鼠IgG抗体购自R&D Systems公司;IPTG购自Promega公司;SDS、Kan、Acr和Bis购自Amresco公司;TEMED购自Bio-Rad公司;0.22 μm的无菌滤器购自Millipore公司;DMEM培养基、RPMI1640和FBS购自GIBCO公司;细胞培养板购自Costar公司;所需引物由上海Invitrogen公司合成。
1.1.3 实验仪器PTC-200 PCR仪(美国MJ Resea-rch公司)、CO2培养箱(日本NAPCO公司)、低温离心机(美国Sigma公司)、摇床(江苏太仓)、Mu-ltiTempⅢ恒温水浴锅、高速离心机(Eppendorf公司)、水平板电泳(美国Bio-Rad)、电热干燥箱(熊猫公司)、凝胶图像采集与分析软件(Ultra-Violet公司)、超纯水仪(Sartorius 公司)、流式细胞仪(美国BD公司)、ELx800型酶联免疫检测仪(美国BLO-TEK公司)、JY92-2D超声波细胞粉碎机(中国新芝科器研究所)、倒置显微镜(美国COIC公司)、Allegar 21R台式高速冷冻离心机(美国BECKMAN公司)、超净工作台(中国苏净集团)。
1.2 方法 1.2.1 PCR扩增scolopin2基因 利用大肠杆菌密码子偏爱性软件(http://www.ebi.ac.uk/Tools/st/emboss_backtranseq/)设计AMP-scolopin 2的引物:P1:5′-GGTATCCTGAAGAAATTCATGCTGCATCGTGGTACCAAAGTTTAC-3′;P2:5′-ATGAGAACGTTTAGACAGGGTACGCATTTTGTAAACTTTGGTACC-3′。用上述引物进行PCR反应。扩增参数:94 ℃ 预变性5 min;94 ℃ 变性30 s,50 ℃ 延伸30 s,72 ℃ 退火20 s,30个循环;72 ℃ 延伸7 min。进行2.5﹪琼脂糖凝胶电泳观察扩增产物,利用Axygen胶回收试剂盒割胶纯化scolopin 2基因。
1.2.2 融合表达载体的构建根据以上PCR纯化得到的scolopin 2模板,设计一对分别含有Stu I和Hind Ⅲ酶切位点的基因特异性引物:P3:5′-TGGAGGCCTAAGAAATTCA-3′(Stu I);P4:5′-CCCAAGCTTTCAATGAGAAC-3′(Hind Ⅲ)。用上述引物进行PCR反应。扩增参数:94 ℃ 预变性5 min;94 ℃ 变性30 s,50 ℃ 延伸30 s,72 ℃ 退火20 s,30个循环;72 ℃ 延伸7 min。进行2.5﹪琼脂糖凝胶电泳观察扩增产物,利用Axygen胶回收试剂盒割胶纯化SUMO-scolopin 2基因。
接种含空质粒pSUMO的E. coli DH5α空质粒单克隆于3 mL 含E. coli DH5α的LB培养液培养基中(含Kan+终浓度为50 μg/mL),37 ℃ 振荡培养过夜;用AxyGEN质粒提取试剂盒提取并纯化pSUMO质粒;Stu I和Hind Ⅲ双酶切以上PCR产物和pSUMO质粒,通过连接反应,将获得的连接产物转入感受态细胞E. coli DH5α;最后挑选阳性克隆(8个)送上海英潍捷基公司测序并鉴定。
1.2.3 SUMO-scolopin2蛋白表达纯化 将测序正确的融合表达载体转入表达菌E. coli BL21(DE3)中,利用IPTG(0.5 mmol/L)诱导SUMO-scolopin 2表达,经Ni柱亲和层析纯化后得SUMO-scolopin 2蛋白,最后进行Western blot鉴定。
1.2.4 AMP-scolopin2的切割与纯化 将上述纯化后的SUMO-scolopin 2蛋白与SUMO蛋白酶以1 ∶ 100(V/V)比例混合,30 ℃ 水浴1 h;将酶切混合物进行Ni柱亲和层析,收集流出液;进行SDS-PAGE检测。
1.2.5 重组蛋白AMP-scolopin 2的生物活性检测 1.2.5.1 抗菌活性检测采用琼脂糖孔穴扩散法测定AMP-scolopin 2对E. coli K12D31的抗菌活性。将培养至对数生长期的E. coli K12D31按终浓度为1%的量加至融化的液体LB培养基中,混匀后倒平板,待凝固后,在无菌条件下打孔,加入待测样品于37 ℃ 培养8 h,观察抑菌活性。
1.2.5.2 MTT细胞增殖抑制作用将1×105个/mL的K562、HepG2和HEK293细胞分别接种于96孔板,0.2 mL/孔;待培养4 h后,分别加不同浓度的AMP-scolopin 2于37 ℃ 培养24 h,吸去废液,每孔加入20 μL MTT(5 mg/mL)和80 μL培养基,培养4 h后小心弃掉上清,每孔加150 mL DMSO,避光振荡15 min;在酶标仪490 nm处测定吸光值。
1.2.5.3 细胞凋亡检测分别将1×106个/mL的K562和HepG2细胞接种于6孔板,培养4 h后,加入不同浓度的AMP-scolopin 2处理12 h,收集各组细胞;分别按Annexin V-FITC/PI apoptosis kit试剂盒说明书操作,用FACS Calibur流式细胞仪检测。
1.2.5.4 Western blot检测接1×106个/mL的K562和HepG2细胞于6孔板,培养4 h,加不同浓度AMP-scolopin 2处理12 h后收集于1.5 mL离心管中;分别加100 μL loadingbuffer裂解细胞,并超声破碎后进行SDS-PAGE电泳;转膜于硝酸纤维素膜(NC)上,TBST(8.8 g NaCl,20 mL 1 mol/L的Tris-HCl,0.5 mL Tween20,pH8.0)振荡洗3次,每次5 min;用5%(W/V)的脱脂奶粉缓慢振荡封闭1 h;一抗4 ℃ 孵育过夜;TBST振荡洗3次,每次5 min;二抗室温孵育1 h;同样经PBST清洗后,使用奥德赛扫描NC膜并分析结果。
1.2.5.5 溶血性实验小鼠眼球取血1.5 mL,3 000×g 水平离心15 min后弃掉上清;加入5 mL 0.9%的生理盐水洗至上清澄清;按8%(V/V)稀释后,每孔加200 μL于96孔板中;生理盐水(NS)为阴性对照,Triton X-100为阳性对照,其余加不同浓度的AMP-scolopin 2,均37 ℃ 孵育1 h后,在酶标仪414 nm处检测吸光值;溶血性的计算公式为:(Apeptide-ANS)/(ATritonX-100-ANS)。
2 结果 2.1 SUMO-scolopin 2克隆及其融合蛋白表达体系的构建克隆所得AMP-scolopin 2的基因序列为75 bp,构建融合表达载体pSUMO-scolopin 2为5 550 bp左右(图 1-A),通过测序验证,融合表达载体序列完全正确。转入pSUMO-scolopin 2质粒的E. coli BL21(DE3)在IPTC诱导之后,37 ℃ 振荡培养。离心后取其上清液及经过镍柱层析的洗脱液进行SDS-PAGE电泳,结果(图 1-B)显示,经IPTG诱导之后在约23 kD处出现了一条带,免疫印迹证明,这条带是融合蛋白SUMO-scolopin 2。
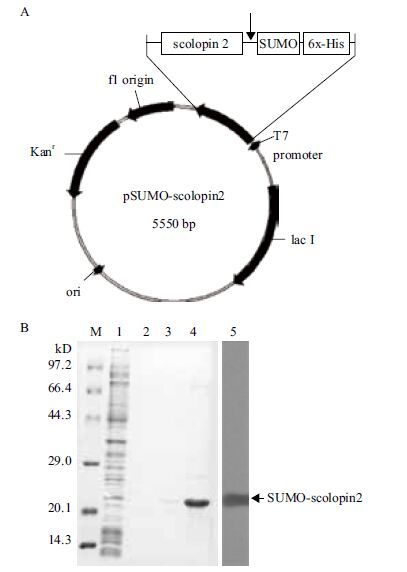
|
| 图 1 SUMO-scolopin 2表达体系的构建 A:pSUMO-scolopin 2 融合表达载体的构建;B:镍柱亲和层析获得融合蛋白。M:DNA Marker;1:经IPTC诱导的转入pSUMO-scolopin 2的E. coli BL21(DE3)上清液;2,3:亲和层析洗脱液;4:亲和层析洗脱液浓缩后;5:Western blotting |
融合蛋白表达纯化后,使用SUMO特异性的切割酶进行了切割,结果(图 2)显示,Tricine/SDS-PAGE得到了约3 kD的scolopin 2蛋白和约20 kD的SUMO标签,又经过一次Ni柱亲和层析,得到了单一条带的AMP-scolopin 2蛋白。
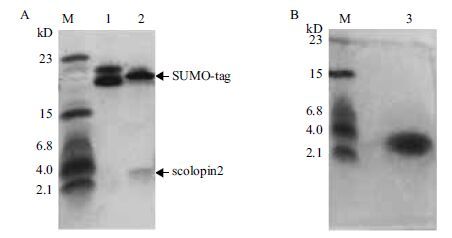
|
| 图 2 Tricine/SDS-PAGE进行重组目的蛋白切割(A)与纯化(B) M:蛋白Marker;1:融合蛋白;2:融合蛋白经酶切后为SUMO标签蛋白和scolopin 2蛋白;3:亲和层析获得目的蛋白AMP-scolopin 2 |
为了检测AMP-scolopin 2的抗菌活性,使用了敏感菌株E. coli K12D31作为试验菌的琼脂糖孔穴扩散法。结果(图 3)显示,SUMO-scolopin 2在融合状态下并没有抗菌活性,AMP-scol-opin 2具有与化学合成的抗菌肽相似的抗菌活性。

|
| 图 3 孔穴法检测重组抗菌肽的抗菌活性 1:PBS;2:SUMO-scolopin 2(20 μmol/L);3:化学合成AMP-scolopin 2(20 μmol/L);4:重组AMP-scolopin 2(15 μmol/L) |
通过对癌细胞毒性的筛选,发现AMP-scolopin 2对白血病细胞K562和肝癌细胞HepG2具有抑制增殖的作用。实验中,两种细胞都表现出对AMP-scolopin 2具有浓度依赖性增殖抑制作用,如图 4所示,用10 μmol/L scolopin 2处理K562细胞就会导致80%存活,而用60 μmol/L scolopin 2处理细胞,则会导致存活率降低到20%,半数致死率的浓度IC50为25 μmol/L;在HepG2细胞中,半数致死率的浓度为50 μmol/L。
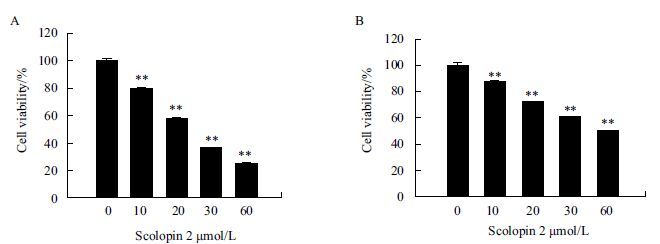
|
| 图 4 MTT检测AMP-scolopin 2对肿瘤细胞增殖的抑制作用 A:不同浓度AMP-scolopin 2对K562细胞毒性;B:不同浓度AMP-scolopin 2对 HepG2细胞毒性;**:差异极显著(P<0.01,n=3,x±s),下同 |
使用流式细胞仪通过Annexin V 和碘化丙啶(PI)双染发现,AMP-scolopin 2可以通过凋亡作用抑制细胞增殖。如图 5所示,40 μmol/L AMP-scolopin 2可以明显地引起21.4% K562细胞凋亡;AMP-scolopin 2在HepG2细胞中,存在相似作用。
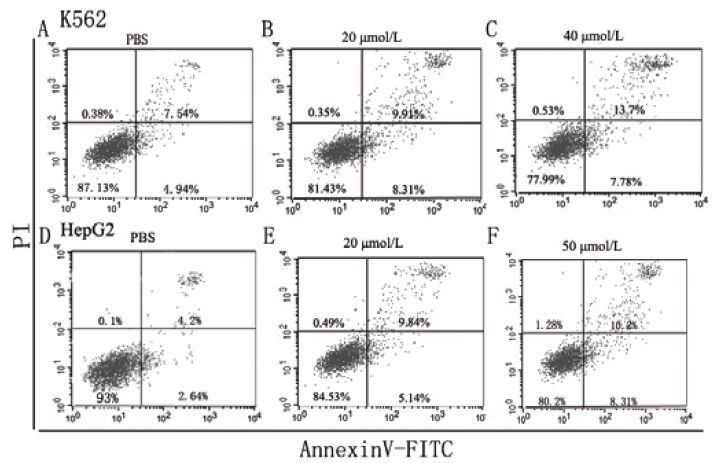
|
| 图 5 流式细胞术检测AMP-scolopin 2对肿瘤细胞的促凋亡作用 A - C:K562细胞,PBS:阴性对照;AMP-scolopin 2浓度:20和40 μmol/L。D - F:HepG2细胞;PBS:阴性对照;AMP-scolopin 2浓度:20和50 μmol/L |
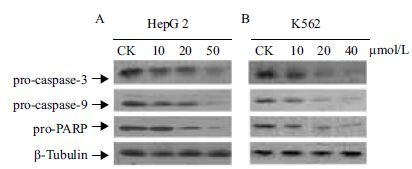
为了进一步确认细胞的凋亡通路,检测了细胞凋亡相关蛋白pro-caspase-3、pro-caspase-9和pro-PARP。Western blotting实验结果(图 6)显示,在K562和HepG2细胞中,pro-caspase-3 随着AMP-scolopin 2的浓度依赖性地减少,表明pro-caspase-3被切割,暗示了caspase-3已被激活,且检测到其上游蛋白pro-caspase-9也下调,更证明了这一点。另外,还检测到caspase-3的下游蛋白pro-PARP也表现出同样下降的趋势。
|
| 图 6 Western blotting检测细胞凋亡的分子机制相关蛋白 A:HepG2细胞;CK:阴性对照组;AMP-scolopin 2浓度:10、20和50 μmol/L;B:K562细胞;CK:阴性对照组;AMP-scolopin 2浓度:10、20和40 μmol/L |
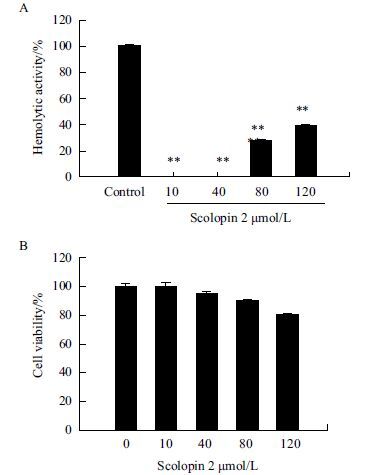
为了检测重组蛋白的毒副作用,对小鼠红细胞进行了溶血性实验,使用人胚肾细胞HEK293进行了增殖抑制实验。图 7-A显示,在实验用量范围内,无溶血活性,即使AMP-scolopin 2浓度加大至远高于IC50的120 μmol/L时,也仅出现30%的溶血;图 7-B显示,当AMP-scolopin 2的浓度达到120 μmol/L时,细胞存活率仍为80%,与对照组无明显差别,故在实验用量范围内,AMP-scolopin 2对正常细胞(HEK293)的毒副作用很小。
|
| 图 7 AMP-scolopin 2对红细胞和正常细胞的毒性研究 A:不同浓度梯度的AMP-scolopin 2对红细胞的溶血性检测;B:不同浓度梯度AMP-scolopin 2对正常细胞(HEK293)的存活率检测 |
少棘蜈蚣栖身土壤,生存环境中不可避免存在着致病菌,在捕食和遭遇外来侵害时,激发其产生一系列的抗菌物质。蜈蚣的毒腺位于头部颚肢,捕食时,将毒颚刺入猎物体内并注入毒液,使之麻痹甚至死亡。Rates等[14]研究表明,少棘蜈蚣的毒液具有很重要的生物学研究价值。Peng等[9]从少棘蜈蚣毒液中分离得到两种抗菌肽,命名为scolopin 1 和scolopin 2,其氨基酸序列分别为FLPKMSTKLRVP-YRRGTKDYH 和 GILKKFMLHRGTKVYKMRTLSKR-SH。AMP-scolopin 2具有广谱抗菌活性,对人和兔红细胞有溶血性,但对抗肿瘤活性的研究尚无报道[9]。
本实验室对原核表达系统做了较多研究,如Trx和Nus等蛋白标签,它们采用化学方法或蛋白酶切的方式从融合蛋白上去除。这些方式最大的弊端就是在蛋白的N端留下一个多余的氨基酸,而蛋白质的N端对于蛋白质的稳定性、功能的发挥或者修饰都起着重要的作用。在本实验中,使用SUMO 特异性蛋白酶切割的方法去掉SUMO标签,切割之后,在N端没有留下多余的氨基酸。SUMO酶是一种可以识别标签蛋白的三级结构的酶,能够在SUMO蛋白的C端两个甘氨酸处切割[11, 15]。本研究首次构建了pSUMO-scolopin 2原核表达载体,通过优化表达体系,最后得到目的蛋白AMP-scolopin 2;进行抗菌活性实验,表明与化学合成的抗菌肽具有相似活性,对后面进一步改造、修饰该抗菌肽做好充足的准备。
在哺乳动物细胞中,细胞凋亡通常通过两条caspase-dependent(胱天蛋白酶依赖)分子途径,即内源性和外源性途径[16]。本实验首先证明AMP-scolopin 2 对白血病细胞K562、肝癌细胞HepG2具有抑制增殖作用,然后通过流式细胞仪检测AMP-scolopin 2处理上述细胞,发现AMP-scolopin 2可以通过诱导凋亡的方式来杀伤肿瘤细胞。细胞中caspase-3是细胞凋亡中起最终执行作用的重要剪切酶,以低活性酶原pro-caspase-3的形式合成,只有当pro-caspase-3被活化后才能发挥作用;而非活化态pro-caspase-3可被上游活化态分子caspase-9切割成活化状态(即:两个cleaved caspase-3),进而激活下游信号蛋白PARP,最终导致细胞凋亡[16, 17]。通过对引起细胞凋亡的线粒体通路的下游分子检测发现,pro-caspase-3、pro-caspase-9和pro-PARP的被切割程度随着AMP-scolopin 2浓度的递增而增强,说明AMP-scolopin 2可以通过线粒体通路引起细胞的凋亡,从而在体外达到抑制肿瘤细胞增殖的效果。另外,体外细胞毒性实验表明 AMP-scolopin 2在实验剂量范围内对鼠红细胞没有溶血性,且对正常细胞(HEK293)的毒性也很小。AMP-scolopin 2拥有的抗肿瘤活性作用、溶血性小、对正常细胞毒副作用低等特点,使其有望成为新型的抗肿瘤药物,值得进一步深入研究。
4 结论成功构建了pSUMO-scolopin 2原核表达载体,并获得具有抗菌抗肿瘤活性的重组AMP-scolopin 2,而且证明AMP-scolopin 2 可通过调节线粒体通路相关蛋白的表达来促进肿瘤细胞(K562和HepG2)的凋亡。
| [1] | Galluzzi L, Senovilla L, Vitale I, et al. Molecular mechanisms of cisplatin resistance. Oncogene , 2012, 31 (15) : 1869–1883. DOI:10.1038/onc.2011.384 |
| [2] | 常晨晨, 王燕, 管珊, 等. 重组骆驼蓬脂转移蛋白与顺铂联合抑制黑色素瘤B16细胞增殖效应的研究. 生物技术通报 , 2015, 31 (12) : 186–192. |
| [3] | Zasloff M. Antimicrobial peptides of multicellular organisms. Nature , 2002, 415 (6870) : 389–395. DOI:10.1038/415389a |
| [4] | Papo N, Shai Y. Host defense peptides as new weapons in cancer treatment. Cellular & Molecular Life Sciences Cmls , 2005, 62 (7-8) : 784–790. |
| [5] | Ren SX, Cheng ASL, To KF, et al. Host immune defense peptide LL-37 activates caspase-independent apoptosis and suppresses colon cancer. Cancer Research , 2012, 72 (24) : 6512–6523. DOI:10.1158/0008-5472.CAN-12-2359 |
| [6] | Pemberton RW. Insects and other arthropods used as drugs in Korean traditional medicine. Journal of Ethnopharmacology , 1999, 65 (3) : 207–216. DOI:10.1016/S0378-8741(98)00209-8 |
| [7] | Ch oi, H Hwang JS, Lee DG. Identification of a novel antimicrobial peptide, scolopendin 1, derived from centipede Scolopendra subspinipes mutilans and its antifungal mechanism. Insect Molecular Biology , 2014, 23 (6) : 788–799. DOI:10.1111/imb.2014.23.issue-6 |
| [8] | Lee H, Hwang JS, Lee J, et al. Scolopendin 2, a cationic antimicrob-ial peptide from centipede, and its membrane-active mechanism. Biochimica et Biophysica Acta(BBA)- Biomembranes , 2015, 1848 (2) : 634–642. DOI:10.1016/j.bbamem.2014.11.016 |
| [9] | Peng K, Kong Y, Zhai L, et al. Two novel antimicrobial peptides from centipede venoms. Toxicon , 2010, 55 (2-3) : 274–279. DOI:10.1016/j.toxicon.2009.07.040 |
| [10] | Makkapati S, Robin C. Production of recombinant peptides as fusions with SUMO. Protein Expression & Purification , 2011, 78 (2) : 113–119. |
| [11] | Butt TR, Edavettal SC, Hall JP, et al. SUMO fusion technology for difficult-to-express proteins. Protein Expression & Purification , 2005, 43 (1) : 1–9. |
| [12] | Zhou L, Lin Q, Li B, et al. Expression and purification of the antimicrobial peptide CM4 in Escherichia coli. Biotechnology Letters , 2009, 31 (3) : 1113–1114. |
| [13] | Li JF, Zhang J, Song R, et al. Production of a cytotoxic cationic antibacterial peptide in Escherichia coli using SUMO fusion partner. Applied Microbiology & Biotechnology , 2009, 84 (2) : 383–388. |
| [14] | Rates B, Bemquerer MP, Richardson M, et al. Venomic analyses of Scolopendra viridicornis nigra and Scolopendra angulata(Centipede, Scolopendromorpha): Shedding light on venoms from a neglected group. Toxicon , 2007, 49 (6) : 810–826. DOI:10.1016/j.toxicon.2006.12.001 |
| [15] | Xun Z, Li S, Hall J, et al. Enhanced expression and purification of membrane proteins by SUMO fusion in Escherichia coli. Journal of Structural & Functional Genomics , 2005, 6 (2-3) : 103–111. |
| [16] | 李静岩. Caspase-3与肿瘤关系的研究. 医学综述 , 2005, 11 (5) : 430–432. |
| [17] | Olsson M, Zhivotovsky B. Caspases and cancer. Cell Death & Differentiation , 2011, 18 (18) : 1441–1449. |




