2. 河北大学药学院,保定 071002
2. College of Pharmaceutical Sciences of Hebei University,Baoding 071002
Fc受体(FcR)广泛表达于免疫活性细胞,介导免疫细胞与抗原 - 抗体复合物及其他细胞间的相互作用,触发广泛的免疫效应[1]。FcγRIIb(Fc gamma receptor IIb,FcγRIIb,即 CD32B)是目前发现的唯一 Fcγ抑制性受体,在免疫、肿瘤、感染性疾病、自体免疫性疾病等方面发挥的负性调节作用,受到越来越多学者的关注[2]。FcγRIIb广泛分布于B细胞、单核细胞、嗜碱性粒细胞、肥大细胞和嗜中性粒细胞,及除CD8记忆性T细胞外的其他T细胞和NK细胞以外的所有白细胞[3, 4]。FcγRIIb 可主要依赖其胞内区的 ITIM 抑制基序介导对多种免疫细胞的负向调节效应,如抑制依赖于钙动员的脱颗粒作用、吞噬作用、抗体依赖的细胞毒作用(ADCC)以及各种介质的释放等[5, 6]。FcγRIIb功能失衡常与多种疾病密切相关,这使人们认识到FcγRIIb可以作为一个潜在的治疗靶标。目前,人们设计了FcγRIIb单克隆抗体阻断FcγRIIb,从而增强对癌症或感染性病原的免疫反应,或者设计融合蛋白或双特异性抗体将FcγRIIb与激活型受体交联发挥其在自身免疫性疾病中的抑制作用等[7, 8]。
由于FcγRIIb的膜外区部分为与IgG直接作用位点,为了便于评价及进行动物实验,本实验首次克隆大鼠FcγRIIb基因膜外区,即FcγRIIb,并在原核表达系统中进行表达,制备高纯度的具备生物学活性的重组蛋白,旨为进一步探索FcγRIIb功能奠定实验基础。
1 材料与方法 1.1 材料DNA胶回收试剂盒、质粒提取试剂盒、pUCm-T载体、大鼠IgG、HRP标记的羊抗大鼠单克隆抗体、多克隆兔抗大鼠sFcγIIb抗体、HRP标记的羊抗兔单克隆抗体,Ni-NTA购自上海生工生物有限公司;DNA marker DM2000、DM10000,Taq酶、dNTPs、超纯RNA提取试剂盒、SuperRT第一链合成试剂盒购自北京康为世纪生物科技有限公司;T4 DNA连接酶、限制性核酸内切酶Pst I、Nde I、EcoR I、蛋白Marker等购自大连宝生物工程有限公司;X-gal、TEMED购自SIGAMA;Tryptone、Yeast Extract购自OXOID;其他常用试剂为国产分析纯试剂。
大鼠嗜碱性白血病细胞系RBL-2H3细胞购自上海中国科学院细胞库。菌株:DH5α和大肠杆菌BL21(DE3)均由本实验室保存;原核表达载体:pET-17b由本实验室保存。
1.2 方法 1.2.1 引物的设计参照GenBank 中FcγIIb基因序列(登录号:BC091113.1),采用Primer 5.0软件设计特异性引物,下划线序列分别为EcoR I酶、Pst I、Nde I酶切位点,斜体序列为6×His。FcγIIb及sFcγIIB基因的PCR扩增引物及产物测序均由上海生工生物有限公司合成。
RT-PCR方法克隆FcγIIb基因,取生长良好的RBL-2H3细胞,提取总RNA,总RNA提取和反转录参照超纯RNA提取试剂盒和SuperRT第一链合成试剂盒说明书进行。以p1和p2作为上下游引物,扩增FcγIIb全基因,纯化后的PCR产物与pUCm-T载体连接。以p3和p4作为上下游引物,亚克隆sFcγIIb基因片段。sFcγIIb基因片段与pET-17b质粒,分别经Nde I和EcoR I双酶切,连接产物转化大肠杆菌感受态细胞,经PCR、双酶切鉴定后进行测序验证。
1.2.3 sFcγIIb蛋白的表达、纯化及复性取测序准确的pET-17b-sFcγIIb/BL21(DE3)克隆接种于含Amp的LB液体培养基中,3 7 ℃ 振荡过夜。取上述菌液按照1 : 100的比例接种于1 L含Amp的LB液体培养基中,37 ℃ 振荡培养至OD600约为0.6,加入IPTG至终浓度为1.0 mmol/L,诱导蛋白表达,继续培养4 h,收集菌体。超声波破碎菌体,分别收集沉淀和上清,采用12% SDS-PAGE电泳检测蛋白表达情况,同时以pET-17b空质粒作对照。对IPTG浓度及诱导时间进行优化,摸索sFcγRIIb蛋白表达体系。
收集蛋白表达包涵体于8 mol/L尿素缓冲液中,4 ℃ 过夜搅拌溶解,上清过0.45 μm滤膜。向Ni-NTA柱中加入2倍体积的Ni-NTA柱平衡缓冲液,加入溶解有包涵体的8 mol/L尿素缓冲液,20 mmol/L咪唑柱平衡缓冲液洗脱杂蛋白,250 mmol/L咪唑柱平衡缓冲液洗脱目的蛋白。将纯化后的包涵体转移至透析袋中,进行透析复性,12% SDS-PAGE电泳检测结果。
1.2.4 Western blotting鉴定取复性前与复性后的sFcγIIb蛋白,与同体积2×SD S-蛋 白上样缓冲液混匀后进行SDS-PAGE电泳,煮沸5 min,待冷却后每种sFcγIIb蛋白分别采取5 μL、10 μL两个不同的量,进行SDS-PAGE电泳。以pET-17b/BL21(DE3)诱导后菌体的裂解产物作为阴性对照。加入一抗(1 : 200稀释的抗FcγRIIb兔多克隆抗体)和二抗(1 : 1 000稀释的HRP标记的羊抗兔IgG抗体)对表达蛋白进行鉴定
1.2.5 ELISA鉴定sFcγRIIb蛋白活性 1.2.5.1 直接法检测IgG与sFcγRIIb蛋白的体外结合将sFcγRIIb蛋白以碳酸盐缓冲液稀释至10 μg/mL,包被酶标板,4 ℃ 过夜。以10 μg/mL的BSA作为阴性对照。PBST清洗5次,加入含5%脱脂奶粉的PBS,37 ℃ 孵育2 h。PBST清洗5次,加入不同浓度的大鼠IgG( 0-5 0 μg/mL),各设立3个平行孔,37 ℃ 孵育2 h。PBS T清洗5次,加入HRP标记的羊抗大鼠多克隆抗体(1 : 8 000),37 ℃ 孵育2 h。PBST清洗5次,加入100 μL TMB底物缓冲液,室温反应20 min。加入50 μL终止液,测定OD450值。
1.2.5.2 竞争法检测大鼠IgG与sFcγRIIb蛋白的体外结合方法见1.2.5.1,在第3个步骤中,加入50 μg/mL 大鼠IgG与不同浓度的( 0-5 0 μg/mL)sFcγRIIb的混合物,其余步骤相同。
1.2.5.3 间接法检测大鼠IgG与sFcγRIIb蛋白的体外结合将大鼠IgG以碳酸盐缓冲液稀释至10 μg/mL,包被酶标板,4 ℃ 过夜。以10 μg/mL的BSA作为阴性对照。加入含5%脱脂奶粉的PBS,37 ℃ 孵育2 h。分别加入不同浓度的sFcγRIIb( 0-5 0 μg/mL),设立3个平行孔,37 ℃ 孵育2 h。加入多克隆兔抗大鼠sFcγIIB抗体(1 : 4 000),37 ℃ 孵育2 h。加入HRP标记的羊抗兔单克隆抗体(1 : 8 000),37 ℃ 孵育2 h。加入100 μL TMB底物缓冲液,室温反应20 min。加入50 μL终止液,测定A450值。期间每加入不同溶液后,均用PBST清洗5次。
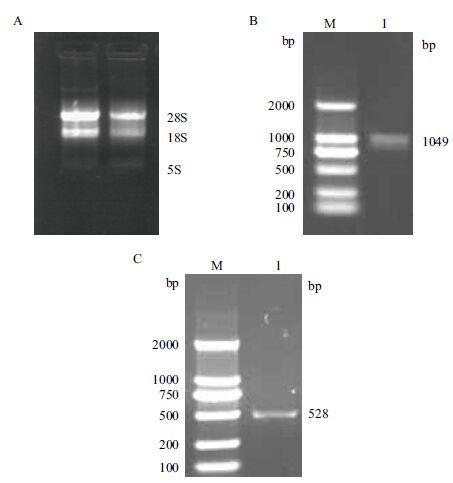
2 结果 2.1 重组质粒的构建RNA提取结果显示,可见28S、18S和5S 3个RNA条带,且28S rRNA条带亮度约为18S rRNA条带亮度的2倍,OD260/OD280的值为2.08,满足实验要求(图 1-A)。RT-PCR扩增FcγIIb全长基因(图 1-B)及sFcγRIIb基因(图 1-C)后经1%琼脂糖凝胶电泳,PCR产物长度为1 049 bp和528 bp,与预期大小一致。
|
| 图 1 RT-PCR法克隆FcγIIb基因 |
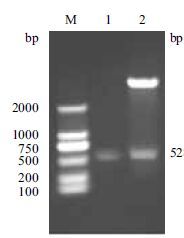
重组质粒pET-17b-sFcγIIb,经EcoR I和Nde I双酶切后产生了约为528 bp的酶切片段,与PCR扩增所得的FcγIIb基因片段大小相符(图 2)。构建的载体经测序分析,确认插入片段及引物、限制性酶切位点准确无误,与GenBank中大鼠FcγRIIb基因胞外区序列相一致。
|
| 图 2 重组质粒FcγRIIb-pET17b的双酶切鉴定 M:DNA 标记DM2000; 1:sFcγRIIb 基因;2: Pst I/Nde I双酶切FcγRIIb-pET17b产物 |
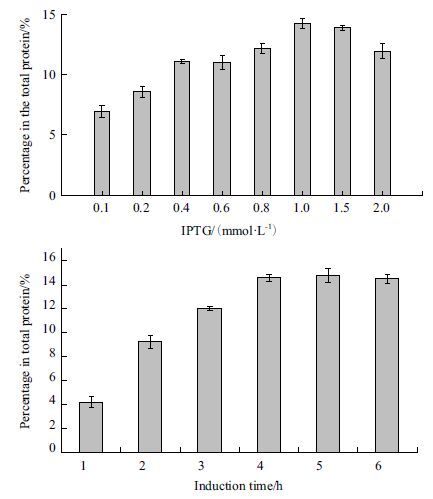
IPTG是诱导重组蛋白表达的关键因素之一,通过对不同IPTG浓度进行优化,结果(图3)显示,随着IPTG浓度增加至1.0 mmol/L时,sFcγRIIb蛋白表达量最高,可达总蛋白的14.45%,IPTG浓度大于1.0 mmol/L时,蛋白表达呈下降趋势,这可能与IPTG对BL21(DE3)菌的毒害作用有关。不同诱导时间对sFcγRIIb蛋白表达影响显著,如图 4所示,蛋白表达量与诱导时间呈正相关,4 h时蛋白的表达量最高(14.39%),与5 h、6 h蛋白表达结果无显著性差异。
|
| 图 4 不同IPTG浓度及诱导时间对sFcγRIIb蛋白表达的影响 |
本实验表达sFcγRIIb蛋白以包涵体形式存在,包涵体洗涤进行初步纯化后,将包涵体溶于高浓度变性剂中,镍柱进一步纯化后的蛋白,经多次透析复性,获得了纯度较高的目的蛋白,可以用于后续的实验(图 5)。各纯化和复性步骤中蛋白回收得率与纯度,见表 2。

|
| 图 5 sFcγRIIb蛋白表达与纯化 M:蛋白分子量标记;1: pET17b/BL21(DE3) 诱导 4 h;2-4:pET17b-sFcγRIIbRIIb/BL21(DE3)诱导4 h后沉淀与上清;5:Trixon-100 洗后的包涵体;6:2 mol/L urea洗后的包涵体;7:8 mol/L urea 洗后的包涵体;8:Ni-NTA 纯化后蛋白;9:复性后蛋白 |
取复性前、后sFcγRIIb蛋白,进行Western blotting检测(图 6),同时以pET-17b/BL21(DE3)诱导后裂解产物作为阴性对照,结果显示复性前、后sFcγRIIb蛋白均与特异性抗体反应,出现明显阳性条带。

|
| 图 6 重组蛋白的Western blotting分析 1:5 μL变性sFcγRIIb蛋白;2:10 μL变性sFcγRIIb蛋白;3:5 μL复性sFcγRIIb蛋白;4:10 μL复性sFcγRIIb蛋白;5:阴性对照 |
包被sFcγRIIb蛋白后,大鼠IgG与sFcγRIIb蛋白之间的结合情况如图 7所示,在一定范围内随着IgG浓度的增加,两者结合量也相应增加。

|
| 图 7 直接法ELISA检测IgG与sFcγRIIb蛋白的体外结合 |
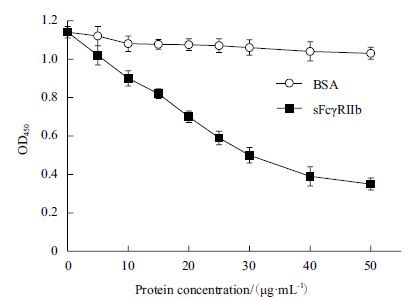
包被sFcγRIIb蛋白后,将不同浓度的sFcγRIIb与大鼠IgG混合后再加入到酶标板中,分析两者的结合。结果(图 8)表明,游离的sFcγRIIb抑制了大鼠IgG与包被于酶标板上的sFcγRIIb蛋白的结合,随着游离sFcγRIIb的浓度增加,结合的大鼠IgG浓度呈下降趋势。
|
| 图 8 竞争法ELISA检测sFcγRIIb与IgG的结合 |
包被大鼠IgG后,通过加入不同量的sFcγRIIb蛋白,观测二者结合情况。结果(图 9)显示,在一定浓度范围内,随着sFcγRIIb浓度增加,两者间结合量也相应增加。
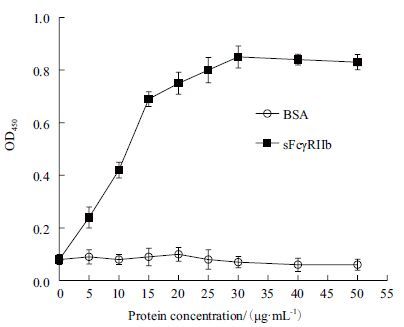
|
| 图 9 间接法ELISA检测sFcγRIIb与IgG的结合 |
FcγRIIb作为唯一的抑制型FcRs,通过与其他激活型受体如FcγRI、FcγRIII、FcγRIV、FcεRI及B细胞受体(BCR)等交联而发挥抑制作用。在肥大细胞和嗜碱性粒细胞中,FcγRIIb1或FcγRIIb2与激活型受体的成簇可以抑制脱颗粒反应。B细胞表面的FcγRIIb1参与对抗体产生和B细胞增殖的负性调节作用,通过特异性IgG的Fab段与B细胞受体结合而Fc段与FcγRIIb1结合,从而转导抑制性信号[9, 10]。
FcγRIIb抑制性功能的发挥依赖于其胞内区的ITIM基序。在FcγRIIb中,ITIM基序包含13个氨基酸残基,含有数种抑制性受体的共有序列V/IxYxxL[11]。FcγR基因位于染色体1的长臂(1q2 1-2 3),位于这一基因簇的数个FcγR的基因非常相似,不同物种间具有明显差异[12]。人与鼠FcγR包括FcγRI、FcγII、RFcγRIII和FcγRIV。人的FcγRII基因簇全长为15 kb,包含FcγRIIa、FcγRIIb和FcγRIIc三个基因。小鼠有FcγRIIb基因,但是没有FcγRIIa和FcγRIIc基因。人与鼠的 FcγRIIb基因高度同源,区别仅在第一个编码胞内区的内含子大小不同。FcγRIIb是一个单链受体,属于免疫球蛋白超家族成员,由具有与IgG结合位点的胞外区、跨膜区和具有ITIM基序的膜内区组成。FcγRIIb受体胞外区是与配体直接作为位点,为了研究FcγRIIb生物学功能,人们已在原核系统中表达了人、猪、小鼠等不同物种的FcγRIIb,即sFcγRIIb(soluble FcγRIIb,可溶性FcγRIIb)在大肠杆菌中的表达、纯化及活性鉴定[13-15],但未见大鼠FcγRIIb膜外区原核表达的相关报道。大鼠体积大于小鼠,操作方便,且当前实验室所用大鼠品系纯、价格便宜,有关分子生物学试剂较多,对抗原反应较为一致,因此本实验对大鼠sFcγRIIb基因进行了克隆、表达。
为得到高效表达的sFcγRIIb 胞外区蛋白并便于纯化,本研究选用pET-17b融合表达载体,目的基因插入载体后,处于T7 强启动子调控之下,选择载体多克隆酶切位点的第一个内切酶Nde I,利用该酶酶切位点中的ATG作为起始密码子,去掉载体自身标签序列,避免将标签加在目的蛋白N端,而将His-tag添加于目的蛋白C端,以利于目的蛋白的高效表达,并便于其亲和纯化。
同表达于原核表达系统中的人[13-15]和猪的sFcγRIIb[16]一样,本实验通过筛选表达菌株,优化诱导温度及时间,尽管在一定程度上提高了FcγRIIb 胞外区蛋白的表达水平,但其表达产物依然以包涵体的形式存在,无法获得可溶性表达。不同于之前对重组蛋白sFcγRIIb采用稀释复性的方法,在本研究中,对包涵体的复性采用了透析复性的方法,这种方法的优点在于避免了复性后的蛋白浓度过低和体积过大,以及随后的浓缩过程,可以小规模地制备实验用的活性重组蛋白sFcγRIIb,且最终回收率与稀释复性相当。经分析,蛋白的理论等电点是8.59,所以选择pH值为7.4的PBS作为复性液,是复性液与蛋白的等电点距离1以上,有利于蛋白的溶解,提高复性后的蛋白回收率。初次抽提的包 涵体含有细菌外膜蛋白和核酸等杂质,利用2 mol/L尿素和1% Triton X-100对包涵体进行反复洗涤,去掉了细菌内大部分杂质及部分目的蛋白,减少了后步的纯化压力,有利于后续的包涵体复性。在复性过程中,我们发现,复性过程中沉淀的出现主要发生在复性液尿素浓度由4 mol/L变换至2 mol/L时,因此我们在含2 mol/L尿素的变性液中加入了0.5 mmol/L GSSG,5 mmol/L GSH和0.5 mol/L的精氨酸[13],并且采用较小的体积比(复性蛋白溶液 : 复性液=1 : 1)并多次换液的方法,有效地减少了沉淀的生成,提高了复性效率。经计算机软件分析,蛋白的疏水性较高,沉淀的产生可能与之有关。
本实验中采用3种不同ELISA实验鉴定重组蛋白的生物学活性,首先将sFcγRIIb或大鼠IgG包被于酶标板上,两种处理均表明两者之间的特异性结合的能力,而将sFcγRIIb与大鼠IgG混合后,同样能够抑制大鼠IgG与包被的sFcγRIIb的结合,3种处理均表明复性后的重组蛋白能够与特异性抗体或大鼠IgG结合,具有正常的生理活性。
4 结论本实验成功克隆大鼠sFcγRIIb基因,建立了sFcγRIIb蛋白原核表达体系,重组蛋白利用Ni-NTA柱亲和层析纯化。包涵体复性后,经Western blotting、ELISA与竞争性ELISA鉴定结果表明,成功制备了具有生物学功能的重组大鼠sFcγRIIb蛋白。
| [1] | Cohen-solal JF, Cassard L, Fridman WH, et al. Fc gamma receptors. Immunol Lett , 2004, 92 (3) : 199–205. DOI:10.1016/j.imlet.2004.01.012 |
| [2] | Roghanian A, Teige I, Mårtensson L, et al. Antagonistic human FcγRIIB(CD32B)antibodies have anti-tumor activity and overcome resistance to antibody therapy in vivo. Cancer Cell , 2015, 27 (4) : 473–488. DOI:10.1016/j.ccell.2015.03.005 |
| [3] | Hogarth PM, Pietersz GA. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov , 2012, 11 (4) : 311–331. DOI:10.1038/nrd2909 |
| [4] | Starbeck-Miller GR, Badovinac VP, Barber DL, et al. Cutting edge: Expression of FcγRIIB tempers memory CD8 T cell function in vivo. J Immunol , 2014, 192 (1) : 35–39. DOI:10.4049/jimmunol.1302232 |
| [5] | Stefanescu RN, Olferiev M, Liu Y, et al. Inhibitory Fc Gamma Receptors: From Gene to Disease. Clin Exp Immunol , 2004, 24 (4) : 315–326. DOI:10.1023/B:JOCI.0000029105.47772.04 |
| [6] | Brownlie RJ, Lawlor KE, Niederer HA, et al. Distinct cell-specific control of autoimmunity and infection by FcγRIIb. J Exp Med , 2008, 205 (4) : 883–895. DOI:10.1084/jem.20072565 |
| [7] | Williams EL, Tutt AL, Beers SA, et al. Immunotherapy targeting inhibitory Fcγ receptor IIB(CD32b)in the mouse is limited by monoclonal antibody consumption and receptor internalization. J Immunol , 2013, 191 : 4130–4140. DOI:10.4049/jimmunol.1301430 |
| [8] | Zhu D, Kepley CL, Zhang K, et al. A chimeric human-cat fusion protein blocks cat-induced allergy. Nat Med , 2005, 11 (4) : 446–449. |
| [9] | Malbec O, Attal JP, Fridman WH, et al. Negative regulation of mast cell proliferation by FcgammaRIIB. Mol Immunol , 2002, 8 (16-18) : 1295–1299. |
| [10] | Daeron M, Lesourne R. Negative signaling in Fc receptor complexes. Adv Immunol , 2006, 89 (89) : 39–86. |
| [11] | Muta T, Kurosaki T, Misulovin Z, et al. A 13-amino-acid motif in the cytoplasmic domain of Fc gamma RIIB modulates B-cell receptor signaling. Nature , 1994, 369 (6478) : 70–73. |
| [12] | Qiu WQ, de Bruin D, Brownstein BH, et al. Organization of the human and mouse low-affinity Fc gamma R genes: duplication and recombination. Science , 1990, 248 (4956) : 732–735. DOI:10.1126/science.2139735 |
| [13] | Kurucz I, Hilbert A, Kapus A, et al. Bacterially expressed human Fc gamma RIIb is soluble and functionally active after in vitro refolding. Immunol Lett , 2000, 75 (1) : 33–40. DOI:10.1016/S0165-2478(00)00281-9 |
| [14] | Buchner J, Rudolph R. Renaturation, purification and characteriz-ation of recombinant Fab-fragments produced in Escherichia coli. Biotechnology , 1991, 9 (2) : 157–162. DOI:10.1038/nbt0291-157 |
| [15] | 张雷, 曹秀琴, 杨志伟. 人FcγRIIb 胞外区原核表达载体的构建及表达. 宁夏医科大学学报 , 2011, 33 (3) : 219–223. |
| [16] | Tian X, Wang A, Qiao S, et al. Expression, purification and characterization of a functional extracellular domain of porcine FcgammaRII. Protein Expr Purif , 2009, 68 (1) : 12–17. DOI:10.1016/j.pep.2009.06.020 |






