2. 沈阳药科大学中韩分子生药学研究室,沈阳 110016
2. Laboratory of China-Korea Molecular Pharmacognosy,Shenyang Pharmaceutical University,Shenyang 110016
中华大蟾蜍(B. bufo gargarizans)为蟾蜍科蟾蜍属动物,全身皆可入药,如蟾酥、蟾皮、干蟾、蟾蜍头、蟾蜍舌、蟾蜍肝、蟾蜍胆等[1, 2]。因其具有重要的药用价值,如治疗恶性肿瘤、心衰、各种感染性疾病、慢性肝炎、骨髓炎、周围性面神经麻痹、止痛麻醉等而备受关注[3-5]。许多研究者正致力于研究有关的药理作用和活性成分,但对中华大蟾蜍重要生理功能的基因研究则报道较少。肌动蛋白(actin)广泛存在于真核生物中,是肌小节和细胞骨架的重要组成成分,在细胞分裂、染色体运动、细胞器运动、胞质流动等几乎所有真核细胞的生理过程中发挥重要作用[6-8]。高等动物细胞内的肌动蛋白根据等电点的不同分为α、β和γ三类,α分布于各种肌细胞中,β和γ常分布于肌细胞和非肌细胞中[9, 10]。各类肌动蛋白氨基酸序列都非常保守,其同源性高达70%以上[11, 12]。肌动蛋白除有基因序列高度保守的特征外,还具有mRNA的表达数量高,而且数量稳定,几乎不随时间变化的特点,在研究mRNA表达量时,常采用β-肌动蛋白mRNA作为内标[13-15]。目前关于蟾蜍属 动物肌动蛋白序列尚未见报道,为了更好的研究该基因的功能和进化特点,本研究对采用RNA-Seq方法获得的中华大蟾蜍肌动蛋白基因cDNA序列进行生物信息学分析,并对其翻译的蛋白质三维结构进行预测,同时构建系统进化树,为进一步揭示两栖动物功能蛋白基因提供科学资料。
1 材料与方法 1.1 材料 1.1.1 实验材料成体中华大蟾蜍由沈阳药科大学实验动物中心提供,经沈阳药科大学中药学院王东副教授鉴定为中华大蟾蜍(B. bufo gargarizans)。
1.1.2 试剂RNAiso Plus和Recombinant DNaseⅠ(RNase-free)购自大连宝生物公司,RNA inhib itor购自上海生工生物有限公司,TruSeq RNA Sample Prep Kit购自美国Illumina公司。无水乙醇、氯仿、异丙醇购自国药集团化学试剂有限公司,琼脂 糖购自Biowest公司,氢氧化钠购自天津博迪化工股份 有限公司。
1.1.3 仪器SW-CJ-1D超净台(苏州净化设备有限公司),Life Pro PCR仪(杭州博日科技有限公司),Mupid-2Plus电泳仪(日本TaKaRa公司),CT-14RD台式高速冷冻离心机(上海天美生化仪器设备工程有限公司),UPW-50S超纯水机(北京历元电子仪器公司),RAININ移液器(美国梅特勒-托利多公司),Nano Drop 2000分光光度计(赛默飞世尔科技公司),Illumina HiSeqTM 2000测序平台(美国 Illumina公司)。
1.2 方法 1.2.1 总RNA的提取称取新鲜耳后腺组织约30 mg,置于装有液氮的研钵中迅速研磨、粉碎,按操作说明采用RNAiso Plus提取总RNA。使用Recombinant DNaseⅠ进行DNA消化,以紫外分光光度计和1%的琼脂糖凝胶电泳检测RNA的浓度和纯度。提取的耳后腺总RNA于-80 ℃ 保存。
1.2.2 BbgActin基因cDNA全长序列的获得参照美国 Illumina 公 司TruSeq®RNA Sample Preparation v2 Guide操作制备测序文库,委托北京迈基诺基因科技有限责任公司于Illumina HiSeqTM 2000测序平台进行测序。采用NCBI BLAST程序对所得转录组进行blastn同源搜索(http://blast.ncbi.nlm.nih.gov/Blast.cgi),获得中华大蟾蜍肌动蛋白全长cDNA序列BbgActin。
1.2.3 RT-PCR扩增目的基因以1.2.2中获得的中华大蟾蜍肌动蛋白全长cDNA序列的为模板,分别于ORF前后约20 bp处设计特异性引物:Primer AF:5′-GACTTGACAACACAACCTAT-3′,Primer AR:5′-TTCGTTTGGAAGTTGGCTCT-3′,引物由南京金斯瑞公司合成。以提得的总RNA为模板,按 TaKaRa逆转录试剂盒操作说明合成第一链cDNA。反应体系:RNase Free dH2O 4 μL,Oligo(dT)1 2-1 8 Primer(50 μmol/L)1 μL,模板RNA 1 μL混合均匀,70 ℃ 保温10 min后迅速转移至冰浴中冷却2 min,离心数秒使模板RNA/引物的变性溶液聚集于Microtube管底部。在上述Microtube管中加入下列反转录相关试剂:5×M-MLV Buffer 2 μL,dNTP Mixture(各10 mmol/L)0.5 μL,RNase Inhibitor(40 U/μL)0.25 μL,RTase M-MLV(RNase H-)(200 U/μL)0.5 μL,RNase Free dH2O 0.75 μL轻轻混匀,42 ℃ 保温1 h,70 ℃ 保温15 min后冰上冷却。以第一链cDNA为模板,合成双链cDNA,反应体系:Premix TaqTM 5 μL,第一链cDNA模板4 μL,Primer AF 2 μL,Primer AR 2 μL,RNase Free dH2O 17 μL。PCR反应条件如下:95 ℃ 1 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 1 min;4 ℃ 保温。取5 μL PCR反应产物经1%琼脂糖电泳鉴定与预期片段大小一致后,将剩余产物送至北京博迈德公司测序进行DNA序列鉴定。
1.2.4 BbgActin基因生物信息学分析利用ORF Finder程序预测BbgActin cDNA开放阅读框;利用NCBI BLAST P程序进行蛋白同源比对和保守结构域预测;用ProtParam软件(http://web.expasy.org/cgi-bin/protparam/protparam)计算蛋白质的相对分子量,理论等电点和稳定性;通过ExPASy-Protscale(http://web.expasy.org/protscale/)预测其亲疏水性;采 用ExPASy PROSITE(http://www.expasy.ch/prosite/)对蛋白结构域进行检索;利用Motif Scan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)对蛋白序列中蛋白修饰位点进行预测;采用SWISS-MODEL(http://swissmodel.expasy.org/)进行二级结构分析并进行BbgActin的同源建模预测。在GenBank(http://www.ncbi.nlm.nih.gov/)中检索得到18种动物的肌动蛋白氨基酸序列,用MEGA6.0软件将所得的18条Actin氨基酸序列与BbgActin序列进行比对,通过UPGMA法构建系统进化树,其中重复抽样次数选择1 000以确保所构建进化树分支的稳定性。
2 结果 2.1 中华大蟾蜍耳后腺总RNA的提取将中华大蟾蜍耳后腺总RNA在1%琼脂糖凝胶上电泳检测,电泳结果表明28S、18S和5S rRNA均清晰可见,说明 RNA的完整性较好。使用紫外分光光度法对所提取的RNA进行检测,A260/A280为1.92,RNA纯度较高,所得RNA的浓度为0.42 μg/μL,可用于后续实验。
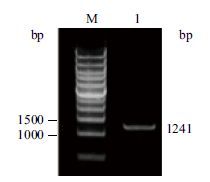
2.2 BbgActin基因cDNA序列的获得对Illumina高通量测序所得有效Reads采用Velvet软件进行拼接,共获得32 840条长度大于200 bp的contigs 。经blastn同源比对,获得BbgAc-tin cDNA序列,共2 055 bp,经RT-PCR(图 1)及测序鉴定无误后并在GenBank上登录,登录号为:KT334220。ORF finder结果显示,BbgActin的ORF长为1 131 bp,编码376个氨基酸。BbgActin的cDNA序列及编码蛋白序列如图 2所示。通过ExP-ASy PROSITE对BbgActin蛋白结构域分析显示,BbgActin编码的蛋白在5 4-6 4、10 5-1 17、35 7-3 65位点具有肌动蛋白家族特征序列,分别为:YVGD-EAQSKRG、LLTEAPLNPKANR、WISKQEYDE。利用BLAST P程序将BbgActin蛋白序列于GenBank蛋白数据库中进行同源比对,发现BbgActin与各个物种Actin同源性都很高,相似度都能达到90 %以上。表明所得BbgActin为actin家族成员,且actin家族在进化过程中是高度保守的。
|
| 图 1 1%的琼脂糖凝胶检测图谱 M:DNA Marker;1:PCR产物 |

|
| 图 2 BbgActin cDNA序列及推导的氨基酸序列 方框为起始密码子ATG 和终止密码子TAA;下划线部分为肌动蛋白家族特征序列 |
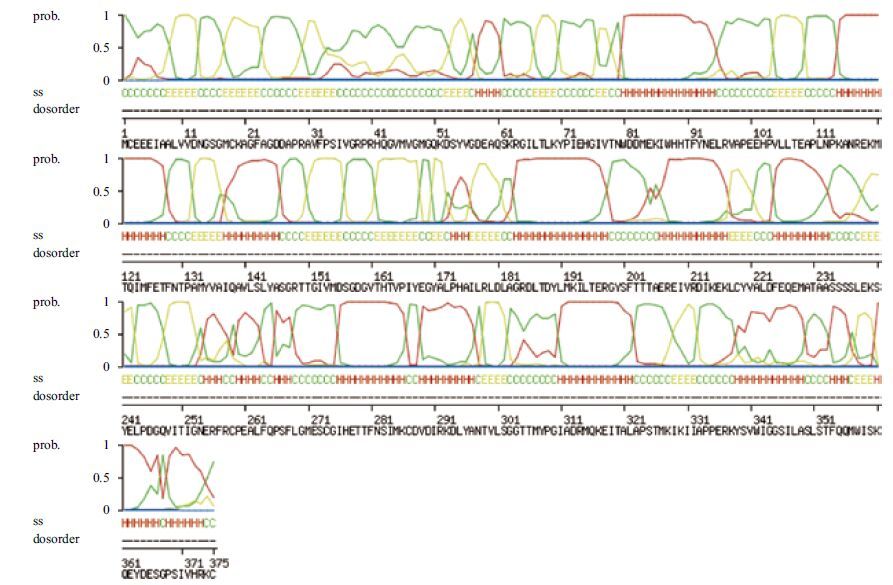
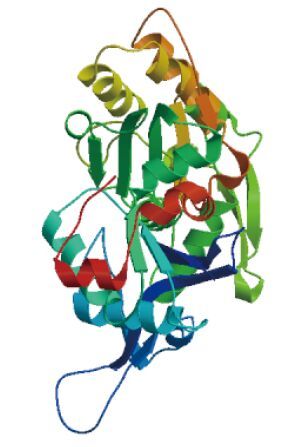
ProtParam软件推测BbgActin蛋白质分子量为41.9 kD,理论等电点为5.31,分子式为C1856H2914N492O562S24,带负电残基总数(Asp+Glu)为49,带正电残基总数(Arg+Lys)为37;不稳 定系数为37.47,属于稳定蛋白;脂肪系数为81.73,亲水系数为-0.193。ExPASy-Ptotscale预测结果表明,BbgActin氨基酸序列第139位的A分值最高为2.20,疏水性最强;第364位的D分值最低为-2.44,亲水性最强;其中,亲水性氨基酸明显多于疏水性氨基酸,表明BbgActin为亲水性蛋白。MotifScan分析显示,BbgActin蛋白序列具有多个蛋白修饰位点:1个 N-糖 基化位点(1 3-1 6位:NGSG),一个cAM P-环 磷酸腺苷和cGM P-环 磷酸鸟苷蛋白激酶磷酸化位点(33 6-3 39位:RKYS),4个酪蛋白激酶Ⅱ磷酸化位点(7 8-8 1位:TNWD,20 3-2 06位:TTAE,23 5-2 38位:SSLE,35 9-3 62位:SKQE),8个酰基化位点(1 4-1 9:GSGMCK,4 3-4 8:GVMVGM,4 9-5 4:GQKDSY7,5- 8 0:GIVTNW,15 9-1 64:GVTHTV,24 6-2 51:GQVITI,26 9-2 74:GMESCG,34 4-3 49:GSILAS),5个蛋白激酶C磷酸化位点(6 1-6 3:SKR,6 7-6 9:TLK,14 6-1 48:SGR,19 5-1 97:TER,32 5-3 27:TMK),2个酪氨酸激酶磷酸化位点(19 2-1 99:KILTERGY,21 1-2 19:RDIKEKLCY)。这些结构修饰位点与植物中茶树(Camellia sinensis)肌动蛋白基因结构修饰位点[16]是一致的。表明BbgActin可能在蛋白水平上存在复杂的调控和修饰作用并在进化过程中是高度保守的。使用SWISS-MODEL对BbgActin进行二级结构分析,结果(图 3)显示其中α螺旋占28.5%,β折叠占8.2%,其他无规则卷曲占63.3%。家兔(Oryctolagus cuniculus)肌动蛋白(α-Actin,PDB:1IJJ_A)晶体结构已经用X射线衍射法测定,同时该蛋白与BbgActin相似度高达93.88%,因此以其作为参考蛋白建 模预测BbgActin三维结构(图 4)。
|
| 图 3 通过SWISS-MODEL对BbgActin二级结构的在线预测 Red H:α-螺旋;Yellow E:β-折叠;Green C:无规则卷曲 |
|
| 图 4 BbgActin的三维结构同源建模 建模信息:建模氨基酸范围:5 - 375;参考模版:1IJJ [2.85Å];序列相似性[%]:93.88;QMEAN:-5.24;GMQE:0.98 |
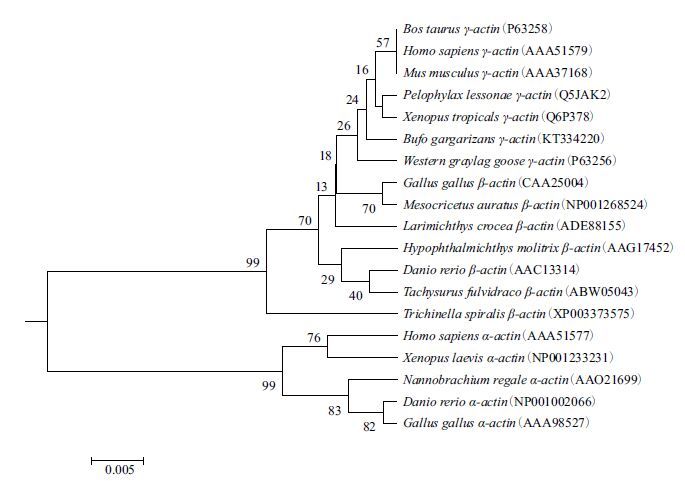
将BbgActin与从GenBank中下载18条Actin进行同源比较(图 5)并共同构建系统进化树(图 6)。同源比较分析不同动物的肌动蛋白氨基酸序列仅在少数位置有差异,说明动物的肌动蛋白基因无论是其核苷酸序列还是编码的氨基酸序列都具有高度的保守性和同源性;系统进化分析表明,α-Actin单独为一分支,且β-Actin与γ-Actin进化距离较近,BbgActin 与γ-Actin聚为一类,因此推测所得BbgActin为γ-肌动蛋白。

|
| 图 5 BbgActin与其他物种Actin氨基酸序列同源性比对 Bs γActin:Bos taurus(P63258);Dr αActin:Danio rerio(NP001002066);Dr βActin:Danio rerio(AAC3314);Gg αActin:Gallus gallus(AAA98527);Gg βActin:Gallus gallus(CAA25004);Hs γActin:Homo sapiens(AAA37168);Hs αActin:Homo sapiens(AAA51577);Hm βActin:Hypophthalmichthys moltrix(AAG17452);Lc βActin:Larimichthys crocea(ADE88155);Ma βActin:Mesocricetus allratus(NP001268524);Mm γActin:Mus musculus(AAA37168);Nr αActin:Nannobrachium regale(AAO21699);Pl γActin:Pelophylax lessonae(Q5JAK2);Tf βActin:Tachysurus fulvidraco(ABW05043);Wgg γActin:Western graylag goose(P63256);Xt γActin:Xenopus tropicals(Q6P378);Xl αActin:Xenopis laevis(NP001002066);Ts βActin:Trichinella spiralis(XP003373575);方框内为Actin家族特征序列;阴影表示差异氨基酸序列 |
|
| 图 6 不同物种的肌动蛋白序列通过MEGA 6.0软件构建的UPGMA树 |
动物肌动蛋白具有高度保守性,一般由37 5-3 77个氨基酸残基组成[17, 18],本研究克隆的中华大蟾蜍耳后腺肌动蛋白基因全长2 055 bp,ORF为1 131 bp,编码376个氨基酸,具有肌动蛋白家族特有的特征信号序列:YVGDEAQSKRG、LLTEAPLN-PKANR、WISKQEYDE。利用BLAST P程序将Bbg-Actin核苷酸和蛋白序列于GenBank数据库中进行同源比对核苷酸序列相似性高于89%,所编码蛋白的氨基酸序列相似性高于90%,与18种动物肌动蛋白的多序列分析结果表明,不同动物的肌动蛋白氨基酸序列仅在少数位置有差异,说明动物的肌动蛋白基因无论是其核苷酸序列还是编码的氨基酸序列都具有高度的保守性和同源性。肌动蛋白的高度保守性是与其参与构成细胞骨架的重要功能紧密相关的,由于生理功能的重要性,肌动蛋白在自然选择过程中承受着巨大的选择压力,因而核苷酸序列和氨基酸序列都表现出高度保守。
肌动蛋白基因至少表达成5种异构形式,被分为肌肉型(α-骨骼肌、心肌和平滑肌)和胞质型(β-和γ-)两种类型,胞质型广泛表达于不同组织中,是构成细胞骨架的重要成分,而肌肉型则特异地表达于不同类型的肌肉中,主要构成了细胞形态变化、细胞器运动的主要动力[19-21]。这些不同类型的肌动蛋白分别在不同的肌动蛋白结合蛋白作用下,参与不同的生理活动和生命过程。本研究得到的BbgActin为γ-肌动蛋白,推测Bbgγ-Actin是蟾蜍耳后腺细胞骨架的重要组成成分,对细胞形态和细胞器定位具有重要作用。Bbgγ-Actin基因序列的获得为进一步研究该基因在中华大蟾蜍生命活动中的作用奠定了 基础,也为蟾蜍类动物基因表达水平研究提供了重要的工具。
4 结论中华大蟾蜍中γ肌动蛋白(Bbgγ-Actin)全长cDNA长2 055 bp,编码376个氨基酸,其基因序列和蛋白序列均具有高度保守性。Bbgγ-Actin可能为蟾蜍耳后腺细胞骨架的重要组成部分。
| [1] | 吴喜燕, 高慧敏, 王智民. 蟾蜍类药材化学成分研究进展. 中国实验方剂学杂志 , 2010, 16 (14) : 207–214. |
| [2] | 江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 1986 : 2713. |
| [3] | 张慧卿, 殷子斐, 盛佳钰, 苏永华. 蟾酥的临床应用与研究现状. 临床军医杂志 , 2012, 40 (2) : 477–480. |
| [4] | 赵强, 梦凡静, 刘安西. 蟾酥的研究进展. 中草药 , 2004, 35 (10) : 4–7. |
| [5] | 国家药典委员会. 中华人民共和国药典(2010版)一部[M]. 北京: 中国医药科技出版社, 2010 : 265. |
| [6] | 薛茂云, 胡承俊, 张营, 等. 松江鲈β-肌动蛋白基因全长cDNA的克隆和序列分析. 安徽农业科学 , 2010, 38 (32) : 18229–18232. |
| [7] | Pollard TD, Cooper JA. Actin and actin-binding proteins. a critical evaluation of mechanisms and functions. Annu Rev Biochem , 1986, 55 : 987–1035. DOI:10.1146/annurev.bi.55.070186.005011 |
| [8] | Kabsch W, Vandekerekhove J. Structure and function of actin. Annu Rev Biophys Biomol Struct , 1992, 21 : 49–76. DOI:10.1146/annurev.bb.21.060192.000405 |
| [9] | Vandekerekhove J, Weber K. Mammalian cytoplasmic actins are the products of at least two genes and differ in primary structure in at least 25 identified positions from skeletal muscle actins. Proceedings of the National Academy of Sciences of the United States of America , 1978, 75 (3) : 1106–1110. DOI:10.1073/pnas.75.3.1106 |
| [10] | 黄静茹, 黄辉洋, 叶海辉, 等. 拟穴青蟹β-肌动蛋白基因的克隆与分析. 厦门大学学报: 自然科学版 , 2012, 51 (2) : 274–279. |
| [11] | 宋伟, 王晓琳, 严维辉, 等. 黄颡鱼β-肌动蛋白基因的克隆及表达分析. 江苏农业学报 , 2008, 24 (32) : 263–268. |
| [12] | Hu S, Yan L. Aetin and eukaryotic evolution. Aeta Zoolngica Sinica , 1999, 45 : 440–447. |
| [13] | 张殿昌, 江世贵, 邵艳卿, 等. 鲮β-肌动蛋白基因的分子克隆及作为分子内标的可靠性分析. 中国水产科学 , 2006, 13 (5) : 708–713. |
| [14] | Hua Z, Jonathan WS. Direct comparison of GAPDH, β-Actin, cyclophilin, and 28S rRNA as internal standards for quantifying RNA LEvels under hypoxia. Biochemical and Biophysical Research Communications , 1999, 259 (3) : 523–526. DOI:10.1006/bbrc.1999.0815 |
| [15] | Choi JK, Hohzer S, Chacko SA, et al. Phorbol esters selectively and reversibly inhibit a subset of myofibrillar genes responsible for the ongoing differentiation program of chick skeletal myotubes. Mol Cell Biol , 1991, 11 (9) : 4473–4482. DOI:10.1128/MCB.11.9.4473 |
| [16] | 杨亚军, 王新超, 马春雷. 茶树肌动蛋白基因(CsActin1)全长cDNA克隆与生物信息学分析. 植物研究 , 2012, 32 (1) : 69–76. |
| [17] | 贺淹才. 肌动蛋白和肌动蛋白基因的研究进展. 生命的化学 , 2002, 22 (3) : 248–250. |
| [18] | Zhu XJ, Dai ZM, Liu J, et al. Actin gene in prawn. Macrobrachium rosenbergii: charact eristics and differential tissue expression during embryonic development. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology , 2005, 140 (4) : 599–605. DOI:10.1016/j.cbpc.2004.12.010 |
| [19] | Horigane M, Ogihara K, Nakajima Y, et al. Identification and expression analysis of an actin gene from the soft tick, Ornithodoros moubata(Acari: Argasidae). Archives of Insect Biochemistry and Physiology , 2007, 64 (4) : 186–199. DOI:10.1002/(ISSN)1520-6327 |
| [20] | Christine CK, Michelle DC, Fyrberg EA. A nonsense mutation within the act88f actin gene disrupts myofibril formation in Drosophila indirect flight muscles. Cell , 1984, 38 (3) : 711–719. DOI:10.1016/0092-8674(84)90266-6 |
| [21] | 刘秀霞, 梁旭方, 王琳, 等. 鳜鱼(Siniperca chuatsi)β-肌动蛋白基因cDNA全序列与5′侧翼区的克隆与分析. 海洋与湖沼 , 2009, 40 (1) : 102–108. |




