雷州黑鸭是广泛分布于雷州半岛的一种具有独特外貌特征(通体羽毛黑色)、个体小、肉质鲜香、产蛋量多、耐粗饲及抗逆性强等生产性能优良的肉蛋兼用型地方鸭种[1, 2]。其胸腿肌肌内脂肪含量较高,具有独特的风味与口感,在肌肉嫩度、肉色、粗脂肪率等方面表现出一定的天然优势,具有良好的肉用性能[3]。产肉性能是衡量家禽经济价值的重要指标之一,目前对雷州黑鸭的肉用性能研究主要有:陈琦[4]对雷州黑鸭内脏器官的结构进行观察发现其消化管长,有发达的肌胃和较发达的小肠,消化吸收功能强且具有耐粗饲的特点;汤绮明[2, 3]测定了300日龄雷州黑鸭的肉用性能,并对影响雷州黑鸭肉质嫩度的p94基因及其编码的蛋白进行功能分析;黄骏腾[5]对其滩涂生活习性进行观察发现雷州黑鸭得益于独特的地理位置,以鱼、虾、蟹、贝类、藻菜等浅海生物群落为食,肉质鲜美,其胸腿肌肌内脂肪含量较高;马猛[6, 7]对不同性别的雷州黑鸭屠宰性能和肉品质进行了测定,并对其血液生化性状与体尺性状、肉品质性状间的相关性进行分析。在机体生长发育过程中Pax3基因通过诱导骨骼肌卫星细胞与骨骼肌纤维融合增加骨骼肌纤维的直径,从而增加肌肉的嫩度[8]。DCN参与调控组织形态改变、胶原纤维的形成、细胞分化、增殖等过程,在细胞生长发育过程中起着重要作用[9]。DCN基因的表达可以促进成肌细胞分化、肌纤维的形成与肌肉再生[10]。MSTN基因通过接收DCN基因的调控降低对成肌细胞分化与增殖的抑制作用[11]。研究发现它既可以直接参与抑制成肌细胞分化和生长,也可以通过调控巨噬细胞的活性,抑制卫星细胞的分化,从而抑制成肌细胞增殖与分化[12-16]。大量研究表明Pax3、DCN和MSTN三个基因在早期胚胎中前体肌细胞的分化、增殖、促进肌纤维的形成起到至关重要的作用。
为了保护雷州黑鸭优异的肉用性能,并开发这一珍贵的种质资源,本研究以雷州黑鸭为实验材料,对其不同胚龄期的胸腿肌进行切片观察,并且以对骨骼肌生长发育有着重要调控作用的Pax3、DCN和MSTN基因为研究对象,尝试通过不同胚龄期Pax3、DCN和MSTN基因mRNA和蛋白质的表达量分析探讨其对雷州黑鸭胚胎期骨骼肌形成的调控作用及功能上的关系,从而为优质雷州黑鸭的品种选育和分子育种提供理论依据,并为其肉的生产和加工提供理论指导。
1 材料与方法 1.1 材料 1.1.1 实验动物选取在同一孵化条件下8、13、18、23、28胚龄的雷州黑鸭孵化蛋各共45个。
1.1.2 主要试剂Total RNA提取试剂盒、PrimeSc-ript RT reagent Kit with gDNA Eraser(Perfect Real ti-me)、TaKaRa荧光定量试剂盒、DNA Marker DL2000、DNA Marker DL5000、10×loading Buffer均购置于TaKaRa公司;三氯甲烷、异丙醇和无水乙醇等常规试剂均为国产分析纯、DEPC(购于金鑫天佑公司);琼脂粉购于OXOID公司;甘氨酸、Tris、琼脂糖、十二烷基磺酸钠、过硫酸钠、丙烯酰胺均为分析纯(上海国药,中国);Tissue Protein Extraction Kit、BCA Protein Assay Kit、Multicolor Protein Marker、SDS-PAGE上样缓冲液(非还原,5×)、Eecl Western Blot Kit均购置于康为世纪。
一抗:Pax3(A-5)抗体、Decorin(H-80)抗体、GDF-8/11(H-109)抗体、Actin(C-2)抗体均购置于SantaCruz,USA,稀释比例为1 ∶ 400。
二抗:Peroxidase-Labeled Affinity Purified Antib-ody To Mouse lgG(H+L)购置于KPL公司,稀释比例为1 ∶ 10 000;HRP标记山羊抗兔IgG(H+L)购置于巧伊生物技术有限公司,稀释比例为1 ∶ 12 000。
1.1.3 主要仪器台式高速冷冻离心机(Sigma,美国)、梯度PCR仪(PTC-100,Bio-Rad)、水平电泳槽、StepOne Plus荧光定量PCR仪(Applied Biosystems,美国)、Biophotometer6131型核酸蛋白分析仪(eppendorf,德国)、超低温冰箱(SANYO,日本)、GDS-800凝胶成像系统(UPV,美国)、恒温培养箱(上海福玛试验设备有限公司,中国)、5810R型低温超速离心机(Eppendorf,德国)、IS2000MM化学发光成像系统(KODAK,美国)、超纯水系统(Veolia Water Systems,英国)、自动制冰机(上海安亭科学仪器厂,中国)、高压灭菌锅(上海申安医疗器械厂,中国)、电热恒温干烤箱(上海福玛试验设备有限公司,中国)、AY12O型电子天平(Shimadzu,日本)、HD-1360超净工作台(哈尔滨市东联公司,中国)、电泳仪、电泳槽(北京六一仪器厂,中国)。
1.2 方法 1.2.1 雷州黑鸭胚胎期胸腿肌组织形态研究 1.2.1.1 样品采集取8胚龄期发育正常的雷州黑鸭的腿芽和胸部躯干,以及13、18、23、28胚龄(每个胚龄取3个胚蛋)胚胎的腿肌和胸肌,置于10%福尔马林中保存。
1.2.1.2 石蜡包埋切片将固定的组织块用自来水冲洗过夜后用不同浓度的酒精脱水,二甲苯、苯、甲苯等试剂中进行透明后依次放在各个蜡杯中浸蜡。将预热好的和第3杯石蜡相同熔点的石蜡倒入折好的蜡槽内,然后将浸渗好的组织块放入蜡槽内,摆好组织块位置后放到4 ℃ 冰箱中冷却。将蜡块固定在切片机上,切片的厚度设为5 μm进行手动切片,置42 ℃ 水浴中展片。待切片充分展平后,取涂有一薄层鸡蛋清的载玻片在水中捞取蜡片,置38 ℃ 温箱中烘干。烘干好的切片在二甲苯中脱蜡10 min后进行苏木精伊红染色(HE染色)。最后采用尼康显微数码摄影系统在10×20倍镜下进行切片图像采集,每张切片采集3张清晰图片。
1.2.2 雷州黑鸭胚胎期Pax3、DCN和MSTN基因的相对表达量 1.2.2.1 样品采集选取在同一孵化条件下8、13、18、23、28胚龄的雷州黑鸭孵化蛋(各6个)。取8胚龄雷州黑鸭的腿芽和胸部躯干,13、18、23、28胚龄胚体的腿肌和胸肌,以及28胚龄的内脏(心、肝、脾、肺、肌胃、小肠、脑)。做好标记,用液氮速冻,放-80 ℃ 冰箱保存。
1.2.2.2 组织总RNA提取采用常规方法提取RNA,电泳检测RNA符合质量要求的放于-80 ℃ 保存。
1.2.2.3 cDNA合成cDNA合成步骤:按TaKaRa公司PrimeScrip RT reagent Kit(for Real Time)试剂盒说明书进行。除去基因组DNA,4 ℃ 保存。反转录反应完成后合成的cDNA置于-20 ℃ 冰箱保存。
1.2.2.4 实时荧光定量PCR引物设计选取 β-肌 动蛋白(β-actin,登录号:EF667345)作为内参基因,根据NCBI上公布的鸭Pax3(登录号:JQ070187.1)、DCN(登录号:XM_005012380.1)和MSTN(登录号:EU336992.1)基因及内参基因的保守区序列设计4对荧光定量引物(表 1),用于实时荧光定量PCR检测Pax3、DCN和MSTN基因在各组织中的特异性表达,实验重复3次。
反应程序:94 ℃ 35 s;94 ℃ 20 s,57 ℃ 35 s,72 ℃ 25 s,40个循环;95 ℃ 15 s,60 ℃ 1 min;95 ℃ 15 s,每升高0.2 ℃ 采集一次荧光。在PCR反应过程中,所用反应用同一cDNA作为板间对照,以加入cDNA换成纯化水作为阴性对照。通过实时荧光定量PCR反应,根据得出目的基因与内参基因的Ct值采用2-△△CT的方法计算Pax3、DCN和MSTN基因在各个胚龄胸腿肌以及内脏组织中的mRNA相对表达量,荧光定量结果采用spss17.0软件在P<0.05水平上进行多重比较显著性检验。
1.2.3 雷州黑鸭胚胎期骨骼肌中Pax3、DCN与MSTN蛋白的表达研究 1.2.3.1 样品采集方法同1.2.2.1。
1.2.3.2 组织中蛋白提取组织蛋白抽提前将蛋白抽提试剂4 ℃ 预冷,按照1 ∶ 99比例加入蛋白酶抑制 剂混合物,配置1×工作液。按照1 ∶ 10(g/mL)的比例加入组织蛋白抽提试剂后对组织进行匀浆处理,冰上孵育25 min。10 000 r/min离心15 min,抽取上清液,置于-80 ℃ 冰箱保存。样品蛋白浓度采用BCA法进行分析。
1.2.4 Westernblot分析 每个样品上样量按35 μg总蛋白用25 µL微量进样器进行上样,蛋白在5%浓缩胶期间80 V进行电泳,进入到分离胶时调整电压120 V,约1.5 h,当溴酚蓝跑至胶底部时停止电泳。剪与凝胶大小等同的硝酸纤维膜和4块滤纸,在转移缓冲液中按照从负极到正极的顺序进行以下组装:海绵垫 - 滤纸 - 凝胶 - 硝酸纤维膜 - 滤纸 - 海绵垫,注意要赶走气泡,然后夹紧置于电转仪中,添加转移缓冲液,恒流200 mA转移 1-2 h。将膜用TBS清洗1次(5 min),浸入5%脱脂奶粉(TBS溶解)中37 ℃ 封闭1 h(或4 ℃ 封闭过夜),将膜取出,TBS清洗1次(5 min);在5%脱脂奶粉(TBS溶解)中加入一抗,膜浸入其中,37 ℃ 孵育1 h;将杂交膜1×TTBS清洗5次,每次5 min;在5%脱脂奶粉中加入二抗,将膜浸入其中,37 ℃ 孵育1 h;1×TTBS 清洗5次,每次5 min,1×TBS洗15 min;利用化学发光试剂盒进行发光后在暗室中压胶片,最后将胶片依次置于显影液和定影液中,胶片干燥后照相。
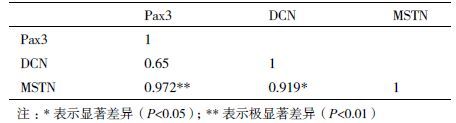
1.2.5 Pax3、DCN与MSTN基因间功能相关性分析在肌纤维的形成以及生长发育过程中,Pax3、DCN和MSTN基因起关键性作用,被认为是影响肌纤维特性的候选基因。为进一步了解Pax3、DCN和MSTN基因与雷州黑鸭骨骼肌形成的密切关系,以及在骨骼肌形成过程中相互之间的功能联系,本研究采用spss 17.0软件对Pax3、DCN与MSTN三个基因在胚胎期骨骼肌中的mRNA表达量进行相关性分析。
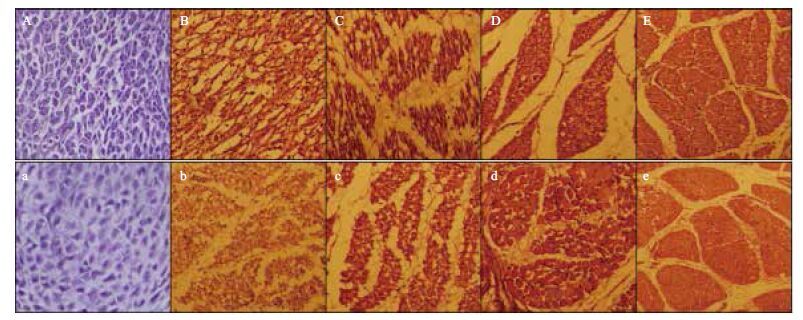
2 结果 2.1 雷州黑鸭胚胎期胸腿肌组织形态研究切片观察不同胚胎期雷州黑鸭胸腿肌组织,由切片图 1 A - E可以看出雷州黑鸭胚8胚龄时胸肌细胞核位于细胞中央,单个肌纤维细胞存在,成纺锤形;13胚龄时肌纤维细胞出现细胞溶合形成肌管具有多核特征;18胚龄时进入肌管时期,并且出现肌纤维束轮廓;23胚龄时肌纤维束形成,表现为肌管时期的典型特征;28胚龄时肌管逐渐减少,肌纤维明显。由切片图 1 a - e可以看出雷州黑鸭胚8胚龄时胸肌细胞核位于细胞中央,单个肌纤维细胞存在,成纺锤形;13胚龄时就出现了肌细胞核逐渐朝边上移动,多核肌管开始形成,并出现肌纤维束轮廓;18胚龄时存在典型的多核肌管,处于肌管时期;23胚龄时部分肌管存在,形成肌纤维,细胞核移向细胞边缘;28胚龄时形成成熟的肌纤维。
|
| 图 1 雷州黑鸭胚胎期胸腿肌切片图(10×20倍,HE染色) A:成肌细胞;B:多核肌管;C:肌纤维束;D:肌纤维束;E:肌纤维;a:成肌细胞;b:多核肌管;c:肌纤维束;d:肌纤维;e:成熟肌纤维。A - E:分别对应雷州黑鸭胚胎8、13、18、23和28 d的胸肌切片;a - e:分别对应雷州黑鸭胚胎 8、13、18、23和28 d的腿肌切片 |
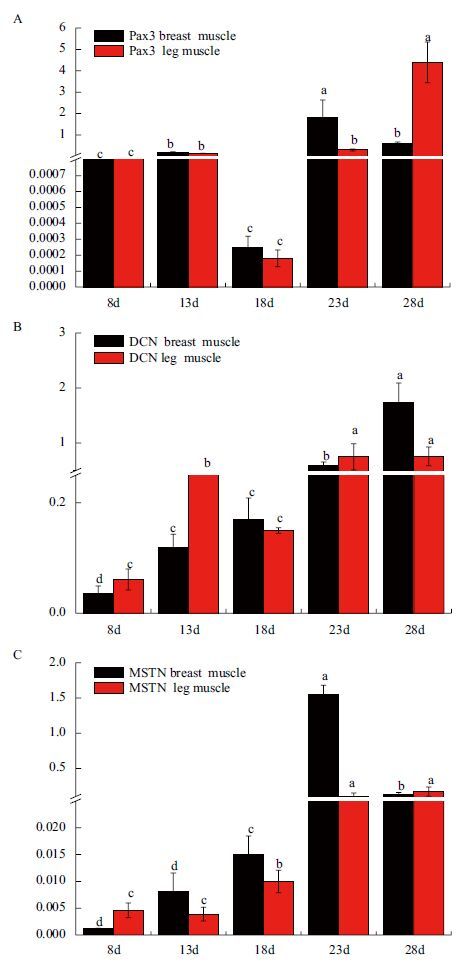
由图 2-A分析表明,雷州黑鸭胸肌组织中Pax3 mRNA相对表达量在23胚龄时显著高于其它胚胎期的相对表达量(P<0.05),而在腿肌中,Pax3 mRNA相对表达量在28胚龄时最高(P<0.05),8和18胚龄时Pax3 mRNA相对表达量在胸腿肌中均最低,差异不显著(P>0.05),Pax3基因在雷州黑鸭胸腿肌中整体表现为先升高后降低的趋势,表达呈波浪式。图 2-B显示,胸腿肌中DCN mRNA相对表达量在28胚龄时相对表达量均最高(P<0.05),8胚龄期的相对表达量最低,整体均呈上升趋势。但是在腿肌组织中DCN mRNA相对表达量在13胚龄时达到一个小高峰,显著高于8和18胚龄期的相对表达量(P<0.05)。图 2-C显示,胸肌组织中MSTN mRNA相对表达量在23胚龄时显著高于其它胚胎期的相对表达量(P<0.05),8和18胚龄时相对表达量最低,差异不显著(P>0.05),在腿肌中MSTN在23和28胚龄时相对表达量最高,在8和13胚龄相对表达量最低,MSTN基因在雷州黑鸭胚胎期胸肌中的表达呈先升高后降低的趋势,腿肌中的表达则逐步增加。
|
| 图 2 雷州黑鸭胚胎期胸肌中Pax3(A)、DCN(B)和MSTN(C)基因mRNA相对表达量 所标字母相异表示差异显著(P<0.05);所标字母相同表示差异不显著(P>0.05) |
定量PCR分析雷州黑鸭胚胎期不同组织Pax3、DCN和MSTN mRNA的表达模式结果发现,在胸肌和腿肌中Pax3、DCN和MSTN mRNA的表达显著高于其他组织(P<0.05)。从胸腿肌中比较3个基因的表达,Pax3在腿肌中表达量最高,DCN则在胸肌组织中表达量最高。DCN和MSTN在心、肝、脾、肺、胃、小肠、脑中的表达量处于同一表达水平,且在各组织中表达量最低,差异不显著(P>0.05)。其中,Pax3在脾和肺中的表达量显著高于心、肝、胃、小肠、脑中表达的量(P<0.05)(图 4)。

|
| 图 3 雷州黑鸭胚胎期各组织中Pax3、DCN和MSTN基因mRNA相对表达量 *表明差异显著(P<0.05) |

|
| 图 4 雷州黑鸭胚胎期胸腿肌中Pax3、DCN、MSTN与β-actin蛋白表达谱 M:蛋白Marker;8,13,18,23,28:分别代表雷州黑鸭孵化期8、13、18、23及28 d |
本研究采用Western blot实验方法对雷州黑鸭胚胎期骨骼肌中DCN蛋白进行检测,图 4显示,雷州黑鸭胸肌组织中Pax3蛋白和DCN蛋白在8和13胚龄期表达量较低,到18胚龄时表达量增加,而MSTN蛋白在8、13和18胚龄期表达量较低,在23胚龄时Pax3、DCN和MSTN蛋白表达量均达到高峰,蛋白条带颜色最深;腿肌组织中Pax3和DCN蛋白在13胚龄时就有明显的条带,在28胚龄时Pax3蛋白条带颜色最深,DCN蛋白在23和28胚龄时条带颜色最深,MSTN蛋白在28胚龄时条带颜色最深。内参蛋白β-actin蛋白的表达量处于一个稳定水平。
2.5 统计结果与分析采用spss 17.0软件对Pax3、DCN与MSTN三个基因在胚胎期骨骼肌中的mRNA表达量进行相关性分析(表 2),发现Pax3基因的表达量与DCN相关性不显著,与MSTN存在极显著的正相关关系;DCN基因的表达量与MSTN存在显著的正相关关系。
雷州黑鸭骨骼肌形成经历了由成肌细胞,多核肌管,肌纤维这一过程。结合切片图对比表达模式的分析结果发现,13胚龄的胸肌和腿肌中均有大量肌管开始出现,相应的Pax3在这一时期胸腿肌中的mRNA和蛋白表达量均达到一个峰值,表明雷州黑鸭Pax3基因在胚胎骨骼肌发育阶段调节多核肌管起重要作用;腿肌中13胚龄就形成了肌束膜,胸肌在18胚龄时才出现肌束膜,相应的DCN基因在腿肌中mRNA和蛋白的表达在13胚龄时达到一个高峰,表明DCN能够调节结缔组织形成,促进多核肌管进一步分化形成肌纤维,对肌纤维的生长发育、增殖起到至关重要的作用;而MSTN基因在胚胎后期大量表达结合组织23和28胚龄切片图分析发现,雷州黑鸭孵化后期阶段骨骼肌形成速度最快,随着孵化期得增加,大量肌纤维的形成,肌生成抑素水平提高,对骨骼肌的抑制作用增强。综上所述,Pax3、DCN与MSTN三个基因在雷州黑鸭胚胎期的前、中、后期等不同发育阶段调控着骨骼肌生成中成肌细胞的分化、增殖、促进肌纤维的形成与成熟。研究已表明Pax3基因通过诱导骨骼肌卫星细胞与骨骼肌纤维融合增加骨骼肌纤维的直径而增加肌肉的嫩度[8];DCN基因的表达可以促进肌肉再生而增加肌肉产量[9];MSTN在胚胎期后期抑制肌肉过度生长发育或肥大,防止肌肉出现双肌现象[17],其功能的缺失或表达量变化都会影响下游靶基因的表达量,从而改变肌肉的组织学结构而引起肌肉品质的变化[18]。所以对这3个基因在胚胎期不同阶段进行正确的调控,提高鸭肉的产量和改善鸭肉品质的作用,从而达到在鸭肉产量、嫩度以及肉品质上均能满足消费者们的需求。
肌肉的形成在长期的生长发育过程中是一个动态过程,因此鸭肉品质的形成也是一个循序渐进的过程,在这个过程中相关基因的分子调控起到至关重要的作用。对于Pax3、DCN与MSTN三个基因之间的调控关系以及在调控基因的同时对其下游靶基因的影响需要进一步试验才能得出。
4 结论雷州黑鸭胸腿肌组织切片观察发现其胚胎期腿肌的发育明显早于胸肌,同时对Pax3、DCN与MSTN三个基因在雷州黑鸭胚胎期骨骼肌中的mRNA和蛋白表达量相关性分析表明,雷州黑鸭胚胎期骨骼肌形成时期依赖于Pax3、DCN与MSTN基因的精准调控。Pax3基因在胸腿肌中表达规律基本相同,在mRNA转录和蛋白翻译过程中存在时间间隔,且具有组织表达特异性。DCN与MSTN基因在胸腿肌组织中表达规律均不一致,mRNA转录和蛋白翻译在胸肌组织中都存在时间间隔,但在腿肌组织中不存在,表达具有组织特异性。
| [1] | 汤绮明, 苏瑛, 谭道杰, 等. 雷州黑羽鸭外貌特征及体型性状的主成分分析. 中国家禽 , 2012, 19 : 20–24. |
| [2] | 汤绮明. 雷州黑鸭部分种质特性的研究[D]. 广州: 广东海洋大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10566-1013225068.htm |
| [3] | 汤绮明, 苏瑛, 张丽, 等. 雷州黑鸭p94部分序列的克隆与蛋白功能分析. 广东农业科学 , 2013, 1 : 147–149. |
| [4] | 陈琦, 肖卡, 苏瑛, 等. 雷州黑羽鸭内脏器官的结构观察. 广东农业科学 , 2012, 39 (23) : 110–114. |
| [5] | 黄骏腾, 苏瑛, 廖院华, 等. 雷州黑鸭滩涂生活习性观察. 南方农业学报 , 2014, 45 (3) : 484–488. |
| [6] | 马猛, 苏瑛, 王昊, 等. 雷州黑鸭蛋品质研究. 江苏农业科学 , 2014, 42 (2) : 159–161. |
| [7] | 马猛, 苏瑛, 汤绮明, 等. 雷州黑鸭体尺性状与屠宰性状间的典型相关分析. 中国农学通报 , 2014, 30 (5) : 33–37. |
| [8] | 姚守秀, 冯欣璐, 米拉, 等. 鸡, 鹌鹑和杂交种胚胎期生肌调节因子MyoG, Pax7表达规律的研究. 黑龙江畜牧兽医 , 2010, 23 (5) : 47–49. |
| [9] | Takeuchi Y, Kodama YT. Matsumoto, Bone matrix decorin binds transforming growth factor-beta and enhances its bioactivity. Biol Chem , 1994, 269 (51) : 32634–32638. |
| [10] | Li Y, Li J, Zhu J, et al. Decorin gene transfer promotes muscle cell differentiation and muscle regeneration. Mol Ther , 2007, 15 (9) : 1616–1622. DOI:10.1038/sj.mt.6300250 |
| [11] | Miura T, Kishioka Y, Wakamatsu J, et al. Decorin binds myostatin and modulates its activity to muscle cells. Biochem Biophys Res Commun , 2006, 340 (2) : 675–680. DOI:10.1016/j.bbrc.2005.12.060 |
| [12] | Mccroskwry S, Thomas M, Piatt L, et al. Improved muscle healing through enhanced regeneration and reducedfibrosis in myostatin-null mice. J Cell Sci , 2005, 118 (15) : 3531–3541. DOI:10.1242/jcs.02482 |
| [13] | Mcpherron AC, Lawler SJ. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature , 1997, 387 (6628) : 83–90. DOI:10.1038/387083a0 |
| [14] | Thomas M, Langley B, Berry C, et al. Myostatin, a negative regulator of muscle growth, functions by inhibiting myoblast proliferation. J Biol Chem , 2000, 275 (51) : 40235–40243. DOI:10.1074/jbc.M004356200 |
| [15] | Rios R, Carneiro V, Arce M, et al. Myostatin is an inhibitor of myogenic differentiation. Am J Physiol Cell Physiol , 2002, 282 (5) : 993–999. DOI:10.1152/ajpcell.00372.2001 |
| [16] | Whitemore LA, Song K, Li X, et al. Inhibition of myostatin in adult mice increases skeletalmuscle mass and strength. Biochem Biophys Res Commun , 2003, 300 (4) : 965–971. DOI:10.1016/S0006-291X(02)02953-4 |
| [17] | 沈冰营, 倪宏波, 苗树君. 肌肉生成抑制素基因及其应用研究进展. 黑龙江八一农垦大学学报 , 2005, 17 (5) : 57–60. |
| [18] | Lee SJ, Mcpherron AC. Myostatin and the control of skeletal muscle mass. Curr Opin Genet Dev , 1999, 9 (23) : 604–607. |