2. 北京林业大学林学院,北京 100083
2. College of Forestry,Beijing Forestry University,Beijing 100083
我国真菌资源丰富,截至2010年,已发现的真菌总 数达14 060种[1],其中食用菌936种[2],药用菌473种[3]。锦带花纤孔菌(Inonotus weigelae T. Hatt. & Sheng H. Wu),隶属于锈革孔菌科(Hymen-ochaetaceae),纤孔菌属(Inonotus),广泛分布于我国贵州、湖北、湖南、浙江等地,主要寄主为多种阔叶树的活立木或倒木[4]。作为一种白腐真菌,锦带花纤孔菌是重要的药用资源,具有抑肿瘤、抗氧化等多种功效[5]。
抗氧化能力是指对机体内氧化物质的清除能力,而生物体中有氧化作用的物质主要有超氧阴离子、羟 自由基及过氧化氢等,由于其性质较不稳定,极易攻击机体内细胞和体液中的生物大分子DNA、脂类 和蛋白质等[6, 7]。在微生物细胞中,机体主要通过两种途径进行抗氧化作用及自我调节。一种为预防性抗氧化途径,主要是通过分解过氧化物、阻断氧化链或去除起催化作用的金属离子以达到保护机体的目的。此途径主要涉及一些细胞内的自由基清除剂,包括超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Gluta-thione peroxidase,GPX)、谷胱甘肽还原酶(Gluta-thione reductase,GR)、谷胱甘肽转移酶(Glutathione transferase,GST)、一些维生素、氨基酸和金属蛋白等[8-10];另一种为即时性抗氧化途径,主要通过抗坏血酸(Ascorbic acid,AA,维生素C)、生育酚(维生素E)、没食子酸(Gallic acid)和一些酚类物质等清除一个或多个自由基,避免机体脂质过氧化[11, 12]。
目前已有大量研究报道了药用真菌的抗氧化活性。Kan等[13]通过响应面设计优化了亮盖灵芝(Ganoderma lucidum)多糖的产量,当提取时间、提取温度和水样比分别为137 min、66 ℃ 和35 mL/g时,多糖产量为2.44%,比热水提取时增加了2.0%。Xu等[14]探索了不同脂肪酸、表面活性剂和有机溶剂等对桦纤孔菌(Inonotus obliquus)分泌多糖能力及其抗氧化活性的影响,得到Tween 80可显著提高菌株多糖的抗氧化活性。Zhang等[15]发现利用超声波辅助提取可明显增强火木层孔菌(Phellinus igniarius)分泌多糖的能力及其抗氧化活性。程鑫颖等[16]对瓦宁木层孔菌(Phellinus vaninii)中的多酚和黄酮类成分进行了分离,并研究了其清除自由基的能力。Luo等[17]利用响应面设计优化了鲍姆桑黄(Sanghuangporus baumii)菌丝体的多糖产量,并测定了多糖的单糖组成及抗氧化活性。钱骅等[18]证实了桑黄(Sanghuangporus sanghuang)子实体分泌的多糖、黄酮和多酚类物质均具有抗氧化活性。
然而 ,大多数研究均集中于灵芝、桦纤孔菌、桑黄等少数模式菌株,缺乏对新资源的探索。鉴于锦带花纤孔菌也是一种药用真菌,与上述多种模式菌株在系统发育关系上十分相近[19],因此,本研究主要是将锦带花纤孔菌进行液体培养,测定其在此过程中的菌丝体生物量和漆酶活性变化,并评价体外抗氧化活性,从而为该种真菌进一步的药理研究及开发利用奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 供试菌株锦带花纤孔菌(Inonotus weigelae)菌株Dai 15768,采自于重庆市金佛山森林公园的锦带花(Weigela sp.)死树上,经分离纯化获得,现保藏于北京林业大学微生物研究所。
1.1.2 试剂2 ,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)(2 ,2’-azino-bis(3-ethylbenzthiazoline-6-sulp-honic acid),ABTS)、福林 - 酚(Folin-Ciocalteu)试剂、3 ,5-二硝基水杨酸(3 ,5-dinitrosalicylic acid,DNS)和1 ,1-二苯基-2-三硝基苯肼(1 ,1-diphenyl-2-picrylhydrazyl,DPPH)购自Sigma;丙二醛(Malonaldehyde,MDA)测定试剂盒、SOD测定试剂盒和总抗氧化能力(Total antioxidant capacity,T-AOC)测定试剂盒购自南京建成生物工程研究所;其他试剂为分析纯。
1.1.3 培养基固体培养基:葡萄糖20.0 g/L,酵母浸粉5.0 g/L,琼脂粉20.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,ZnSO4·7H2O 0.05 g/L,pH自然,1×105 Pa高压灭菌30 min,待指温可触时加入终浓度为0.01 g/L已过滤除菌的维生素B1,充分混匀备用。
液体培养基:葡萄糖20.0 g/L,酵母浸粉5.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,ZnSO4·7H2O 0.05 g/L,pH自然,1×105 Pa高压灭菌30 min,待指温可触时加入终浓度为0.01 g/L已过滤除菌的维生素B1,充分混匀备用。
1.2 方法 1.2.1 活化及培养于固体平板培养基上活化,28 ℃ 恒温培养箱培养10 d备用。
1.2.2 种子发酵及液体培养取250 mL三角瓶分装100 mL液体培养基,接种5个直径1 cm菌饼,于摇床28 ℃ 、150 r/min振荡培养 9-1 0 d。内切式匀浆机将种子发酵菌液制成悬液,充分振荡,以5.0%(体积比)的接种量加入含100 mL液体培养基的250 mL三角瓶中,于摇床28 ℃ 、150 r/min振荡培养,设3个重复。
1.2.3 样品制备每2 d取样,将整瓶培养物抽滤,所得菌丝球经去离子水冲洗数次,于烘箱65 ℃ 烘干至恒重后称重,计算菌丝体生物量。培养液经12 000 r/min离心20 min,上清液一部分用于测定培养液pH,一部分用于测定还原糖含量、漆酶活性、多酚含量、MDA含量、SOD活性、T-AOC和DPPH自由基清除能力。
1.2.4 还原糖含量测定采用DNS法测定还原糖含量[20]。
1.2.4.1 DNS试剂配制称取3.15 g DNS溶于500.0 mL去离子水中,搅拌5 s,水浴至45 ℃ 。后加入100.0 mL 0.2 g/mL氢氧化钠溶液,期间不断搅拌,直到溶液清澈透明。再逐步添加91.0 g四水酒石酸钾钠、2.5 g苯酚和2.5 g无水亚硫酸钠,45 ℃ 水浴加热,补加300.0 mL去离子水,期间不断搅拌,直至加入的物质完全溶解,冷却至室温后用去离子水定容至1.0 L,室温下避光保存7 d后备用。
1.2.4.2 标准曲线制作准确配制0.1、0.2、0.3、0.4、0.5、0.6和0.7 mg/mL葡萄糖标准液。分别吸取上述葡萄糖标准液0.5 mL于8支20 mL具塞刻度试管中,加入1.5 mL DNS试剂,摇匀后沸水浴5 min,取出冷却后用去离子水定容至20.0 mL,充分混匀。于540 nm处测定吸光值,设3个重复,求平均值。以反应体系中葡萄糖标准品的浓度为横坐标、吸光值为纵坐标作标准曲线,计算回归方程为:y=0.057 6x-0 .013 6,相关系数r2=0.997 1。
1.2.4.3 样品还原糖含量测定取0.5 mL离心后的上清液,加入1.5 mL DNS试剂,摇匀后沸水浴5 min,取出冷却后用去离子水定容至20.0 mL,按制作标准曲线的方法进行还原糖含量测定。以去离子水替代上清液同体积的反应混合液为对照,还原糖含量以培养液中葡萄糖当量计。
1.2.5 漆酶活性测定3.0 mL反应体系中,含1.95 mL柠檬酸 - 磷酸盐缓冲液(pH5.0)、50.0 μL上清液和1.0 mL 1.0 mmol/L ABTS,25 ℃ 反应3 min后,于420 nm处测定吸光值,以去离子水替代上清液同体积的反应混合液为对照[21]。定义1 min内催化氧化1 μmol ABTS所需的酶量为1个酶活力单位(U),设3 个重复,求平均值。已知420 nm处ABTS摩尔消光系数ε420=3.6×104 L/(mol·cm)。
1.2.6 多酚含量测定采用Folin-Ciocalteu法测定多酚含量[22]。
1.2.6.1 标准曲线制作准确配制0.08 g/L没食子酸标准液。分别吸取上述没食子酸标准液0、0.1、0.2、0.3、0.4、0.5、0.6和0.7 mL,加入0.3 mL 1.0 mol/L Folin-Ciocalteu试剂,避光放置8 min,再加入0.6 mL 10%(质量体积比)Na2CO3溶液,混匀后室温下避光反应30 min,用 去离子水定容至5.0 mL,于750 nm处测定吸光值。设3个重复,求平均值。以反应体系中没食子酸标准品的浓度为横坐标、吸光值为纵坐标作标准曲线,计算回归方程为:y=0.235 0x-0.183 0,相关系数r2=0.996 8。
1.2.6.2 样品多酚含量测定取5.0 mL离心后的上清液,加入等体积的乙酸乙酯,重复萃取3 次后,萃取液合并浓缩定容至5.0 mL[23],按制作标准曲线的方法进行多酚含量测定。以去离子水替代上清液同体积的反应混合液为对照,多酚含量以培养液中没食子酸当量计。
1.2.7 MDA含量测定采用南京建成生物工程研究所试剂盒测定。原理:过氧化脂质降解产物中的MDA可与硫代巴比妥酸缩合,形成红色产物,在532 nm处有最大吸收峰,以此可测定样品中MDA的含量。具体操作步骤按试剂盒说明书进行。
1.2.8 SOD活性测定采用南京建成生物工程研究所试剂盒测定。原理:通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子,后者氧化羟胺形成亚硝酸盐,加入显色剂后显紫红色,在550 nm处有最大吸收峰。当样品中含SOD时,则会以超氧阴离子为底物进行氧化,使形成的亚硝酸盐减少,得到的吸光值低于对照管的吸光值,以此可测定样品中SOD的活性。具体操作步骤按试剂盒说明书进行。定义1.0 mL样品中使超氧阴离子的 抑制率达50%时所需的样品量为1个SOD活力单位(U)。
1.2.9 T-AOC测定采用南京建成生物工程研究所试剂盒测定。原理:机体中有许多抗氧化物质,能使Fe3+还原成Fe2+,后者可与菲啉类物质形成稳固的络合物,通过比色可测出其抗氧化能力的高低。具体操作步骤按试剂盒说明书进行。定义在37 ℃ 下1.0 mL样品1 min内使反应体系的吸光值每增加0.01所需的样品量为1 个T-AOC单位(U)。
1.2.10 DPPH自由基清除能力测定DPPH自由基清除能力测定参照Brand-Williams等[24]的方法并稍作改动。
准确称取20.0 mg DPPH,用无水乙醇溶解并定容至250 mL,得到2.0×10-4 mol/L DPPH溶液。吸取2.0 mL上清液及2.0 mL 2.0×10-4 mol/L DPPH溶液加入同 一具塞试管中,充分摇匀,避光反应30 min后于517 nm处测定其吸光值A样品,同时测定2.0 mL 2.0×10-4 mol/L DPPH溶液与2.0 mL无水乙醇混合液的吸光值A空白。设3 个重复,求平均值。根据下列公式计算样品对DPPH自由基的清除率:清除率=(1-A样品/A空白 )×100%,其中,A样品为添加样品后DPPH溶液的吸光值;A空白为未添加样品时DPPH溶液的吸光值。
1.2.11 统计分析所得结果以x±s表示。利用SP-SS 20.0软件对数据进行单因素方差分析(ANOVA)、t-检验和LSD检验。
2 结果 2.1 生物量和pH为探索锦带花纤孔菌在液体培养过程中的生长变化,连续14 d对其菌丝体生物量进行了测定。结果(图 1)显示,在液体培养过程中,前12 d内锦带花纤孔菌的菌丝体生物量随着培养时间的增加而增长,其生长曲线呈“S”型,表现出典型的适应期、对数生长期和缓慢期。前 2 -6 d生长较缓慢,菌丝体表面致密光滑,形态饱满; 6-1 2 d迅速增长,期间菌株开始分泌酚类等小分子物质,并伴有色素产生,出现黄褐色;到第12天生物量达到最大值(0.12 g),此后呈下降趋势,菌丝体开始凋亡,出现自溶现象。

|
| 图 1 锦带花纤孔菌液体培养过程中菌丝体生物量的变化 |
锦带花纤孔菌液体培养过程中的pH变化(图 2)显示,接种后培养液pH为5.13,随着培养时间的增加,pH上升,尤其是第6天,pH达到5.71,可能是由于此时的菌株生长旺盛,可降解利用培养基中大量的有机物,例如,糖类等大分子物质被分解为各种小分子物质,因而造成pH较高。而第6天后pH下降,源于经过一段时间的积累,菌株分泌的酸性次级代谢产物增加,进而使得环境中pH下降。随后,pH在第10天后又呈增长趋势,可能是由于此时的菌株开始启动自身的抗氧化机制,使得代谢活动较为频繁。但总体而言,锦带花纤孔菌液体培养过程中的pH变化较小。
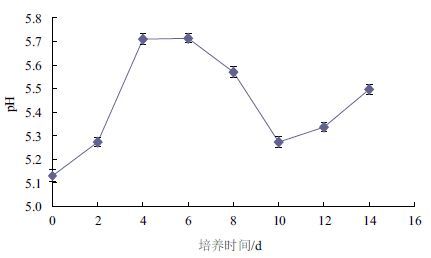
|
| 图 2 锦带花纤孔菌液体培养过程中pH的变化 |
如图 3所示,锦带花纤孔菌在液体培养过程中的还原糖含量变化较小。接种后,初始还原糖含量为41.28 mg/mL。前4 d呈增长趋势,这可能是由于液体培养基经过高温灭菌后,如酵母浸粉等物质被降解为单糖,这就为锦带花纤孔菌菌株的生长提供了充足的碳源,同时也为菌丝体合成各种酶类和分泌次级代谢产物提供了相应的能源,使得还原糖含量在第6天时呈下降趋势。随着培养时间的增加,该菌株逐渐分泌大量降解酶类,可更快地分解利用培养基,为还原糖的合成提供了基物,使得其合成量超过了消耗量,因此在第10天出现最大值,达68.33 mg/mL。此后,由于各种物质的积累和周围环境的变化,使得菌株启动自身的抗氧化机制,需要消耗大量营养物质,造成还原糖的消耗量远远超过合成量,呈现明显的下降趋势。
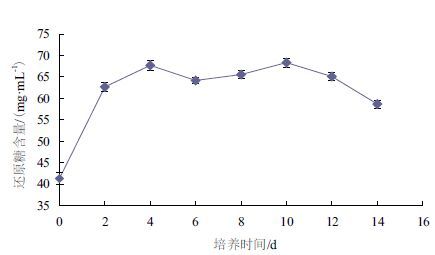
|
| 图 3 锦带花纤孔菌液体培养过程中还原糖含量的变化 |
本研究对锦带花纤孔菌液体培养条件下的漆酶活性进行了测定。结果(图 4)显示,由于营养利用与生理代谢相互依存,使得漆酶活性的变化趋势与菌丝体生物量基本一致,都是前期稳步增长,到第12天出现最高峰(0.25 U/mL),此后又开始降低。
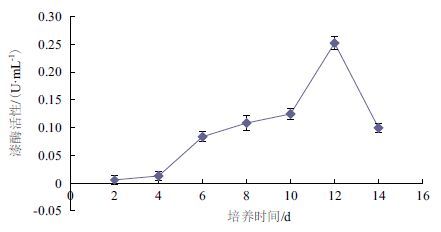
|
| 图 4 锦带花纤孔菌液体培养过程中漆酶活性的变化 |
如图 5所示,锦带花纤孔菌在液体培养过程中的多酚含量变化与菌丝体生物量及漆酶活性的变化趋势基本一致,都是随着培养时间的增加而增长,尤其是在 6 -8 d内迅速上升,到第12天时达到最大值(4.70 mg/mL),这表明该菌株分泌多酚的能力与其自身的生长状况密切相关。
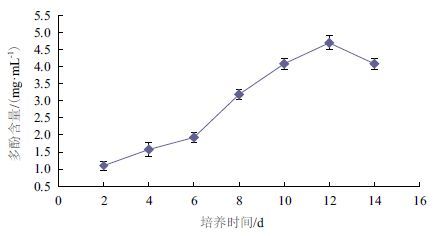
|
| 图 5 锦带花纤孔菌液体培养过程中多酚含量的变化 |
本研究对锦带花纤孔菌液体培养过程中MDA的含量变化进行了测定,结果(图 6)显示,前4 d内MDA含量迅速上升,这可能是由于菌株在液体培养过程中受到了来自环境压力下的氧化胁迫,处于适应阶段;随后,机体开始启动自身的抗氧化机制以抵抗外界的氧化损伤,表现在MDA含量的降低上;从第8天开始,MDA含量与菌丝体生物量、漆酶活性、多酚含量和还原糖含量的变化一致,均呈现上升趋势后缓慢下降,表明氧化胁迫既可以激发菌株自身的抗氧化能力,又通过不断的代谢反应产生多种自由基,以维持生物体代谢机能的动态平衡。

|
| 图 6 锦带花纤孔菌液体培养过程中MDA含量的变化 |
如图 7所示,前6 d内,锦带花纤孔菌在液体培养过程中的SOD活性从初始的1.64 U/mL减少至1.59 U/mL,这可能是由于菌丝球经过匀浆后有损伤和破碎,受到的氧化胁迫压力较大,致使分泌SOD的能力下降;随后,SOD开始迅速增长,到第14天可达到1.89 U/mL,表现出一定的优势,说明菌株已适应环境,并启动自身的抗氧化机制,以抵御外界的损害。
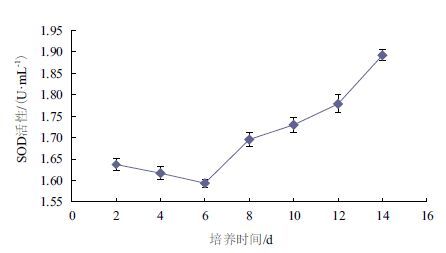
|
| 图 7 锦带花纤孔菌液体培养过程中SOD活性的变化 |
锦带花纤孔菌液体培养过程中T-AOC的变化如图 8所示,前8 d内,T-AOC几乎无变化,说明菌株处于适应环境阶段,并通过分泌各种自由基为合成次级代谢产物做准备。从第8天开始,T-AOC迅速上升,说明在氧化胁迫的刺激诱导下,菌株通过启动自身的抗氧化机制以抵抗外界的损害,这与SOD活性的变化趋势一致;同时,也促进机体合成大量抗氧化酶和抗氧化物质,包括漆酶和多酚在内,进而导致机体微环境中氧含量的减少和局部氧化胁迫的减轻。但相对而言,该锦带花纤孔菌菌株的抗氧化能力较强,第14 天可达到93.12 U/mL。
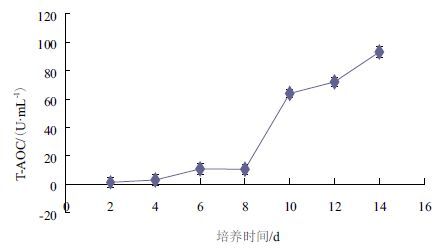
|
| 图 8 锦带花纤孔菌液体培养过程中T-AOC的变化 |
为评价锦带花纤孔菌在液体培养过程中的抗氧化活性,对其清除DPPH自由基的能力也进行了探索,结果(图 9)显示,培养初期,锦带花纤孔菌对DPPH自由基的清除率可达到78.56%,随着培养时间的增加,该菌株对DPPH自由基的清除能力稍稍下降,但在第6天时清除率仍可达75.58%,可能是由于此阶段的菌株生长较为旺盛,各种代谢功能都较强,致使其对自由基的清除能力也处于高峰时期。从第6天起,菌株对DPPH自由基的抑制作用开始迅速下降,这是因为到了培养后期,菌株的生长代谢能力下降,甚至出现自溶现象,其自身的抗氧化能力也相应降低,但在第14天时对DPPH自由基的清除率仍达到52.81%,进一步说明该锦带花纤孔菌菌株的抗氧化能力较强。

|
| 图 9 锦带花纤孔菌液体培养过程中DPPH自由基清除能力的变化 |
氧自由基(Reactive oxygen species,ROS),又称活性氧,主要包括超氧阴离子、羟自由基及有机过氧化物自由基等。在正常代谢过程中机体可产生ROS,而一些外界环境因素会增加细胞中ROS的浓度,如若不及时清除以恢复平衡,就会引起生物膜的过氧化损伤,甚至造成细胞器的损害和DNA与蛋白质等的降解与失活[25, 26]。因此,锦带花纤孔菌作为一种潜在的药用真菌,研究其抗氧化活性就显得尤为重要。
相对于同期培养的绒毛栓孔菌(Trametes pubescens)而言,锦带花纤孔菌的长势相对较慢,且培养过程中分泌大量色素,后期培养液呈现棕褐色[27]。随着培养时间的增加,培养液的pH先升高后下降再升高,呈波浪式变化,但总体而言pH变化较小,这些变化与锦带花纤孔菌菌株的次级代谢产物积累、营养物质利用、胞外酶分泌及抗氧化机制启动等密 切相关。次级代谢产物积累会导致pH下降,抑制菌丝体生物量的增加,但迫于环境的压力,自身的抗氧化系统活动频繁,又使得pH上升。漆酶是一种含铜的多酚氧化酶,属于蓝色多铜氧化酶家族,可降解木质纤维素类化合物,其活性大小可以衡量出菌株对营养物质的利用能力[28]。在降解木质素的过程中,漆酶可触发启动一系列的自由基链反应,同时将有机物氧化成多种自由基,而这些自由基作为基物在一定程度上能够促使菌株启动自身的抗氧化机制以抵抗外界环境的变化,说明漆酶活性的大小也可以间接反映出菌株的抗氧化能力[29]。因此,若以收获菌丝体为目的进行液体培养,则第12天是其最佳的液体种子收获期。
多酚含量、MDA含量、SOD活性、T-AOC和DPPH自由基清除能力直接反映锦带花纤孔菌菌株的抗氧化活性。其中,多酚是真菌在生长代谢过程中分泌的次级代谢产物,由一个或多个芳香环与一个或多个羟基结合而成,是一类具有生物活性的天然化合物,由于具有较高的羟基取代和吞噬自由基能力,多酚表现出较强的抗氧化活性[30]。此外,大量研究发现,多酚还可以抗感染、抗病毒、抗细菌、抗过敏、抗出血和抑制肿瘤形成等[31]。本研究中,锦带花纤孔菌在液体培养过程中的多酚含量随培养时间的增加而不断 增长,说明该菌株可分泌大量酚类物质,十分有益于其清除自由基和保护机体免于氧化损伤。MDA作为脂质过氧化的代谢产物,其含量可直接评估ROS的水平和细胞受损伤的程度[32]。而本研究发现,锦带花纤孔菌在液体培养过程中的MDA含量变化趋势与菌丝体生物量、还原糖含量、漆酶活性和多酚含量基本一致,说明脂质过氧化既可以激发菌株自身的抗氧化能力,又通过不断的代谢反应产生多种自由基,以维持生物体代谢机能的动态平衡。SOD是一种广泛存在于生物体内的金属酶,由细胞自发或酶促反应生成,通过催化超氧阴离子发生歧化反应,将其转变为过氧化氢和分子氧,清除机体代谢过程中产生的过多自由基,减轻或消除氧自由基对细胞的损伤,因此,SOD在机体的抗氧化系统中起着极为重要的作用[33]。T-AOC是机体内所有抗氧化性能的总和,也是衡量共同抗氧化系统功能状态的综合性指标[34]。SOD活性和T-AOC的变化趋势后期基本一致,都说明在氧化胁迫下,菌株通过启动自身的抗氧化机制以抵御外界的损伤,同时也通过分泌大量抗氧化酶来减少微环境中氧的含量。
DPPH是一种很稳定的自由基,其乙醇溶液显紫色,在517 nm处有最大吸收峰。当有供氢能力的抗氧化剂存在时,DPPH的溶液颜色会变浅,吸光值变小,据此可用于测定该物质的抗氧化活性[6]。本研究中,锦带花纤孔菌对DPPH自由基的清除率最高可达78.56%,随着培养时间的增加,清除作用逐渐减小,但到第14天时菌株对DPPH的清除率仍能保持在50%以上,说明该锦带花纤孔菌菌株的抗氧化活性较高。
与同期培养的药用真菌桑黄和槐生多年卧孔菌(Perenniporia robiniophila)相比,锦带花纤孔菌在液体培养过程中的多酚含量、MDA含量、SOD活性、T-AOC和DPPH自由基清除能力显著高于槐生多年卧孔菌,略高于桑黄。
综上所述,在液体培养过程中,菌株的抗氧化活性与对营养物质的利用情况、次级代谢产物的分泌及胞外酶的活性有较大的相关性,营养物质利用越充分,菌丝体生长越旺盛,生物量越大,菌株分泌次级代谢产物和胞外酶的能力也就越强,进而其抵抗自由基损伤的抗氧化活性也就越高[18, 33]。本研究为深入了解锦带花纤孔菌的培养特性和大批量液体培养提供了理论指导,同时也为该菌株后续的药理学研究奠定了基础。
4 结论本研究通过测定锦带花纤孔菌在14 d液体培养过程中菌丝体生物量、pH、还原糖含量、漆酶活性、多酚含量、MDA含量、SOD活性、T-AOC和DPPH自由基清除能力的变化,得到该药用真菌菌株具有较强的抗氧化活性,且这一活性与其对营养物质的利用情况、次级代谢产物的分泌及胞外酶的活性密切相关。
| [1] | 戴玉成, 庄剑云. 中国菌物已知种数. 菌物学报 , 2010, 29 : 625–628. |
| [2] | 戴玉成, 周丽伟, 杨祝良, 等. 中国食用菌名录. 菌物学报 , 2010, 29 : 1–21. |
| [3] | 戴玉成, 杨祝良. 中国药用真菌名录及部分名称的修订. 菌物学报 , 2008, 27 : 801–824. |
| [4] | 戴玉成, 图力古尔, 崔宝凯, 等. 中国药用真菌图志[M]. 哈尔滨: 东北林业大学出版社, 2013. |
| [5] | Wu SH, Dai YC, Hattori T, et al. Species clarification for the medicinally valuable ‘sanghuang’mushroom. Botanical Studies , 2012, 53 : 135–149. |
| [6] | 曹春蕾, 韩美玲, 崔宝凯, 等. 三种木层孔菌子实体不同溶剂提取物抗氧化活性的研究. 菌物学报 , 2013, 32 : 883–890. |
| [7] | Zhang GY, Yin QS, Han T, et al. Purification and antioxidant effect of novel fungal polysaccharides from the stroma of Cordyceps kyushu ensis. Industrial Crops and Products , 2015, 69 : 485–491. DOI:10.1016/j.indcrop.2015.03.006 |
| [8] | Kim JH, Campbell BC, Mahoney N, et al. Chemosensitization of aflatoxigenic fungi to antimycin A and strobilurin using salicylaldehyde, a volatile natural compound targeting cellular antioxidation system. Mycopathologia , 2011, 171 : 291–298. DOI:10.1007/s11046-010-9356-8 |
| [9] | Li R, Yuan C, Dong C, et al. In vivo antioxidative effect of isoquercitrin on cadmium-induced oxidative damage to mouse liver and kidney. Naunyn-Schmiedeberg’s Archives of Pharmacology , 2011, 383 : 437–445. DOI:10.1007/s00210-011-0613-2 |
| [10] | Si J, Cui BK. Study of the physiological characteristics of the medicinal mushroom Trametes pubescens(higher basidiomycetes)during the laccase-producing process. International Journal of Medicinal Mushrooms , 2013, 15 : 199–210. DOI:10.1615/IntJMedMushr.v15.i2 |
| [11] | Ortigosa SM, Díaz-Vivancos P, Clemente-Moreno MJ, et al. Oxidative stress induced in tobacco leaves by chloroplast over-expression of maize plastidial transglutaminase. Planta , 2010, 232 : 593–605. DOI:10.1007/s00425-010-1185-y |
| [12] | Wang WB, Kim YH, Lee HS, et al. Differential antioxidation activities in two alfalfa cultivars under chilling stress. Plant Biotechnology Reports , 2009, 3 : 301–307. DOI:10.1007/s11816-009-0102-y |
| [13] | Kan YJ, Chen TQ, Wu YB, et al. Antioxidant activity of polysaccharide extracted from Ganoderma lucidum using response surface methodology. International Journal of Biological Macromolecules , 2015, 72 : 151–157. DOI:10.1016/j.ijbiomac.2014.07.056 |
| [14] | Xu XQ, Quan LL, Shen MW. Effect of chemicals on production, composition and antioxidant activity of polysaccharides of Inonotus obliquus. International Journal of Biological Macromolecules , 2015, 77 : 143–150. DOI:10.1016/j.ijbiomac.2015.03.013 |
| [15] | Zhang HN, Ma HL, Liu W, et al. Ultrasound enhanced production and antioxidant activity of polysaccharides from mycelial fermentation of Phellinus igniarius. Carbohydrate Polymers , 2014, 113 : 380–387. DOI:10.1016/j.carbpol.2014.07.027 |
| [16] | 程鑫颖, 包海鹰, 丁燕, 等. 瓦宁木层孔菌中多酚和黄酮类成分分离及清除自由基活性的研究. 菌物学报 , 2011, 30 : 281–287. |
| [17] | Luo JG, Liu J, Sun Y, et al. Medium optimization, preliminary characterization and antioxidant activity in vivo of mycelial polysaccharide from Phellinus baumii Pilát. Carbohydrate Polymers , 2010, 81 : 533–540. DOI:10.1016/j.carbpol.2010.03.010 |
| [18] | 钱骅, 赵伯涛, 陈斌, 等. 桑黄子实体多糖、黄酮和多酚含量与抗氧化活性相关性. 食品工业科技 , 2015, 36 : 104–108. |
| [19] | Zhou LW, Vlasák J, Decock C, et al. Global diversity and taxonomy of the Inonotus linteus complex(Hymenochaetales, Basidiomycota): Sanghuangporus gen. nov., Tropicoporus excentrodendri and T. guanacastensis gen. et spp. nov. , and 17 new combinations. Fungal Diversity , 2016, 77 : 335–347. DOI:10.1007/s13225-015-0335-8 |
| [20] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry , 1959, 31 : 426–428. DOI:10.1021/ac60147a030 |
| [21] | 司静, 崔宝凯, 戴玉成. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化. 微生物学通报 , 2011, 38 : 405–416. |
| [22] | 张梅梅, 魏志文, 刘玉冰, 等. Folin-Ciocalteu比色法测定桦褐孔菌多酚的条件优化. 菌物学报 , 2011, 30 : 295–304. |
| [23] | Zheng WF, Zhang MM, Zhao YX, et al. Accumulation of antioxidant phenolic constituents in submerged cultures of Inonotus obliquus. Bioresource Technology , 2009, 100 : 1327–1335. DOI:10.1016/j.biortech.2008.05.002 |
| [24] | Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. LWT-Food Science and Technology , 1995, 28 : 25–30. DOI:10.1016/S0023-6438(95)80008-5 |
| [25] | 李爱红, 陈鑫, 郭爱松. 白灵菇真菌多糖对衰老模型小鼠学习记忆能力、脑组织超氧化物歧化酶活性和丙二醛含量的影响. 临床神经病学杂志 , 2012, 25 : 126–128. |
| [26] | Nieto G, Huvaere K, Skibsted LH. Antioxidant activity of rosemary and thyme by-products and synergism with added antioxidant in a liposome system. European Food Research and Technology , 2011, 233 : 11–18. DOI:10.1007/s00217-011-1486-9 |
| [27] | 司静, 崔宝凯. 绒毛栓孔菌液体培养过程中胞外酶活性的研究. 基因组学与应用生物学 , 2012, 31 : 70–77. |
| [28] | Rivera-Hoyos CM, Morales-álvarez ED, Poutou-Pi?ales RA, et al. Fungal laccases. Fungal Biology Reviews , 2013, 27 : 67–82. DOI:10.1016/j.fbr.2013.07.001 |
| [29] | Hamza M, Khoufi S, Sayadi S. Fungal enzymes as a powerful tool to release antioxidants from olive mill wastewater. Food Chemistry , 2012, 131 : 1430–1436. DOI:10.1016/j.foodchem.2011.10.019 |
| [30] | Smith H, Doyle S, Murphy R. Filamentous fungi as a source of natural antioxidants. Food Chemistry , 2015, 185 : 389–397. DOI:10.1016/j.foodchem.2015.03.134 |
| [31] | Xu XQ, Hu Y, Zhu LH. The capability of Inonotus obliquus for lignocellulosic biomass degradation in peanut shell and for simultaneous production of bioactive polysaccharides and polyphenols in submerged fermentation. Journal of the Taiwan Institute of Chemical Engineers , 2014, 45 : 2851–2858. DOI:10.1016/j.jtice.2014.08.029 |
| [32] | Ruktanonchai U, Bejrapha P, Sakulkhu U, et al. Physicochemical characteristics, cytotoxicity, and antioxidant activity of three lipid nanoparticulate formulations of alpha-lipoic acid. AAPS Pharmacology Science and Technology , 2009, 10 : 227–234. DOI:10.1208/s12249-009-9193-6 |
| [33] | Lushchak VI. Adaptive response to oxidative stress: bacteria, fungi, plants and animals. Comparative Biochemistry and Physiology, Part C , 2011, 153 : 175–190. |
| [34] | Song Y, Hui J, Kou W, et al. Identification of Inonotus obliquus and analysis of antioxidation and antitumor activities of polysaccharides. Current Microbiology , 2008, 57 : 454–462. DOI:10.1007/s00284-008-9233-6 |




