2. 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,阿拉尔843300;
3. 昆明理工大学生命科学与技术学院,昆明 650500
2. Xinjiang Production & Construction Corps Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin,Aral 843300;
3. Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500
病毒广泛存在于各类生境中,在自然水体中的丰度尤其高[1-3]。湖泊作为连接陆地和淡水环境的交接点,多种矿物质沉淀赋存,尤其适宜微生物生存栖息,是理想的古生物基因库,病毒丰度平均为106 - 108 个/mL,尤以细菌病毒(噬菌体)占主导地位[4, 5]。国外对淡水湖泊噬菌体关注度较高,结合微观分子技术与宏观生态工程技术系统研究了不同营养化水平湖泊中病毒的类群与丰度、基因组序列分析及对区域生态系统功能维持的影响[6-9]。我国中科院水生生物研究所、武汉大学、中国海洋大学等机构也相继开展了浮游病毒的丰度、时空分布、检测技术等研究[10, 11]。系列成果表明,噬菌体在调控微生物种群演替、促进物种间遗传物质交换、介导物质循环、能量流动方面发挥着重要生态功能,对调控区域生态平衡有重大意义。
目前国内对湖泊噬菌体的研究多限于常温噬菌体,对高寒湖泊生境中的低温噬菌体,即能在 ≤ 4 ℃ 条件下侵染嗜冷或耐冷细菌并增殖的病毒[12]却鲜见报道。低温噬菌体长期在极端条件下生存,漫长的自然进化历程中可能形成独特的遗传结构和耐冷适应机制,利于抗逆基因资源的发掘。对低温噬菌体开展研究,不仅可丰富人们对极端生命多样性的认识,同时为深入探究生命起源、揭示物种进化历程、阐明适冷微生物的耐冷机制等提供基础资料。但迄今为止,只有为数不多的低温噬菌体被报道,丰富的低温噬菌体资源亟待发掘。
东帕米尔高原位于青藏高原西北部,素有我国“西疆极地”之称。高原上湖泊众多,多为冰川运动形成的构造断陷湖、冰蚀湖和冰碛湖。由于东帕米尔高原海拔高、冬季漫长、昼夜温差大、紫外辐射强等特点造就了其独特的生态环境和生物特有现象。课题组前期对东帕米尔高原喀拉库勒湖低温细菌多样性研究表明,假单胞菌(Pseudomonas)为优势菌群(数据待发表),进一步分析发现其中存在众多相应低温噬菌体。本研究以分离自喀拉库勒湖的2株假单胞菌低温噬菌体与明永冰川的1株假单胞菌低温噬菌体[13]为对象,对其形态及生物学特性进行比较研究,旨为深入探究不同地理环境下的低温噬菌体类型、生命特征、遗传差异及其与环境的互作关系奠定基础。
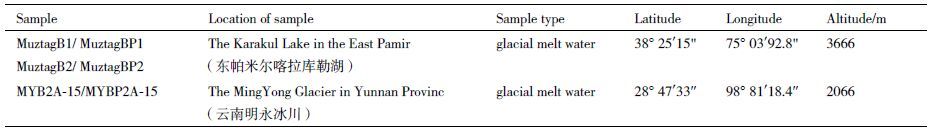
1 材料与方法 1.1 材料 1.1.1 样品来源宿主菌Pseudomonas sp. MuztagB1、Pseudomonas sp. MuztagB2及其噬菌体MuztagBP1、MuztagBP2分离自新疆东帕米尔高原喀拉库勒湖水样。宿主菌Pseudomonas sp. MYB2A-15及其噬菌体MYBP2A-15分离自云南低纬度、低海拔的明永冰川融水样。采样点特征详见表 1。
宿主菌Pseudomonas sp. MuztagB1、Pseudomonas sp. MuztagB2及噬菌体MuztagBP1、MuztagBP2分离培养采用PYGV培养基(参照DSMZ Medium621.PYGV AGAR,略有改动)。宿主菌Pseudomonas sp. MYB2A-15及其噬菌体MYBP2A-15分离培养采用LB培养基。固体培养基添加1.8%琼脂粉,半固体培养基添加4 g/L琼脂糖。
1.2 方法 1.2.1 低温噬菌体富集培养与效价测定噬菌体富集:将冷冻保存的宿主菌划线活化,接种单菌落至液体培养基,15 ℃ 、180 r/min振荡培养至对数期,再接入相应噬菌体保存液继续振荡培养24 h,13 000×g,15 min离心取上清即得噬菌体增殖液。重复培养可获得高效价噬菌体增殖液。
噬菌体效价测定:将对数期宿主菌液100 μL与300 μL适当稀释的噬菌体增殖液混合,15 ℃ 静置15 min后倾倒双层平板,待平板凝固后置于15 ℃ 培养 1-2 d,观察噬菌斑形成情况并计算效价。
噬菌体效价(pfu/mL)=噬菌斑数×稀释倍数×取样量折算数。
1.2.2 噬菌体形态观察依据文献[14],取效价1×109 pfu/mL的噬菌体液20 μL,滴于一枚230目碳支持膜铜网上,室温静置5 min,再用2%(wt/v)、pH5.6的磷钨酸染色15 min,待其干燥后用透射电镜(JEM-1200EX)观察噬菌体形态。
1.2.3 噬菌体包膜分析参照文献[15],将效价1×109 pfu/mL的噬菌体液100 μL与900 μL氯仿混匀,室温处理10 min(期间不断颠倒),4 000×g离心10 min,测定上层水相中噬菌体效价。将效价1×109 pfu/mL的噬菌体液100 μL与900 μL异丙醇混匀,室温处理30 min后测定噬菌体效价。依据文献[16],向效价为1×109 pfu/mL的噬菌体液中加入终浓度为5%的乙醚,4 ℃ 处理过夜,13 000×g离心2 min,测定下层水相中噬菌体效价。将效价1×109 pfu/mL的噬菌体液经0.1%的SDS(W/V)于56 ℃ 处理6 min,测定噬菌体效价。取效价1×109 pfu/mL的噬菌体液100 μL,用缓冲液(10 mmol/L Tris-HCl,5 mmol/L EDTA)稀释100倍,再加入终浓度1 mg/mL的蛋白酶K,于56 ℃ 处理1 h,测定噬菌体效价。
1.2.4 宿主菌生长与噬菌体增殖温度分析宿主菌生长温度范围测定:将宿主菌划线接种至平板上,分 别于4、10、15、20、25、30、37、42和48 ℃ 培养 2-3 d,观察细菌生长状况。
噬菌斑形成温度范围测定:取对数期宿主菌悬液100 μL与300 μL适当稀释的噬菌体增殖液混匀,倾倒双层平板,分别于4、10、15、20、25、30、37、42和48 ℃ 培养 1-2 d,监测噬菌斑形成情况及形态特征。
温度对噬菌体增殖活性的影响:取对数期宿主菌悬液100 μL与噬菌体液以MOI=10(multiplicity of infection,MOI)混匀,用15 ℃ 温育的新鲜液体培养基平衡体系至5 mL,根据宿主菌生长及噬菌斑形成温度范围,分别在4、6、8、10、12、14、16、18、20、22、24、26和28 ℃ 下振荡培养过夜,测定不同温度下噬菌体效价。
1.2.5 理化因素对噬菌体活性影响 1.2.5.1 热稳定性研究取效价为1×1 09 pfu/mL的噬菌体液1 mL,分别于40、50、60和70 ℃ 水浴保温1 h,测定各组噬菌体效价。
1.2.5.2 pH对噬菌体活性影响取不同pH( 3-1 1)的缓冲液各0.99 mL,25 ℃ 水浴30 min至温度平衡,再加入效价1×109 pfu/mL的噬菌体液0.01 mL,25 ℃ 处理1 h后测定各组噬菌体效价。
1.2.5.3 噬菌体紫外耐受性取效价为1×109 pfu/mL的噬菌体液2 mL于6孔板中,每株设2个平行,在紫外灯下(20 W,50 cm)分别处理0、4、8、12、16、20和24 min,再转移至暗处平衡30 min,分别测定不同处理时间下噬菌体效价。
1.2.6 一步生长曲线测定将1 mL对数期宿主菌悬液(约1×108 CFU/mL)与噬菌体液以MOI=10混匀,15 ℃ 吸附10 min后经11 000×g离心5 min,弃上清以新鲜液体培养基洗涤3次,尽量去除未吸附的游离噬菌体。沉淀用5 mL新鲜液体培养基重悬并15 ℃ 、160 r/min振荡培养,自0时起每20 min连续取样测定子代噬菌体效价。以取样时间为横坐标,测得噬菌体效价为纵坐标,绘制噬菌体的一步生长曲线,并计算3株噬菌体侵染宿主的潜伏期、裂解期及裂解量。
2 结果 2.1 噬菌体形态特征噬菌斑及噬菌体电镜形态如图 1所示,3株噬菌体均表现出较强的裂菌能力,15 ℃ 培养24 h后,双层平板上噬菌斑清晰可见,但大小各异,MuztagBP2和MYBP2A-15噬菌斑周围可见半透明晕环。

|
| 图 1 噬菌斑及噬菌体颗粒形态 A - C:分别为噬菌体MYBP2A-15、MuztagBP1和MuztagBP2的噬菌斑形态;D:噬菌体MYBP2A-15颗粒形态;E:噬菌体MuztagBP1颗粒形态;F:噬菌体MuztagBP2颗粒形态 |
电镜观察,3株噬菌体均为头尾型结构,头部呈正多面体对称。MYBP2A-15头部直径约74 nm,尾管呈收缩状,长度约160 nm,尾管直径约35 nm,头部与尾管的结合处有一颈圈状结构清晰可见;MuztagBP1形态与MYBP2A-15相似,但头部相对较小,直径约68 nm,也拥有一个长度约130 nm的粗状尾管;MuztagBP2的电镜形态与上述二者明显不同,头部直径约82 nm,尾管细长,约640 nm。根据3株噬菌体电镜特征,从形态学上将MYBP2A-15、MuztagBP1初步鉴定为肌尾噬菌体科,MuztagBP2归属为长尾噬菌体科。
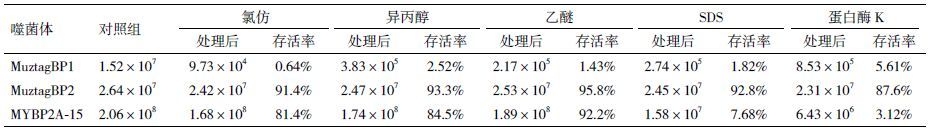
2.2 噬菌体包膜分析部分噬菌体的衣壳外可能有包膜包裹,其主要成分为脂类和蛋白质,是否有包膜与噬菌体的宿主专一性及侵染特性有关。3株噬菌体经不同化学试剂处理后敏感性不同(表 2),MuztagBP1对氯仿、异丙醇、乙醚、SDS和蛋白酶K均十分敏感,经处理后侵染活性几乎丧失,推断MuztagBP1核衣壳外含有脂膜包被。MuztagBP2、MYBP2A-15经氯仿、异丙醇和乙醚处理后存活率均在80%以上,分析其核衣壳外无脂质成分;MuztagBP2经SDS与蛋白酶K处理后,存活率分别为98.2%和87.6%,而MYBP2A-15对SDS与蛋白酶K表现敏感,经处理后存活率急剧下降。
噬菌体MuztagBP1、MuztagBP2、MYBP2A-15均可于 4-2 0 ℃ 侵染宿主并在双层平板上形成清晰可见的噬菌斑。宿主菌MYB2A-15可在 4-3 0 ℃ 范围内生长,最适生长温度1 0-1 5 ℃ ;而MuztagB1和MuztagB2的生长温度范围较MYB2A-15宽,上限可达37 ℃ ,1 5-2 0 ℃ 生长速率最快,温度升高或降低均显著影响宿主菌生长速率,详见表 3。
温度对噬菌体增殖活性影响如图 2所示,3株噬菌体在4 ℃ 时的增殖活性均较强,其中MuztagBP2产生子代噬菌体数量最多,其次是MYBP2A-15和MuztagBP1。噬菌体MuztagBP1在 4-8 ℃ 时子代噬菌体数量呈线性增长,8-2 0 ℃ 时噬菌体数量无显著性差异(P>0.05),温度超过22 ℃ 后,噬菌体数量直线下降,高于26 ℃ 则不增殖。而MuztagBP2与MYBP2A-15在 4-1 0 ℃ 时子代噬菌体数量与温度正相关,1 0-1 6 ℃ 噬菌体数量无显著差异(P>0.05),温度高于16 ℃ 时噬菌体数量随温度升高而急剧下降,超过24 ℃ 均丧失增殖能力。

|
| 图 2 温度对噬菌体增殖活性的影响 以相对效价P/P0表示,P0表示3株噬菌体的初始效价,P表示在不同温度下培养后的效价 |
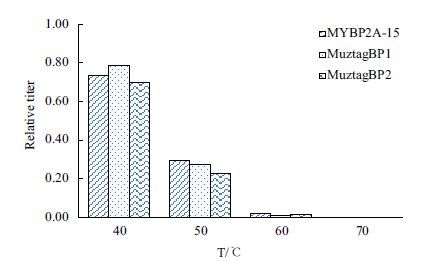
热稳定性分析(图 3)表明,3株噬菌体均对高温敏感。40 ℃ 处理 1 h,MuztagBP1、MuztagBP2和MYBP2A-15的存活率分别为79%、70%和74%,温度超过40 ℃ 后,噬菌体的存活率均呈直线下降趋势,60 ℃ 处理1 h三株噬菌体基本丧失侵染活性。这与前期报道的黄杆菌低温噬菌体特征相似,低温噬菌体的一大显著特点即是耐高温能力较差。
|
| 图 3 三株低温噬菌体的热稳定性分析 |
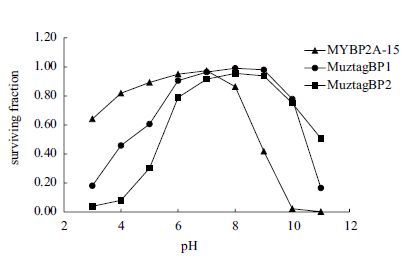
噬菌体对宿主的侵染活性与环境pH关系密切。图 4显示,MuztagBP1、MuztagBP2 在pH 6-9 时存活率最高,对酸性环境耐受性较差,在中性、弱碱性环境中相对稳定。与此相反,噬菌体MYBP2A-15在酸性环境中较稳定,pH=3时仍能保留57%的效价,pH 4-8 时仍有80%以上存活,pH>8时侵染活性直线下降。
|
| 图 4 pH对噬菌体MYBP2A-15、MuztagBP1和Muztag-BP2活性的影响 以相对效价P/P0表示,P0表示3株噬菌体的初始效价,P表示经不同pH下孵育1 h后的效价 |
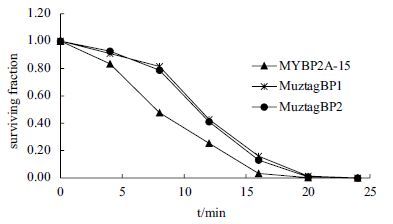
大多噬菌体对紫外线敏感,短时间照射即丧失增殖活性。但图 5显示,MuztagBP1、MuztagBP2、MYBP2A-15对紫外照射有一定耐受性。MuztagBP1、MuztagBP2经紫外线照射8 min其存活率仍可达80%以上,12 min后存活率保持40%左右,至照射20 min才完全丧失侵染能力。MYBP2A-15对紫外线相对敏感,处理8 min时其存活率仅剩48%,处理16 min基本丧失侵染活性。
|
| 图 5 三株噬菌体的紫外耐受性 |
噬菌体一步生长曲线如图 6所示,以MOI=10、15 ℃ 大幅振荡培养后,3株噬菌体的潜伏期、裂解期明显不同。其中MuztagBP2潜伏期最长,约100 min,裂解期约40 min;MuztagBP1潜伏期约80 min,裂解期约65 min;MYBP2A-15潜伏期、裂解期均最短,分别为65 min、35 min。根据一步生长曲线,计算得到MuztagBP1、MuztagBP2、MYBP2A-15的裂解量分别为7.6、56.7和11.4。

|
| 图 6 三株噬菌体的一步生长曲线 以相对效价P/P0表示,P0表示3株噬菌体的初始效价,P表示在不同培养时间测定的效价 |
自20世纪初第一株低温噬菌体被报道以来[17],人们逐步意识到极端环境中丰富的噬菌体资源,其在基础研究和生物工程开发方面具有特殊应用价值。前期研究表明,低温假单胞菌在东帕米尔高原洋布拉克冰川、喀拉库勒湖及低纬度、低海拔的云南明永冰川均为优势菌属,进一步研究发现相应噬菌体同样丰富。
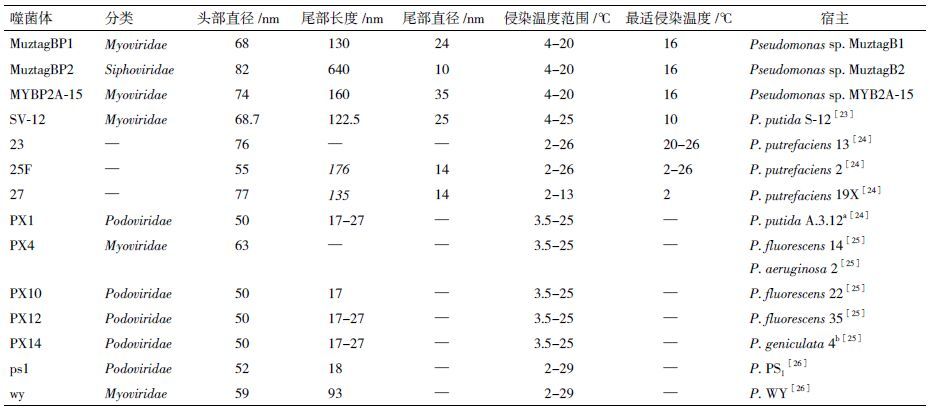
目前已知的低温噬菌体多为头尾型结构(表 4),本研究3株噬菌体也不例外,但形态差异显著。MYBP2A-15与MuztagBP1形态相似,都属肌尾噬菌体科,但两者头部直径与尾管长度差异明显。MuztagBP2在形态上与MYBP2A-15、MuztagBP1明显不同,其拥有一根长约640 nm的细长尾管,头部直径也较大,约82 nm,在已知的假单胞菌低温噬菌体中尾管最长,从形态学上将其归属为长尾噬菌体科。
低温微生物长久生存在寒冽生境中,多对低温具有一定适应与依赖机制,其生物活性发挥多依靠低温存在[18-20]。研究发现3株噬菌体的增殖活性在温度低于12 ℃ 时,子代噬菌体数量与温度呈正相关,高于18 ℃ 后,子代噬菌体数量又逐步减少,此现象可能与噬菌体的侵染能力及宿主菌生长温度有关。当温度低于12 ℃ 时,宿主菌生长缓慢,噬菌体的侵染水平也相应较低;在1 2-2 0 ℃ 时,宿主菌生长较快,被噬菌体侵染的机率也增大;当温度高于20 ℃ 后宿主菌虽仍在生长,但被噬菌体侵染的机率急剧下降,导致双层平板培养时很难观察到噬菌斑,具体机制尚待进一步分析。低温噬菌体的可增殖温度上限普遍低于宿主菌的最高生长温度[12],如噬菌体SV-12的侵染温度为 4-2 5 ℃ ,而宿主可在37 ℃ 生长;噬菌体ps1、wy侵染温度为 2-2 9 ℃ ,宿主最高生长温度可达32 ℃ ,本研究也不例外。此外,3株宿主菌同属耐冷假单胞菌,但生长温度范围不同,推测其差异缘于生存环境不同,是在长久进化历程中环境与宿主菌双向选择的结果。
低温噬菌体普遍呈现热不稳定性,如PX1、PX4、PX10等60 ℃ 处理30 min后基本失活,MYBP2A-15、MuztagBP1、MuztagBP2同样呈现热敏感性,而常温噬菌体在此温度下受影响较小,高温噬菌体更可耐受8 0-9 0 ℃ 的高温。推测低温噬菌体的热敏感性,一方面可能由于溶壁酶、穿孔素等在高温下不可逆变性失活,或噬菌体衣壳蛋白构象被破坏丧失吸附能力[25]。另一方面,从蛋白质观点看,噬菌体颗粒如同包裹着核酸的酶分子,低温酶特殊的结构特征使其柔顺性增加,催化活性更高,但同时也会影响到热不稳定性[26],其具体机制目前尚不清楚。大多噬菌体对紫外线敏感,短时间照射即丧失增殖活性[27, 28],但本研究中的3株噬菌体对紫外线照射均具有一定耐受性,且MuztagBP1、MuztagBP2的抗紫外能力明显高于MYBP2A-15,分析其原因可能是对生存环境长期适应的结果。MuztagBP1、MuztagBP2分离自东帕米尔高原,相对明永冰川其海拔更高、紫外辐射更强。噬菌体感染细菌的一步生长特征与噬菌体、宿主菌自身特性及培养条件密切相关。于龙等[29]报道,低温噬菌体相对常温、高温噬菌体而言潜伏期更长,有尾噬菌体潜伏期从11 min - 40 h不等,裂解量介于 2-2 000个。本研究MuztagBP1、MuztagBP2、MYBP2A-15一步生长特征显著不同,其潜伏期分别约80、100和65 min,裂解量分别约7.6、56.7和11.4,相比已报道低温假单胞菌噬菌体,潜伏期更短,裂解量更小。因这些噬菌体归属不同科,推测噬菌体的一步生长特征受其形态影响较小,主要取决于宿主和栖息环境[30]。
本研究率先对东帕米尔高原高寒湖泊进行低温噬菌体的分离,并对其部分生物学特征进行描述,研究结果不仅丰富了对低温噬菌体多样性认识,为该地区低温微生物资源开发利用提供新资料,而且有助于进一步了解低温噬菌体性质并进行抗逆基因分离。与明永冰川低温噬菌体生理特征的初步比较,为尝试解析不同地理环境的低温噬菌体形态结构、生理特征、遗传差异等积累数据,利于深入开展微生物抗逆性的生理与分子机理研究。
4 结论对东帕米尔高原喀拉库勒湖的假单胞菌低温噬菌体MuztagBP1、MuztagBP2和云南明永冰川的MYBP2A-15生物学特性进行比较研究,结果表明三株噬菌体颗粒形态明显不同,MuztagBP1、MYBP2A-15归属为肌尾噬菌体科,MuztagBP2为长尾噬菌体科。3株噬菌体均对热敏感,有一定的紫外耐受性,呈现出独特的一步生长曲线。低温噬菌体MuztagBP1、MuztagBP2、MYBP2A-15都以假单胞菌为宿主,但生物学特征各异。
| [1] | 卢龙飞, 汪岷, 梁彦韬, 等. 东海、黄海浮游病毒及异养细菌的分布研究. 海洋与湖沼 , 2013, 44 (5) : 1339–1346. |
| [2] | 刘晶晶, 杜萍, 曾江宁, 等. 夏季长江口浮游细菌和浮游病毒的分布特征及环境制约因素. 海洋学研究 , 2011, 29 (3) : 118–124. |
| [3] | Sandaa RA. Burden or benefit? Virus-host interactions in the marine environment. Research in Microbiology , 2008, 159 (5) : 374–381. DOI:10.1016/j.resmic.2008.04.013 |
| [4] | Breitbart M, Rohwer F. Here a virus, there a virus, everywhere the same virus?. Trends in Microbiology , 2005, 13 (6) : 278–284. DOI:10.1016/j.tim.2005.04.003 |
| [5] | Säwström C, Granéli W, Laybourn-Parry J, et al. High viral infection rates in Antarctic and Arctic bacterioplankton. Environmental Microbiology , 2007, 9 (1) : 250–255. DOI:10.1111/emi.2007.9.issue-1 |
| [6] | Danovaro R, Dell’Anno A, Corinaldesi C, et al. Major viral impact on the functioning of benthic deep-sea ecosystems. Nature , 2008, 454 (7208) : 1084–1087. DOI:10.1038/nature07268 |
| [7] | Tijdens M, Hoogveld HL, Kamst-van Agterveld MP, et al. Population dynamics and diversity of viruses, bacteria and phytoplankton in a shallow eutrophic lake. Microbial Ecology , 2008, 56 (1) : 29–42. DOI:10.1007/s00248-007-9321-3 |
| [8] | Colombet J, Charpin M, Robin A, et al. Seasonal depth-related gradients in virioplankton: standing stock and relationships with microbial communities in Lake Pavin(France). Microbial Ecology , 2009, 58 (4) : 728–736. DOI:10.1007/s00248-009-9535-7 |
| [9] | Bettarel Y, Sime-Ngando T, Amblard C, et al. Viral activity in two contrasting lake ecosystems. Applied and Environmental Microbiology , 2004, 70 (5) : 2941–2951. DOI:10.1128/AEM.70.5.2941-2951.2004 |
| [10] | 刘晶晶, 曾江宁, 杜萍, 等. 长江口及邻近海域夏, 冬季浮游病毒丰度分布. 应用生态学报 , 2011, 22 (3) : 793–799. |
| [11] | 白晓歌, 汪岷, 梁彦韬, 等. 运用荧光显微技术分析北黄海夏季浮游病毒的分布. 中国海洋大学学报:自然科学版 , 2008, 38 (4) : 609–613. |
| [12] | Wells LE, Deming JW. Characterization of a cold-active bacteriophage on two psychrophilic marine hosts. Aquatic Microbial Ecology , 2006, 45 (1) : 15–29. |
| [13] | 李明源. 明永冰川低温噬菌体分离及其特征研究[D]. 昆明: 昆明理工大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10674-1012431040.htm |
| [14] | 张琳, 乐率, 卢曙光, 等. 铜绿假单胞菌噬菌体PaP4的分离与鉴定. 微生物学通报 , 2013, 40 (4) : 609–616. |
| [15] | 白宇, 徐春燕, 苏建宇. 一株弗氏链霉菌噬菌体的分离及其分子特性研究. 生物技术通报 , 2014, 12 : 168–172. |
| [16] | 刘斌, 黄翔玲, 谷力, 等. 源于克雷伯氏菌Klebsiella sp. AC-11的3株噬菌体的生物学特性. 海洋学报 , 2011, 33 (4) : 147–154. |
| [17] | Elder AL, Tanner FW. Action of bacteriophage on psychrophilic organisms. The Journal of Infectious Diseases , 1928, 43 : 403–406. DOI:10.1093/infdis/43.5.403 |
| [18] | 李明源, 季秀玲, 王宝强, 等. 明永冰川融水中一株裂解性低温噬菌体的分离及特征. 微生物学报 , 2012, 52 (2) : 236–242. |
| [19] | 李明源, 王继莲, 魏云林, 等. 明永冰川三株黄杆菌低温噬菌体的生物学特性研究. 生命科学研究 , 2014, 18 (2) : 114–120. |
| [20] | 辛玉华, 周宇光, 东秀珠. 低温细菌与古菌的生物多样性及其冷适应机制. 生物多样性 , 2013, 21 (4) : 468–480. |
| [21] | 崔尹赡, 易萍, 许忠福, 等. 一株假单胞菌属低温噬菌体的分离及其特性研究. 中国微生态学杂志 , 2013, 25 (3) : 249–253. |
| [22] | Delisle AL, Levin RE. Characteristics of three phages infectious for psychrophilic fishery isolates of Pseudomonas putrefaciens. Antonie van Leeuwenhoek , 1972, 38 (1) : 1–8. DOI:10.1007/BF02328071 |
| [23] | Olsen RH, Metcalf ES, Todd JK. Characteristics of bacteriophages attacking psychrophilic and mesophilic Pseudomonads. Journal of Virology , 1968, 2 (4) : 357–364. |
| [24] | Whitman PA, Marshall RT. Characterization of two psychrophilic Pseudomonas bacteriophages isolated from ground beef. Applied Microbiology , 1971, 22 (3) : 463–468. |
| [25] | 史一博, 孙建和. λ噬菌体穿孔素(holin)蛋白触发裂菌的分子机制. 微生物学报 , 2012, 52 (2) : 141–145. |
| [26] | 于鹏, 刘静雯. 微生物适冷酶及其应用研究新进展. 微生物学杂志 , 2014, 34 (2) : 77–81. |
| [27] | 南南, 曹放, 沈俊涛, 等. 一株产1, 3-丙二醇的克雷伯氏菌的噬菌体生物学特性. 微生物学报 , 2013, 53 (9) : 943–949. |
| [28] | 高苗, 杨金广, 刘旭, 等. 一株裂解性青枯雷尔氏菌噬菌体的分离及生物学特性分析. 中国农业科学 , 2015, 48 (7) : 1330–1338. |
| [29] | 于龙, 温占波, 杨文慧, 等. 一株粘质沙雷氏菌烈性噬菌体污水分离及特性. 微生物学报 , 2008, 48 (4) : 498–502. |
| [30] | Stenholm AR, Dalsgaard I, Middelboe M. Isolation and characterization of bacteriophages infecting the fish pathogen Flavobacterium psychrophilum. Applied and Environmental Microbiology , 2008, 74 (13) : 4070–4078. DOI:10.1128/AEM.00428-08 |