2. 唐山师范学院,唐山 063000
2. Tangshan Normal University,Tangshan 063000
拟除虫菊酯类农药是根据天然除虫菊酯结构人工合成的杀虫剂。天然除虫聚酯为红花除虫菊花(Chrysanthemum coseum)和白花除虫菊(Chrysanthemum cinerariaefolium)中的有效杀虫成分。拟除虫菊酯具有高效、低毒的特点,在世界范围内被大规模的生产使用。氟氯氰菊酯与其他菊酯类农药相比具有相对低的成本,因而广泛应用于蔬菜、水果、大豆等作物的病虫害的防治[1]。
氟氯氰菊酯的大量使用不仅会在土壤、河流中产生大量残留而导致在哺乳动物如牛、羊和人类体内富集,还会使得害虫产生一定的抗药性[2]。同时有研究表明,氟氯氰菊酯对人与哺乳动物具有神经和生殖毒性并具有潜在的致癌性[3-5]。因此去除环境中氟氯氰菊酯的残留成为目前亟待解决的问题[6]。
因为生物修复安全高效的特点,采用微生物对农药的降解已成为解决环境中农药残留的重要途径[7, 8]。到目前为止,国内外学者已经分离得到了多种能够降解氯氟氰菊酯的微生物。2004年Saikia等[10]研究了绿色木霉Trichoderma viride 5-2在茄子表面氯氟氰菊酯残留降解的应用;2005年梁卫驱等[11]对氟氯氰菊酯降解菌曲霉属Aspergillus niger ZD11中水解酶进行了研究;2010年张建云[9]在拟除虫菊酯污染的土壤中分离获得了一株能够降解氯氟氰菊酯的绿脓假单胞菌Pseudomonas aeruginosa GZ-3;2014年胡桂琴等[8]在农药厂排污口的污泥中分离得到能够降解氟氯氰菊酯的巨大芽孢杆菌Bacillus megaterium FLQ-5。本研究利用农药厂的排污口周围采集到的泥土,通过富集驯化的方法筛选到一株氟氯氰菊酯高效降解菌YC-WZ5,并对其降解特性进行研究,旨在丰富氟氯氰菊酯农药降解菌的微生物资源,为氟氯氰菊酯的生物修复提供参考。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒质粒载体pMD19-T和宿主大肠杆菌E. coli DH5α由本实验室保藏;氟氯氰菊酯降解菌YC-WZ5由实验富集筛选得到。
1.1.2 主要试剂氯氟氰菊酯(99%)购于北京中国计量科学研究院,在甲醇中配制成1.0×104 mg/L的储配液,使用时将储备液稀释成适当的浓度加入到培养基中。细菌基因组提取试剂盒购自天根公司;PCR引物由上海生工合成;培养基中酵母提取物、蛋白胨购自Oxide公司;培养基中其他化学药品购自北京化工厂;正己烷为色谱纯,购自美国Fisher公司。
1.1.3 培养基MSM无机盐培养基:NH4NO3 1.0 g,MgSO4·7H2O 0.5 g,(NH4)2SO4 0.5 g,KH2PO4 0.5 g,NaCl 0.5 g,K2HPO4 1.5 g,酵母提取物0.5 g,用蒸馏水定容至1 L,用NaOH调节pH值至7.0。
TYC富集培养基培养基:蛋白胨10 g,酵母提取物10 g,KH2PO4 2.0 g,蒸馏水定容至1 L,调节pH值至7.0。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,用蒸馏水定容至1 L,用NaOH调节pH值至7.0。
固体培养基:于各种液体培养基中添加液体体积1.5%的琼脂。上述所有培养基在121 ℃ 灭菌20 min。
1.2 方法 1.2.1 降解菌株的富集与分离取自河北邢台农药厂排污口及周围农田的土壤作为最初的接种物。取5.0 g土壤样品,加入含有氟氯氰菊酯100 mg/L的100 mL富集培养液TYC中,于摇床上避光富集培养,摇床培养条件30 ℃ ,180 r/min。培养1周后,吸取10%的培养液于新的TYC富集培养液中,提高氟氯氰菊酯的浓度为200 mg/L。这样连续转接6次,每次转接富集培养的浓度升高100 mg/L。直至最终TYC培养液中的氟氯氰菊酯浓度为700 mg/L[12-14]。
在经过富集驯化培养后,将富集培养液进行系列稀释并涂布于含有氟氯氰菊酯浓度为200 mg/L的MSM固体培养基平板上,30 ℃ 的培养箱中培养2 d,挑取单菌落,进行纯化并验证降解能力。
1.2.2 菌株的鉴定与系统发育分析菌株的形态及生理生化鉴定参照《Bergey′s Manual of Systematic Ba-cteriology》[15]。采用TIANamp Bacteria DNA Kit(天根)提取菌株YC-WZ5基因组DNA。以提取的细菌基因组DNA为模板,使用16S rDNA的通用引物:5′-AGAGTTTGATCCTGGCTCAG-3′和5′-ACGGHTA-CCTTGTTTACGACTT-3′对菌株YC-WZ5的16S rDNA进行扩增。PCR扩增在Eppendoff-Mastercycler扩增仪上进行,扩增体系为50 μL典型扩增体系。PCR反应条件为:94 ℃ 预变性5 min;94 ℃ 变性1 min,53 ℃ 退火1 min,72 ℃ 延伸1.5 min,循环35次;72 ℃ 延伸10 min,4 ℃ 保存[16]。将扩增产物连接到pMD19-T上,转化E. coli DH5α,挑取阳性克隆[17]。序列测定由上海生工公司完成.测序结果通过BLAST与GenBank中注册的16S rDNA序列进行同源性比较。 用MEGA6.0软件以Neighbor-Joining 算法构建菌株系统发育树。
1.2.3 培养基中氟氯氰菊酯含量检测待检测的液体培养基样品中加入等体积的正己烷萃取氟氯氰菊酯,充分震荡后静置。移取上层有机相,加入无水Na2SO4干燥脱水后冷冻抽干,重溶于相同体积的正己烷中,气相色谱检测其浓度。气相色谱条件为:岛津 GC-2010气相色谱仪;Rtx-1301毛细管色谱柱;ECD检测器;进样口温度260 ℃ ,柱温升温程序为:180 ℃ 保留2 min,10 ℃ /min 升至280 ℃ ,保留10 min,ECD 检测温度300 ℃ ,载气N2(纯度>99.999%),流速:8 mL/min,进样量:1 μL,不分流进样[18]。氟氯氰菊酯降解率(%)=[1-(实测残量/对照样实测残量)]×100%[19]。
1.2.4 温度、pH值、接种量对降解率的影响研究温度、pH、接种量对氟氯氰菊酯降解率的影响,以pH7.0,10%接种量,30 ℃ 为基本条件进行单因素变化。将在LB液体培养基中培养至对数期的YC-WZ5菌体离心重悬后(OD600 ≈ 1.0),以10%的接种量分别测定在30 ℃ 条件下pH值为5.0、6.0、7.0、8.0和9.0的环境中50 mg/L氟氯氰菊酯的降解,连续培养5 d,每天取样;在pH7,10%的接种量条件下分别测定温度为20 ℃ 、25 ℃ 、30 ℃ 、35 ℃ 和40 ℃ 环境中50 mg/L氟氯氰菊酯的降解,连续培养5 d,每天取样;将在LB液体培养基中培养至对数期的YC-WZ5菌体离心重悬后(OD600 ≈ 1.0)分别按接种量为1%、3%、5%、10%和15%转接至30 ℃ ,pH7.0,10 mL含有50 mg/L氟氯氰菊酯的MSM液体培养基中,连续培养5 d,每天取样。以上实验均在180 r/min摇床中避光培养,以不接菌只含有50 mg/L氟氯氰菊酯的MSM液体培养基为对照,每次试验设3次重复,气相色谱测定氟氯氰菊酯残留量[20]。
1.2.5 响应面法对菌株YC-WZ5降解条件进行优化采用Design-Expert(v8.0.6)对降解菌株进行Box-Behnken实验设计,研究温度、pH值、接种量三个因素(表 1)对降解率的影响,优化降解条件。
将分离筛选出来的菌种YC-WZ5接种到LB液体培养基中活化至对数期。将菌体5 000 r/min,5 min离心。离心后所得菌体用灭过菌的生理盐水冲洗并且重悬(OD600 nm ≈ 1.0)[21]。以10.9%的接种量加入到10 mL的MSM液体培养基中,调pH为7.16,并加入氟氯氰菊酯农药母液使其终浓度为50 mg/L。用不加菌体只加入农药的MSM液体培养基作空白对照。用分光光度计测定菌体悬液OD600的值检测其生长状况。30.9 ℃ ,180 r/min摇床中避光培养,以不接菌为对照,每次实验设3次重复,气相色谱测定氟氯氰菊酯残留量。
1.2.7 菌株YC-WZ5对不同浓度氟氯氰菊酯的降解向MSM液体培养基中加入氟氯氰菊酯,使其终浓度为100、200、300和400 mg/L。以10%的接种量接入降解菌YC-WZ5。以不接菌为对照,每次实验设3次重复。30 ℃ ,180 r/min摇床中避光培养。连续培养5 d后气相色谱测定氟氯氰菊酯残留量。
1.2.8 菌株YC-WZ5对不同菊酯类农药的降解效果在分别含有50 mg/L的氯氰菊酯、功夫菊酯、溴氰菊酯和联苯菊酯的MSM液体培养基中以10%的接种量接入降解菌YC-WZ5。以不接菌为对照,每次实验设3次重复。30 ℃ ,180 r/min摇床中避光培养。连续培养5 d每天取样,气相色谱测定。
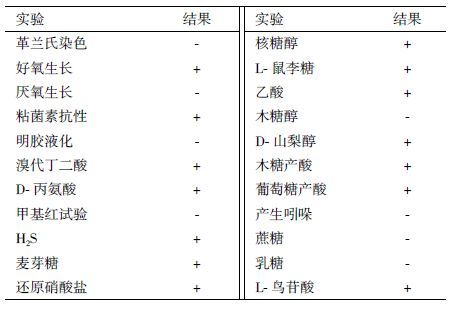
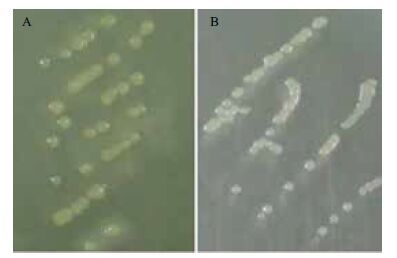
2 结果 2.1 菌株的分离鉴定经初步富集、筛选分离得到氟氯氰菊酯降解菌YC-WZ5。菌株YC-WZ5为革兰氏阴性菌,在LB培养基上菌落形态为圆形,表面光滑湿润,菌落周边整齐。其生理生化特征如表 2所示。
|
| 图 1 为YC-WZ5菌体形态照片 A:在LB平板上的菌落形态;B:在含100 mg/L氟氯氰菊酯MSM 平板上的菌落形态 |
菌株YC-WZ5的16S rDNA序列在GenBank的登录号为KP981385,与GenBank注册的16S rDNA序列进行同源比对,发现菌株YC-WZ5的16S rDNA序列与苍白杆菌属(Ochrobactrum sp.)序列相似性很高。构建系统发育树,结果(图 2)显示,菌株YC-WZ5与Ochrobactrum intermedium LMG 3301(U70978)具有较近的亲缘关系。根据生理生化检测结果结合菌株16S rDNA的遗传分析,确定菌株YC-WZ5为中间苍白杆菌(Ochrobactrum intermedium)。

|
| 图 2 菌株YC-WZ5和其它菌株的系统发育树 |
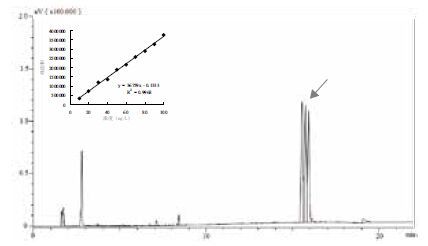
通过气象色谱测定氟氯氢菊酯的保留时间为15.416、15.599和15.783 min(为氟氯氰菊酯的3种同分异构体)。标准曲线为y=36 759x-0.133 33,R2=0.996 8。其中x为氟氯氰菊酯浓度,y为峰面积之和。气象色谱和标准曲线如图 3所示。
|
| 图 3 氟氯氰菊酯的气象色谱图及氟氯氰菊酯标准曲线 |
MSM液体培养基中温度对降解率的影响如图 4所示,在20 ℃ 、25 ℃ 、30 ℃ 、35 ℃ 和40 ℃ 的条件下菌株对氟氯氰菊酯的降解率分别为62.4%、87%、99.67%、96%和73.6%。

|
| 图 4 菌株YC-WZ5在不同温度下对氟氯氰菊酯的降解率 |
MSM液体培养基中pH对降解率的影响如图 5所示,在pH分别为5.0、6.0、7.0、8.0和9.0的条件下,菌株对氟氯氰菊酯的降解率分别为53.87%、84.97%、99.88%、94.2%和70.9%。

|
| 图 5 菌株YC-WZ5在不同pH下对氟氯氰菊酯的降解率 |
以不同接种量接种于含50 mg/L氟氯氰菊酯的MSM液体培养基中氟氯氰菊酯的降解结果(图 6)表明,在1%、3%、5%、10%和15%的接种条件下,氟氯氰菊酯的降解率分别为76.42%、84.35%、94.39%、99.91%和100%。

|
| 图 6 菌株YC-WZ5在不同接种浓度条件下氟氯氰菊酯降解曲线 |
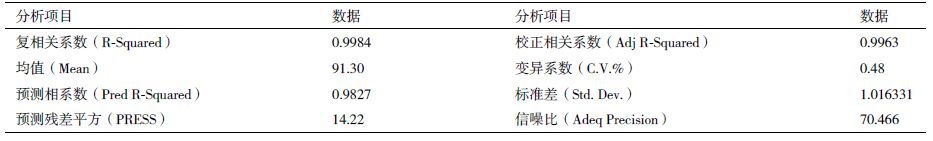
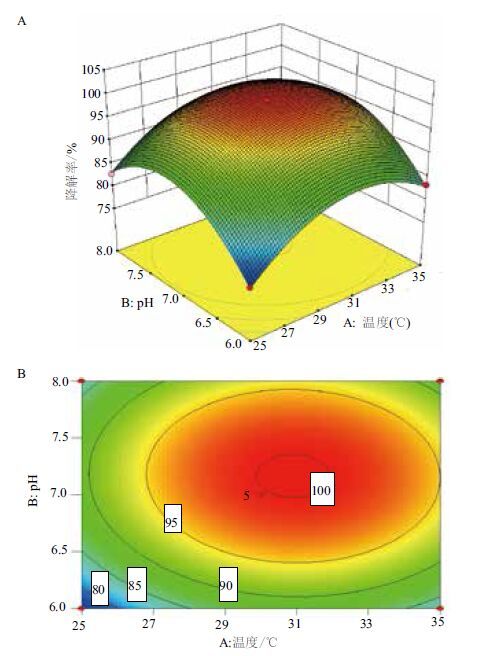
根据单因素实验结果,采用Design-Expert(v8.0.6)对降解菌株进行Box-Behnken实验设计。选择培养温度,接种量和pH值3个因素进行响应面分析实验。并对结果进行方差分析和二次多元回归拟合,得到降解率对该3因素模型的拟合方程:Y=99.82+2.93A+3.09B+3.04C-0.37AB+0.017AC+0.15BC-7.97A2-9.2B2-0.93C2,实验结果如表 3所示。
由表 4和表 5可知该回归模型P<0.000 1,说明该模型显著性很好。失拟项(Lack of Fit)>0.05,说明数据中没有异常点,回归方程拟合度高。R2=0.995 0,R2(adj)=0.988 59说明该模型拟合度较好。在培养温度,接种量和pH值3个因素中pH和温度的P<0.000 1,温度的P>0.01,说明温度和pH值为影响显著的两个因素。温度和pH值交互影响菌株YC-WZ5降解氟氯氢菊酯的等高线和响应面图如图 7所示。根据模型分析计算氟氯氰菊酯降解达到最大值的条件为培养温度30.9 ℃ ,pH值7.16,接种量10.9%,此条件下的响应预测值为100.373%。
|
| 图 7 接种量和pH值对氟氯氰菊酯降解率影响的响应面图(A)和等高线图(B) |
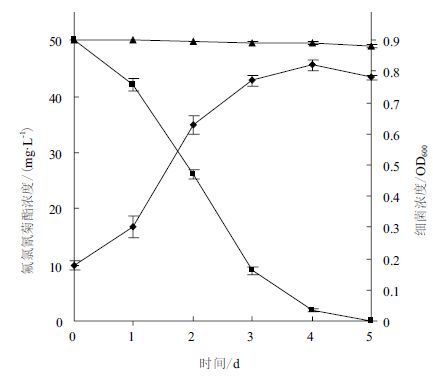
将YC-WZ5接种在以氟氯氰菊酯为唯一碳源的MSM液体培养基中连续培养的结果如图 8所示。菌株YC-WZ5能以氟氯氰菊酯为唯一碳源生长,在经过5 d培养后氟氯氰菊酯的降解率达到100%,并且氟氯氰菊酯降解的同时伴随着细菌生长量的增加。连续培养期间OD600的值从最初的0.21上升到最大值0.80,而后降至0.78。
|
| 图 8 菌株YC-WZ5的生长曲线和氟氯氰菊酯降解率 ■:氟氯氰菊酯的降解曲线;■:菌株生长曲线;▲对照 |
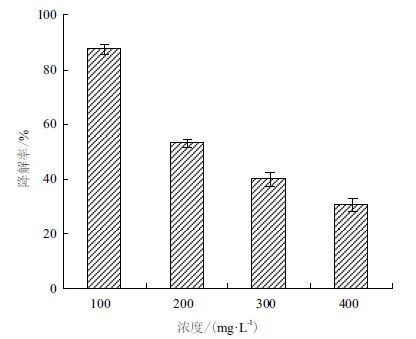
不同起始浓度条件下氟氯氰菊酯的降解率如图 9所示。当氟氯氰菊酯起始浓度为100、200、300和400 mg/L时,氟氯氰菊酯均可被菌株YC-WZ5所降解。但随着起始浓度的增加降解效率逐渐降低,连续培养5 d后的降解率分别为84.5%、54.7%、40%和30.5%。
|
| 图 9 菌株YC-WZ5对不同浓度氟氯氰菊酯的降解率 |
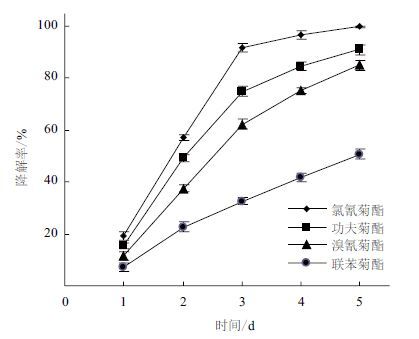
在分别含有50 mg/L的氯氰菊酯、功夫菊酯,溴氰菊酯和联苯菊酯的MSM液体培养基中以9.4%的接种量接入降解菌YC-WZ5,连续培养5 d。如图 10所示,4种菊酯类农药都有不同程度的降解。氯氰菊酯降解率为99.83%,功夫菊酯91.16%,溴氰菊酯84.98%,联苯菊酯55.76%。
|
| 图 10 不同菊酯农药的降解率 |
近些年来随着拟除虫菊酯类农药的大量使用,农残污染对人类健康产生重大威胁。大量研究表明,在长期受农药污染的污泥和水体中,微生物会发生进化而能降解周边的农药,以适应外界的环境压力。因此在长期受农药污染的土壤和废水中分离出相应的降解菌成为微生物环境修复的重要方法。
本研究在生产氟氯氢菊酯的农药厂排污口的污泥中,通过连续富集培养筛选得到一株氟氯氢菊酯高效降解菌YC-WZ5,经16S rDNA和生理生化检测确定其为中间苍白杆菌。菌株YC-WZ5能以氟氯氢菊酯为唯一碳源。由响应面法可知,当在30.9 ℃ ,pH为7.16,10.9%接种量的最佳降解条件下,菌株YC-WZ5可以将50 mg/L的氟氯氰菊酯在5 d内完全降解。同时该菌株在不同的pH条件下菌株同时也保持着相对较高的降解能力,说明其对土壤环境有较高的适应能力。
有报道表明,随着化学农药底物浓度的上升,菌株的降解反应会出现延迟来适应外界环境带来的压力[22]。菌株YC-WZ5在不同的氟氯氰菊酯起始浓度下均保持对氟氯氰菊酯的降解,并且没有出现降解的延迟。说明菌株YC-WZ5具有高效降解氟氯氰菊酯的能力,并且能够适应环境中的极端条件。在对氯氰菊酯、功夫菊酯、溴氰菊酯和联苯菊酯降解实验表明,菌株YC-WZ5具有对拟除虫菊酯广谱的降解能力。从实验结果中可以发现,氯氰菊酯、功夫菊酯和溴氰菊酯的降解明显高于联苯菊酯。这一降解能力差异是由于农药的不同空间结构造成的,氟氯氢菊酯、氯氰菊酯、功夫菊酯和溴氰菊酯的酯醇部分都具有相同的α-氰基-3-苯氧基苄基酯结构,而联苯菊酯的酯醇部分结构为2-甲基-3-苯基苄酯。由此可以推测,菌株YC-WZ5降解拟除虫菊酯能力的差异与菌体内降解酶活性中心的特定空间结构相关。根据以上推断,在接下来的研究中将对菌株的代谢产物和降解机理进行研究,并进一步克隆得到参与降解的相关基因。
大量研究表明,在长期污染环境中一些特定种类的细菌往往具有极强的环境适应能力,能够产生相应的酶用于降解环境中的有毒污染物,例如在芽孢杆菌属中枯草芽孢杆菌Bacillus subtilis Py4可以降解芘[23],巨大芽孢杆菌Bacillus megaterium Y20和坚强芽孢杆菌Bacillus firmus Y19以及蜡状芽孢杆菌Bacillus cereus Y22等组成的芽孢杆菌菌群可对池塘淤泥中有毒化学物质进行降解[24]。在假单胞菌属中报道的有降解尼古丁的恶臭假单胞菌Pseudomonas putida S16[25],酚降解菌恶臭假单胞菌Pseudomonas putida LY1[26],降解菲的铜绿假单胞菌Pseudomonas aeruginosa NY3[27],降解甲基对硫磷的施氏假单胞菌YC-YH1[28]等。苍白杆菌属的很多菌种也具有利用环境中的污染物作为碳源或氮源的能力,如降解尼古丁的苍白杆菌Ochrobactrum sp. DN2[29],降解草甘膦的苍白杆菌Ochrobactrum sp. G1[30],降解有机磷农药甲基对硫磷的苍白杆菌Ochrobactrum sp. B2[31]等。推测这些特定种类的细菌基因组中部分片段可能在有毒污染物的存在下容易发生遗传进化,从而产生适应有毒污染环境的突变。
4 结论本研究从农药厂的排污口周围的污泥中富集筛选出一株氟氯氰菊酯降解菌YC-WZ5。根据该菌株的生理生化特征和16S rDNA的遗传学分析,将其鉴定为中间苍白杆菌。菌株YC-WZ5以10%的接种量可在5 d内将50 mg/L的氟氯氰菊酯完全降解。经检测该菌株的最适降解条件为在pH为7.0的培养基中接种量10%,30 ℃ 摇床180 r/min。菌株YC-WZ5是一株具有较强的环境适应性,对氟氯氰菊酯残留具有高效降解能力的优势菌株。
| [1] | Hu GP, Zhao Y, Song FQ, et al. Isolation, identification and cyfluth-rin-degrading potential of a novel Lysinibacillus sphaericus strain, FLQ-11-1. Research in Microbiology , 2014, 165 : 110–118. DOI:10.1016/j.resmic.2013.11.003 |
| [2] | McCoy MR, Yang Z, Fu X, et al. Monitoring of total type II pyrethroid pesticides in citrus oils and water by converting to a common product 3-phenoxybenzoic acid. Journal of Agricultural and Food Chemistry , 2012, 60 (20) : 50–65. |
| [3] | Guvenc D, Aksoy A, Gacar A, et al. Evaluation of changes in monoamine levels and apoptosis induced by cyfluthrin in rats. Toxicology Research , 2015, 3 (5) : 331–340. |
| [4] | Yilmaz M, Rencuzogullari E, Canli M. The effects of cyfluthrin on some biomarkers in the liver and kidney of Wistar rats. Envir-onmental Science and Pollution Research , 2015, 22 : 4747–4752. DOI:10.1007/s11356-014-3734-6 |
| [5] | Soni I, Syed F, Bhatnagar P, Mathur R. Perinatal toxicity of cyfluthrin in mice: developmental and behavioral effects. Human and Experimental Toxicology , 2011, 30 : 1096–1105. DOI:10.1177/0960327110391386 |
| [6] | Chen SH, Dong YH, Chang CQ, et al. Characterization of a novel cyfluthrin-degrading bacterial strain Brevibacterium aureum and its biochemical degradation pathway. Bioresource Technology , 2013, 132 : 16–23. DOI:10.1016/j.biortech.2013.01.002 |
| [7] | Zhai Y, Li K, Song JL, et al. Molecular cloning, purification and biochemical characterization of a novel pyrethroid-hydrolyzing carboxylesterase gene from Ochrobactrum anthropi YZ-1. Journal of Hazardous Materials , 2012 : 221-222–206-212. |
| [8] | 胡桂琴, 宋凤琴, 尤民生, 等. 氟氯氰菊酯降解菌FLQ5的筛选鉴定及降解特性. 应用与环境生物学报 , 2013, 19 (6) : 851–856. |
| [9] | 张建云, 崔树军, 武秀琴, 等. 1株氟氯氰菊酯降解菌GZ-3的分离和鉴定. 安徽农业科学 , 2010, 38 (13) : 6635–6636. |
| [10] | Saikia N, Gopal M. Biodegradation of β-cyfluthrin by fungi. Journal of Agricultural and Food Chemistry , 2004, 52 (2) : 1220–1223. |
| [11] | Liang WQ, Wang ZY, Li H, et al. Purification and characterization of a novel pyrethroid hydrolase from Aspergillus niger ZD11. Journal of Agricultural and Food Chemistry , 2005, 53 (19) : 7415–7420. DOI:10.1021/jf051460k |
| [12] | Fan XJ, Liu XL, Huang R, et al. Identification and characterization of a novel thermostable pyrethroid-hydrolyzing enzyme isolated through metagenomic approach. Microbial Cell Factories , 2012, 11 : 33. DOI:10.1186/1475-2859-11-33 |
| [13] | 许育新, 戴青华, 李晓慧, 等. 氯氰菊酯降解菌株CDT3的分离鉴定及生理特性研究. 农业环境科学学报 , 2004, 23 (5) : 958–963. |
| [14] | 秦坤, 朱鲁生, 王金花. 氯氰菊酯降解真菌的筛选及其降解特性研究. 环境工程学报 , 2010, 4 (4) : 950–954. |
| [15] | George MG, Don JB, Noel RK, et al. Bergey’s manual of systematic bacteriology[M]. New York: Springer Publishing Press, 2001. |
| [16] | Sambrook J, Fritsch EF. Molecular cloning: A laboratory manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989. |
| [17] | Wang JH, Ren L, Jia Y, et al. Degradation characteristics and metabolic pathway of 4-nitrophenol by a halotolerant bacterium Arthrobacter sp. Toxicological and Environmental Chemistry , 2016, 98 (2) : 226–240. DOI:10.1080/02772248.2015.1115507 |
| [18] | 曲杰.氯氰菊酯降解菌的筛选鉴定及降解机理[D].北京: 中国农业科学院, 2011. |
| [19] | 刘艳, 范丽薇, 王晓萍. 氯嘧磺隆降解菌的分离鉴定及其降解特性. 微生物学通报 , 2010, 37 (8) : 1164–1168. |
| [20] | 陈少华, 罗建军, 肖盈, 等. 一株拟除虫菊酯农药降解菌的分离鉴定及其降解特性与途径. 环境科学学报 , 2011, 31 (8) : 1616–1625. |
| [21] | 李文, 彭香, 闫艳春, 等. 硫丹降解菌的筛选及降解性能研究. 山东农业科学 , 2009, 1 : 67–70. |
| [22] | Jilani S, Khan MA. Isolation, characterization and growth response of pesticides degrading bacteria. Journal of Biology Science , 2004, 4 (1) : 15–20. DOI:10.3923/jbs.2004.15.20 |
| [23] | 侯树宇, 张清敏, 余海晨, 等. 多环芳烃芘高效降解菌的筛选及其降解性能的研究. 南开大学学报: 自然科学版 , 2006, 39 (9) : 71–74. |
| [24] | 闫法军, 田相利, 王军, 等. 刺参养殖池塘降解有机污染物常、低温芽孢杆菌的分离筛选. 中国海洋大学学报 , 2013, 43 (6) : 17–24. |
| [25] | 唐鸿志.恶臭假单胞菌代谢尼古丁分子生物学研究[D].济南: 山东大学, 2008. |
| [26] | 李晶, 饶婷, 李巍, 等. 恶臭假单胞菌Pseudomonas putida LY1共代谢降解苯酚和4-氯苯酚系统的降解动力学研究. 环境科学学报 , 2011, 31 (10) : 2109–2116. |
| [27] | 沈小娟, 聂麦茜, 葛碧洲, 等. 铜绿假单胞菌降解菲的产物鉴定及代谢过程. 安全与环境学报 , 2012, 11 (2) : 62–65. |
| [28] | 史延华, 任磊, 闫艳春, 等. 施氏假单胞菌YC-YH1对甲基对硫磷的降解及其代谢产物检测. 农业环境科学学报 , 2015, 34 (11) : 2097–2104. |
| [29] | Yuan YJ, Lu ZX, Wu N. Isolation and preliminary characterization of a novel nicotine-degrading bacterium, Ochrobactrum intermedium DN2. International Biodeterioration & Biodegradation , 2005, 56 : 45–50. |
| [30] | 张静.草甘膦降解菌苍白杆菌G-1的分离鉴定及草甘膦氧化还原酶基因gox的克隆[D].南京: 南京农业大学, 2009. |
| [31] | 柏文琴, 李梅, 邱星辉, 等. 苍白杆菌B2对甲基对硫磷降解途径研究. 农药学学报 , 2004, 6 (4) : 48–54. |