西瓜枯萎病俗称死秧病、麦割病、萎凋病,是由尖孢镰刀菌西瓜专化型(Fusarium oxysporum f. sp. niveum)引起的一种毁灭性土传真菌病害,其病原在土壤中存活时间8-10年[1-3],在世界各西瓜产地均有发生。西瓜枯萎病最典型的症状是萎蔫,在整个生长期均可发生,以开花坐果期和果实膨大期发病最为严重,该病害一般可造成西瓜产量下降10%-40%,严重时可减产80%以上甚至绝收,给西瓜生产造成严重的经济损失[4]。另外,随着西瓜种植面积的逐年扩大,连作重茬导致病原基数升高,更加重了西瓜枯萎病的发生。因此,探究有效防治西瓜枯萎病的方法,已经成为当今西瓜生产上急需解决的问题。
针对西瓜枯萎病的防治,国内外已经做了大量研究,主要有嫁接换根、抗病育种、轮作、换土、化学药剂防治、物理防治、生物防治等多种策略[5-8]。但嫁接换根费时费力且影响西瓜品质,选育抗病品种周期长,轮作、换土方法由于土地资源有限不易实施,化学药剂防治效果不佳而且污染环境,影响健康。而利用植物根际生防菌进行生物防治既高效环保又经济、可持续,如今已经成为国内外学者研究的热点。
目前对西瓜枯萎病的筛选主要集中在生防细菌和真菌方面,已报道的有非致病镰刀菌(Pseudomo-nas spp.)、从枝菌根菌(Arbuscular Mycorrhize,AM)、芽孢杆菌(Bacillvs spp.)、荧光假单胞菌(Pseudomonas fluorescens)、哈茨木霉(Trichoderma harzianum)、绿色木霉(Trichoderma viride)[12-18],对利用放线菌防治西瓜枯萎病的研究报道较少。放线菌是一类极具重要价值的微生物,在自然界当中分布十分广泛,其产生代谢物质能力强,是抗生素的主要生物来源,是新医药、新农药和生物防治活菌剂的开发源头。目前的天然抗生素约有2/3是由放线菌产生的,其中70%以上由链霉菌产生[19-21]。在适合放线菌生长的各种生态环境中,土壤是放线菌的主要栖息地[22-24]。不同于以往从本植株根系土壤中和植株体内分离拮抗菌,本研究从种植不同种作物的大棚健康土壤中分离筛选具有较强拮抗性的放线菌菌株,使拮抗菌的来源更广,更易筛选出抑制西瓜枯萎病的高效生防菌,从而满足实际生产需求。
1 材料与方法 1.1 材料 1.1.1 供试土壤分离拮抗菌的土壤是从南京市浦口区连续多年种植辣椒的大棚土中采集健康植株的根际土壤,取离土表 10-15 cm的根际土,其理化性质主要参数为:pH6.8、有机质9.81 g/kg、速效磷0.09 g/kg、碱解氮0.16 g/kg、全N 0.70 g/kg、速效钾0.19 g/kg。用自封袋装好记号标记,保存于实验室4℃冰箱中备用。盆栽实验的土壤采集同一地区未种植西瓜的菜园土,其理化性质主要参数为:pH6.8、有机质13.65 g/kg、速效磷0.06 g/kg、碱解氮0.17 g/kg、全N 0.60 g/kg、速效钾0.15 g/kg。
1.1.2 供试作物西瓜品种为“农康瑞丰”,新疆农人种子科技有限公司培育的杂交一代,购于南京理想种苗有限公司。
1.1.3 供试病原菌菌株西瓜枯萎病菌尖孢镰刀菌(Fusarium oxysporum f. sp. niveum),由南京信息工程大学农业资源与环境实验室提供。木贼镰孢(Fusarium equiseti);茄根腐(Fusarium solani);甘蓝黑斑病菌(Alternaria brassicicola Wilts);小麦赤霉(Fusarium graminearum Sehw);大豆赤霉 (Fusarium roseum(Link)Snyder et Hansen、oxysporum Schlech);梨炭疽(Pear anthracnose);梨黑斑(Alternaria kikuchiana Tanaka);番茄早疫(Tomato Early Blig-ht);水稻恶苗(Gibberella fujikuroi),由南京农业大学植保院提供。
1.1.4 供试培养基及试剂马铃薯葡萄糖琼脂(PDA)培养基用于病原菌的培养和拮抗菌的筛选,参考方中达等[25]配制方法。高氏一号培养基用于放线菌的分离与纯化,参考袁丽红等[26]配制方法。LB培养基用于培养基因工程受体菌,参考沈萍等[27]配制方法。所用试剂均为分析纯。细菌总DNA提取试剂盒(E.A.N.A. Bacterial DNA kit),OMEGA公司;PCR产物纯化试剂盒(AxyPre PCR Cleanup kit),Axygen公司。
1.2 方法 1.2.1 菌株的分离与纯化称取10 g土样加入盛有90 mL无菌水的三角瓶(内含玻璃珠10粒左右),在28℃摇床上振荡20 min,静止后吸取土壤悬液稀释至10-4、10-5和10-6。取10-4、10-5和10-6稀释液0.1 mL均匀涂布于高氏一号平板上,每个梯度3次重复。倒置于28℃培养箱中培养3-7 d,挑选培养特征明显相异的单个菌落,采用分区划线法[27]于高氏一号培养基上进行纯化并编号,将反复纯化的菌株转移到斜面培养基上,于4℃保存备用。
1.2.2 拮抗菌株的筛选将西瓜枯萎病病原菌以及其他病原菌在PDA平板上活化。采用平板对峙培养法[25],用打孔器在菌落边缘打取病原菌菌块(直径为5 mm)。再接种到PDA平板中央,28℃培养2 d后,在距离病原菌菌块20 mm处用灭菌牙签点接拮抗菌,然后置于培养箱内28℃培养48 h后,观察拮抗圈并记录48-96 h抑菌圈的直径,试验重复3次。
1.2.3 拮抗菌株鉴定 1.2.3.1 形态学特征将有拮抗效果的放线菌接种到高氏一号培养基上28℃培养3-7 d,观察并记录菌落形态、个体形态及有无芽孢,同时镜检观察菌体形态和孢子的形成[28]。
1.2.3.2 生理生化鉴定将纯化好的拮抗菌进行硝酸盐还原反应、明胶液化、接触酶实验、淀粉水解、七叶灵水解反应、纤维素分解反应、吲哚反应、甲基红、接触酶、石蕊牛奶实验等生理生化测定[28]。
1.2.3.3 温度试验温度设定4℃、10℃、15℃、20℃、25℃、30℃、35℃和40℃,采用高氏一号培养基,在控温培养箱中培养7 d,观察菌落生长并测量菌落直径。
1.2.3.4 pH试验pH设定5.0、6.0、7.0、8.0、9.0、10.0和11.0,采用高氏一号培养基,在恒温培养箱中28℃培养7 d,观察菌落生长并测量菌落直径。
1.2.4 16SrDNA分子生物学鉴定以OMEGA细菌基因组DNA提取试剂盒提取拮抗放线菌的基因组DNA,并以细菌16S rDNA基因的通用引物通F(27F):5'-AGAGTTTGATCCTGGCTCAG-3',通用引物通R(1492r):5'-GGTTACCTTGTTACGACTT-3',PCR扩增放线菌菌株的16S rDNA基因。PCR反应体系为:正向引物F(27F)1 µL,反向引物R(1492r)1 µL,2×PCR mix 12.5 µL,DNA 1 µL,ddH2O 9.5 µL。PCR反应条件:94℃ 2 min;94℃ 30 s,52℃ 30 s,72℃ 1 min,31个循环;72℃ 10 min。将PCR产物经试剂盒纯化后,由上海美吉生物医药科技有限公司进行测序。将测得的序列结果在NCBI网站GenBank数据库中进行在线Blast比对,并选择同源性99%的序列用Mega3.0软件进行同源性比较,采用Bootstrap中的Neighbor-Joining法构建系统发育树。
1.2.5 盆栽抗病试验拮抗菌菌悬液和病原菌孢子悬液的制备:拮抗菌和西瓜尖孢镰刀菌分别接种于高氏一号培养基和PDA培养基,28℃、170 r/min振荡培养96 h,过滤离心收集菌体并用无菌水重悬。
拮抗菌防治西瓜枯萎病的盆栽试验:移栽5株2-3片真叶的西瓜苗于装有1 000 g土的盆钵中。试验设5种处理:(1)灭菌土壤(CK),(2)灭菌土壤+病原菌(CK1),(3)灭菌土壤+病原菌+放线菌(105 CFU/g),(4)灭菌土壤+病原菌+放线菌(106 CFU/g),(5)灭菌土壤+病原菌+放线菌(107 CFU/g),每个处理3次重复。按照试验设定将病原菌和拮抗放线菌分别接种于土壤中,西瓜枯萎病病原菌的接种量为105 CFU/g,拮抗放线菌的接种量分别为105 CFU/g、106 CFU/g、107 CFU/g。30 d时观察并记录西瓜的发病情况,并按照以下公式计算死亡率、发病指数及防治效率[29],数据采用Excel 2010和SPSS 19.0统计分析软件进行分析。
死亡率=(处理死亡株数/处理总株数)× 100%;
病情指数=[∑(各级病株数×相应级数)/(调查总植株数×最高级数)]× 100;
防治效果=[(对照区病情指数-处理区病情指数)/对照区病情指数]× 100%;
病害严重程度分级标准:0级:无病状;Ⅰ级:1/4叶片发病;Ⅱ级:1/2叶片发病;Ⅲ级:整株死亡。
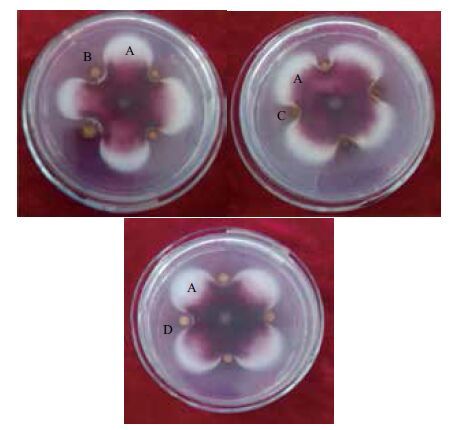
2 结果 2.1 拮抗放线菌菌株的筛选从连作辣椒的根际土壤中分离纯化出32株对西瓜枯萎病有潜在拮抗作用的放线菌。通过平板对峙实验初筛选出10株具有抑菌作用的菌株,其抑菌效果见表 1,其中F22、F23和F32对西瓜尖孢镰刀菌的抑制效果最明显,抑圈带宽达到1.70、1.17和1.47 cm(图 1和图 2)。
|
| 图 1 拮抗菌株与病原菌对峙结果 A:尖孢镰刀菌Fusarium oxysporum f. sp. niveum;B:菌株F22;C:菌株F23;D:菌株F32 |

|
| 图 2 拮抗菌株平板对峙抑菌效果 注:不同的大写字母表示差异极显著(P<0.01) |
将菌株F22、F23、F32对10株病原菌进行抗菌谱测定。图 3综合分析结果表明,菌株F32具有较强的抑菌作用,对这10株病原菌均有抑制作用,抑菌带宽在0.5 cm以上;其中对甘蓝黑斑菌、水稻恶苗菌和番茄早疫的拮抗作用更为显著。表明菌株F32有比较广的抗菌谱。

|
| 图 3 不同菌株对植物病原真菌的拮抗作用 1:西瓜枯萎病菌(Fusarium oxysporum f. sp. Niveum);2:木贼镰孢(Fusarium equiseti);3:茄根腐(Fusarium solani);4:甘蓝黑斑病菌(Alternaria brassicicola Wilts);5:小麦赤霉(FusaHum graminearum Sehw);6:大豆赤霉 (Fusarium roseum(Link)Snyder et Hansen、oxysporum Schlech);7:梨炭疽(Pear anthracnose);8:梨黑斑(Alternaria kikuchiana Tanaka);9:番茄早疫(Tomato Early Blight);10:水稻恶苗(Gibberella fujikuroi)。不同的小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01) |
形态学鉴定显示,F32菌株在高氏一号培养基上28℃培养7 d后,其菌落扁平呈圆形、小而致密、表面干燥不透明、边缘整齐、呈灰色。经显微镜观察发现,该菌孢子丝直或柔曲,孢子卵圆形至长圆形。
生理生化鉴定结果(表 2)显示,F32菌株可在15-40℃环境下生长,存活pH值5-12。在生长过程中可利用多种碳源,可产生淀粉水解酶、凝乳酶、硝酸还原酶,不能产生纤维素酶、接触酶。
以菌株F32的总基因组DNA为模板,进行PCR扩增;扩增产物经1%琼脂糖凝胶电泳检测(图 4)显示,F32菌株纯化产物DNA扩增片段大小为1 433 bp。将测序结果输入NCBI网站GenBank数据库进行在线Blast同源性检索,绘制系统发育树,结果(图 5)显示菌株F32 与Streptomyces sp. GSENDO-0569的相似性达到99%。因此,初步鉴定放线菌F32菌株为链霉菌属Streptomyces sp.。

|
| 图 4 F32菌株的PCR产物电泳图 M:λ-Hind Ⅲ digest maker;1:菌株F32;2:菌株F23;3:菌株F22 |

|
| 图 5 基于F32菌株与链霉菌属相关菌株16S rDNA序列建立的系统发育树 |
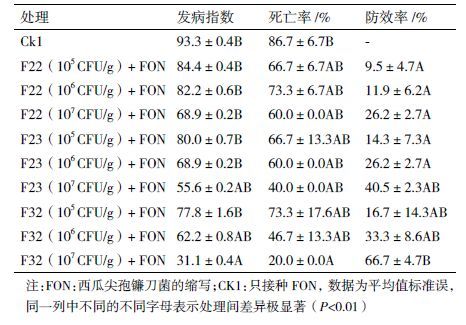
在盆栽试验中,各处理西瓜植株的发病情况如表 3所示。结果表明,CK1(只接病原菌)30 d后严重发病且80%以上的植株死亡;而接种拮抗菌F22、F23、F32的处理植株死亡率要低于CK1(只接病原菌)。
在相同浓度下接种3种不同拮抗放线菌,其中拮抗菌株F32的防效率最高,拮抗菌株F23的防效率次之,拮抗菌株F22的防效率最低。在不同浓度下接种同一拮抗放线菌的处理中,3种不同拮抗放线菌都是在107 cfu/g浓度下对西瓜枯萎病的处理效果最好,其中菌株F32的防治作用最佳,防效率达到66.7%。由此说明菌株F32对西瓜枯萎病的发生有较好的防治作用。
3 讨论西瓜枯萎病为一种严重危害西瓜生产的土传病害,由于土壤的特殊复杂性,西瓜枯萎病的生物防治工作相对缓慢。目前在西瓜枯萎病拮抗菌筛选方面的相关报道,主要是通过从患病植株根系土壤或者患病植株内获得,如岳菊等[30]从西瓜根际土壤中筛选枯草芽孢杆菌Bacillus subtilis NBT-15和铜绿假单胞菌Pseudomonas aeruginosa PL-82对西瓜枯萎病有抑制作用;马艳等[31]从西瓜植株分离出内生拮抗芽孢杆菌BS211对西瓜枯萎病有显著防效。菌种来源单一,且主要集中在拮抗细菌和真菌方面。因此,拓宽拮抗菌的来源,获得高效的拮抗菌,将成为西瓜枯萎病拮抗菌株筛选的一个方向。
本研究从连续种植多年辣椒的大棚土中,分离筛选出能较好抑制西瓜枯萎病病原菌的放线菌F32,不但菌种来源不同,而且对除西瓜枯萎病病原菌外的其他病原菌也有较好的抑制作用。经表型特征、生理生化特性以及16S rDNA分子生物学鉴定,初步确定菌株F32为链霉菌(Streptomyces sp.)。放线菌广泛分布于自然界中,种类繁多,代谢功能各异,是具有巨大实用价值的一类微生物。其中链霉菌是具有生物防治效果的一类重要的生防菌,同时也是放线菌中产抗生素最多的一个属。国内外也有不少该菌属的相关报道,如抗真菌的利迪霉素以及抗细菌的利迪菌素、放线噻唑酸、因子C等[32];赵丽明等[33]从西瓜根际分离出灰色链霉菌、淡紫灰链霉菌、脱叶链霉菌对西瓜枯萎病有良好的抑制作用;张月谷[34]从拮抗放线菌菌株CT205的发酵液中提取出的抗菌粗提物对西瓜枯萎病有一定的抑制作用;周永强[35]研究表明接种放线菌活菌剂对西瓜根域微生物区系有显著影响。本试验筛选出的菌株F32在抑制西瓜尖孢镰刀菌的平板对峙试验和盆钵试验中均取得良好效果,其能存活的温度和pH值范围广,且抗菌谱性广,不仅可以应用于西瓜枯萎病的生物防治研究中,也可以考虑将其应用于其他植物病害的生物防治研究以及实际生产中。在此基础上,我们将进一步研究拮抗菌与有机肥最佳配比的生物有机肥料在盆钵试验的拮抗效果以及应用于大田试验中的防治效果;研究拮抗放线菌在不同土壤以及生态条件下的作用效果以及拮抗放线菌产生抗菌物质的分析,从而提高拮抗放线菌活菌剂的抗病效果和稳定性。研究更加接近农业生产的实际情况,且具有广阔开发应用前景的生防菌活菌剂。
4 结论本研究从连作辣椒根际土中分离了32株放线菌,从中筛选出10株对西瓜枯萎病具有拮抗作用的放线菌,其中抑制作用较强的菌株F32鉴定为链霉菌(Streptomyces sp.)。抗菌谱测定结果表明,该菌的抗菌谱性广。盆栽试验结果表明,该菌对西瓜枯萎病的防治效果最佳。
| [1] | Miguel A, Maroto JV, San BA, et al. The grafting of triploid watermelon is an advantageous alternative to soil fumigation by methyl bromide for control of Fusarium wilt. Scientia Horticulturae , 2004, 10 (3) : 9–17. |
| [2] | 吴学宏, 卢志军, 王品品, 等. 西瓜枯萎病综合防治研究进展. 植物保护 , 2011, 37 (4) : 27–32. |
| [3] | Dau VT, Dang NV, Nguyen DH, et al. Asimplified technique for grafting watermelon onto resistant cucurbit rootstocks for control of Fusarium wilt of watermelon in Nghe An Province, Vietnam. Australasian Plant Disease Notes , 2009, 4 (1) : 114–116. |
| [4] | 李小卫. 西瓜枯萎病的综合防治技术. 现代农业科技 , 2011, 1 (12) : 162–164. |
| [5] | 韩金星, 洪日新, 周林, 等. 西瓜、黄瓜、甜瓜等瓜类枯萎病研究进展. 中国瓜菜 , 2009, 22 (2) : 32–35. |
| [6] | 许田芬, 李凌, 谢立群, 等. 西瓜枯萎病的研究进展. 南方农业 , 2007, 1 (5) : 88–90. |
| [7] | 张屹, 魏林, 许勇, 等. 西瓜枯萎病的研究进展. 湖南农业科学 , 2013, 4 (5) : 67–70. |
| [8] | 吕湘江, 李清萍, 范淑英. 西瓜枯萎病综合防治研究进展. 北方园艺 , 2015, 4 (6) : 187–190. |
| [9] | 李敏, 刘润进, 李晓林, 等. 大田条件下丛枝菌根真菌对西瓜生长和枯萎病的影响. 植物病理学报 , 2004, 34 (5) : 472–473. |
| [10] | 马利平, 乔雄梧, 高芬, 等. 防病促生枯萎病拮抗菌“98-I”对4种枯萎病防治效果研究. 中国生态农业学报 , 2005, 30 (1) : 91–94. |
| [11] | 林纬, 黎起秦, 彭好文, 等. 拮抗菌防治西瓜枯萎病的试验. 广西农业生物科学 , 2002, 21 (4) : 242–244. |
| [12] | 黎起秦, 陈永宁, 林纬, 等. 西瓜枯萎病生防细菌的筛选. 广西农业生物科学 , 2000, 19 (2) : 81–84. |
| [13] | 葛慈斌, 刘波, 朱育菁, 等. 生防菌NH-BS2000对西瓜枯萎病原菌抑制作用的研究. 厦门大学学报 , 2004, 43 (8) : 86–901. |
| [14] | 宗兆锋, 钮绪燕, 李君彦, 等. 西瓜枯萎病拮抗菌的筛选研究. 西北农业大学学报 , 1995, 23 (2) : 60–64. |
| [15] | 赵国其, 林福呈, 陈卫良, 等. 绿色木霉对西瓜枯萎病苗期的控制作用. 浙江农业科学 , 1998, 10 (4) : 206–209. |
| [16] | Anderson AS, Wellington EM. The taxonomy of streptomyces and related genera. International Journal of Systematic & Evolutionary Microbiology , 2001, 51 (Pt3) : 797–814. |
| [17] | 韩立荣, 赵科刚, 顾彪, 等. 5株放线菌对9种靶标病原真菌的持续抑菌作用. 西北农林科技大学学报: 自然科学版 , 2006, 34 (2) : 53–56. |
| [18] | 纪明山, 王英姿, 程根武, 等. 西瓜枯萎病拮抗菌株筛选及田间防效试. 中国生物防治 , 2002, 18 (2) : 71–74. |
| [19] | 黄路枝, 胡兆农, 郭正彦, 等. 土壤稀有放线菌的选择性分离及其抗菌活性研究. 农药学学报 , 2007, 9 (1) : 59–65. |
| [20] | 王振跃, 刘延红, 高书锋, 等. 黄瓜叶围放线菌的分离及其对灰霉菌抑菌效果测定. 河南农业科学 , 2007, 3 (11) : 78–80. |
| [21] | 刘姝, 陆兆新, 吕凤霞, 等. 一株海洋放线菌的分类鉴定及抗菌活性研究. 南京农业大学学报 , 2007, 30 (4) : 124–129. |
| [22] | Watve MG, Tickoo R, Jog MM, e t, a l. How many antibiotics are produced by the genus Streptomyces?. Archives of Microbiology , 2001, 176 (5) : 386–390. DOI:10.1007/s002030100345 |
| [23] | 司美茹, 薛泉宏, 余博, 等. 36株生防菌对辣椒疫病等4种病原真菌的拮抗作用研究. 西北农林科技大学学报: 自然科学版 , 2005, 33 (1) : 49–54. |
| [24] | 蔡艳, 薛泉宏, 陈占全, 等. 青海高原东部土壤辣椒疫霉生防菌的初步筛选. 西北农业学报 , 2007, 16 (2) : 241–244. |
| [25] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998. |
| [26] | 袁丽红. 微生物学实验[M]. 北京: 化学工业出版社, 2010. |
| [27] | 沈萍, 范秀荣, 李广武. 微生物学实验[M]. 北京: 高等教育出版社, 1999. |
| [28] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001 : 62-387. |
| [29] | 江欢欢, 程凯, 杨兴明, 等. 辣椒青枯病拮抗菌的筛选及其生物防治效应. 土壤学报 , 2010, 47 (6) : 1225–1231. |
| [30] | 岳菊, 刘邮洲, 张荣胜, 等. 西瓜枯萎菌拮抗细菌的筛选、鉴定及防效测定. 中国生物防治学报 , 2011, 27 (3) : 428–432. |
| [31] | 马艳, 赵江涛, 常志州, 等. 西瓜内生枯草芽孢杆菌BS211的拮抗活性及盆栽防效. 江苏农业学报 , 2006, 22 (4) : 388–393. |
| [32] | 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984. |
| [33] | 赵丽明, 丁延芹, 路晓萌, 等. 西瓜根际枯萎病拮抗放线菌的筛选及鉴定. 生物技术通报 , 2010 (5) : 107–110. |
| [34] | 张月谷. 拮抗放线菌CT205对土传西瓜枯萎病的防控效益及活性成分分析[D]. 南京: 南京农业大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10307-1014219473.htm |
| [35] | 周永强. 西瓜枯萎病生防放线菌筛选及其防病促生作用研究[D]. 杨陵: 西北农林科技大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10712-2008102784.htm |