小桐子(Jatropha curcas L.)又名小油桐、麻疯树等,是大戟科麻疯树属重要的能源植物,原产美洲,现广布于世界热带地区,在中国主要分布于云南、四川、海南等地[1, 2]。小桐子种子含油率35%-50%,最高可达60%以上,是一种理想的绿色石油替代能源植物。此外,小桐子可全株开发,其叶、茎、果均可入药,种壳可作为高档活性炭的原材料,它也是退耕还林和绿化荒山的先锋树种[2, 3]。作为热带起源植物,小桐子耐热喜温,因此低温严重影响小桐子的存活和生长[4-7]。
低温会改变植物细胞膜的结构与组分,破坏其稳定性,导致电解质外渗,丙二醛(MDA)含量升高,功能受损,膜透性增加[8, 9]。低温还会造成细胞失水,同时诱导植物产生相应的渗透调节物质以适应逆境胁迫[10]。在众多代谢物中,甘氨酸甜菜碱(Glycine betaine,GB)是一种有特殊功效的代谢相容性物质,是最常见的渗透调节剂之一[6, 11]。植物体内甜菜碱的合成途径相对简单,主要包含两步氧化反应,催化第一步反应的酶是胆碱单加氧酶(Choline monooxygenase,CMO),催化第二步反应的酶是甜菜碱醛脱氢酶(Betaine aldehyde dehydrogena-se,BADH)[12]。BADH被认为是高等植物中甜菜碱生物合成的关键限速酶,受到了广泛关注[13]。
脱落酸(Abscisic acid,ABA)参与了逆境胁迫下甜菜碱积累的调控过程[14-16]。Gao等[15]研究发现,外源ABA能够增加干旱胁迫下梨树叶片中的甜菜碱含量,并上调BADH的活性。在一些植物中也有证据表明,ABA可诱导BADH基因的表达,促进甜菜碱的积累,从而增强了植物的抗逆性[14-16]。然而,ABA促进低温胁迫下小桐子幼苗甜菜碱积累和增强其耐冷性的机制还不清楚。
迄今为止,BADH基因已从拟南芥、甜菜、水稻、小麦、豌豆等草本植物中得到分离和鉴定,而木本植物的研究报道较少。本研究采用外源ABA处理低温胁迫下的小桐子,研究ABA对低温胁迫下小桐子幼苗耐冷性以及甜菜碱含量、BADH酶活性和JcBA-DH基因表达的影响,试图初步阐明低温胁迫下AB-A诱发小桐子幼苗甜菜碱积累的机理,旨为进一步阐明ABA诱发小桐子耐冷性形成的机理提供借鉴。
1 材料与方法 1.1 材料小桐子(Jatropha curcas L.)采收于云南省元谋县,以1.5%(W/V)的硫酸铜溶液消毒30 min,浸种24 h后,播种在垫有7层湿滤纸的白磁盘中。25℃下暗萌发7 d后,将萌发均匀的种子置于1/2 Hogland营养液中、于温周期25℃/20℃(昼/夜)、光周期16 h(光照强度300 μmol/m2·s)、相对湿度为75%的人工气候箱中砂培生长14 d[2]。
1.2 方法 1.2.1 低温胁迫及ABA处理将上述培养21 d长势较一致的小桐子幼苗(幼苗高约10 cm)分别置于含不同浓度(0、50、100、150、200、300和500 μmol/L)ABA的1/2 Hogland营养液中,在16 h(光照强度300 μmol/m2·s)、75%相对湿度的人工气候箱中低温(2℃)胁迫4 d,对照幼苗于25℃下继续培养,之后测定相关指标,每个处理200株。
1.2.2 测定方法 1.2.2.1 存活率测定将上述低温处理过的小桐子幼苗取出后,于1/2 Hogland营养液、25℃/20℃(昼/夜)、16 h 光照(光照强度300 μmol/m2·s)、75%相对湿度的人工气候箱中恢复培养10 d,然后计算存活率。在恢复期间能够恢复生长并转绿的小桐子幼苗被视为存活幼苗。
1.2.2.2 电解质渗漏率、丙二醛(MDA)含量和根系活力的测定电解质渗漏率检测参照Yang等[17]的相对电导率法。取1 cm长的小桐子幼苗根尖0.2 g,用蒸馏水漂洗3次,再用洁净滤纸吸干表面水分。加入10 mL蒸馏水,真空渗入,在25℃下浸提3 h后,用DDSL-308电导仪测定第1次电导度(S1)。将材料置于100℃沸水浴中加热15 min,使植物组织死亡,冷却至25℃,测定第2次电导度(S2)。根据公式计算出相对电导度:L=S1/S2,用百分比表示。
膜脂过氧化产物MDA含量的测定按照王莎莎等[18]的硫代巴比妥酸法进行,以μmol/g(dry weight,DW)表示。根系活力的测定参照张志勇等[19]的TTC法进行。准确称取0.2 g小桐子幼苗叶片,在黑暗、30℃条件下,将其充分浸泡于0.6%(W/V)TTC溶液(TTC溶液在pH7.0的磷酸缓冲液配制)中染色24 h。用去离子水将染色后的根系冲洗干净并用滤纸吸干,直接将根系浸泡在5 mL 95%乙醇中,并于85℃水浴条件下放置20 min,待提取液冷却后于485 nm下测定吸光值。
1.2.2.3 甜菜碱含量和BADH酶活性的测定甜菜碱含量的测定参照许锁链等[20]的方法进行。准确称取0.2 g小桐子幼苗叶片,加5 mL蒸馏水充分研磨后于摇床上浸提24 h,之后浸提液于20℃、10 000 g/min下离心20 min,上清液用0.045 μm滤膜过滤2次,即得样品液。取样品液3 mL,加入5 mL 3%的饱和雷氏盐溶液中,4℃冰箱中保存5 h后取出,10 000 g/min离心15 min,弃上清,用乙醚洗涤沉淀2次,再用3 mL 70%丙酮溶解沉淀,立即在525 nm波长处测定吸光度,根据标准曲线计算甜菜碱含量。
BADH酶的活性检测按照我们之前的方法进行[17]。准确称取0.2 g小桐子叶片,液氮下迅速研成粉末,加入10 mL 酶提取缓冲溶液(100 mmol/L Tricine-KOH,pH8.5,2 mmol/L EDTA,2 mmol/L DTT,0.6 mol/L蔗糖)研磨成匀浆,以10 000 g/min离心10 min,所得上清液再重复离心2次,收集上清液,加入饱和度至55%的(NH4)2SO4,得到的沉淀用1.5 mL酶悬浮缓冲液(10 mmol/L Tris-HCl,pH7.8,1 mmol/L DTT,10%甘油)溶解,并在该缓冲液中透析除去硫酸铵即得酶粗提液。然后在1 mL 反应体系中,加入0.95 mL反应缓冲液(100 mmol/L Tris-HCl,pH8.0,0.5 mmol/L NAD+,5 mmol/L DTT),再加入0.05 mL酶溶液,在30℃反应30 min。于340 nm处测定吸光度并计算酶活性,以每分钟NADH生成量表示。
1.2.2.4 RNA提取和RT-qPCR总RNA提取采用TaKaRa公司的RNAiso for Polysaccharide-rich Plant Tissue试剂盒。JcBADH基因的表达采用ABI 7500 Fast Real-Time PCR实时荧光定量PCR仪检测,以小桐子Actin基因为内参(引物序列见表 1)。RT-qPCR的操作按照TaKaRa公司的One Step SYBR® PrimeScriptTM RT-PCR Kit II试剂盒说明书进行。采用2-ΔΔCT法对目标基因进行相对定量的差异表达分析[21]。
所有实验数据至少来源于3次独立实验的结果,每次独立实验有3个平行重复。实验数据采用SPSS13.0进行方差分析。统计结果用Sigmaplot 10.0作图,图中数据均为x±s。
2 结果 2.1 ABA对低温胁迫下小桐子幼苗耐冷性的影响前期的研究结果(表 2)表明,50-300 μmol/L的ABA处理4 d均可不同程度提高低温(2℃)胁迫下小桐子幼苗的存活率和根系活力,降低其电解质渗漏率和MDA含量,其中以150 μmol/L ABA溶液的处理效果较好。因此,在后续的实验中利用150 μmol/L ABA溶液处理小桐子幼苗,研究了ABA对小桐子幼苗耐冷性的影响。结果(图 1)显示,随着低温(2℃)胁迫时间的延长,小桐子幼苗存活率呈逐渐下降趋势,与对照相比,低温胁迫4 d可使小桐子幼苗的存活率下降19.9%(P<0.01);而经150 μmol/L ABA处理的小桐子幼苗与对照相比存活率仅下降10.0%(P<0.05),说明ABA能显著提高低温胁迫下小桐子幼苗的存活率。

|
| 图 1 ABA对低温胁迫下小桐子幼苗存活率的影响 |
图 2为150 μmol/L ABA处理4 d对小桐子幼苗叶片电解质渗漏率的影响。由此可知,低温胁迫下小桐子幼苗的电解质渗漏率呈逐渐上升趋势,与对照相比,低温胁迫4 d可使小桐子幼苗的电解质渗漏率上升1.98倍(P<0.01);而用150 μmol/L ABA处理能显著降低低温胁迫下小桐子幼苗的电解质渗漏率(P<0.05),表明外源ABA可缓解低温胁迫下小桐子幼苗的电解质渗漏。

|
| 图 2 ABA对低温胁迫下小桐子幼苗叶片电解质渗漏率的影响 |
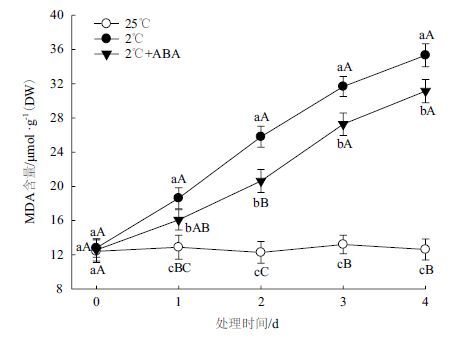
由图 3可知,2℃低温胁迫能诱发小桐子幼苗叶片MDA的大量积累,4 d内小桐子幼苗的MDA含量上升了1.68倍,而150 μmol/L ABA处理1-4 d 均可明显减缓低温胁迫下小桐子幼苗MDA的积累(P<0.05)。表明外源ABA能够减轻低温胁迫下小桐子幼苗的膜受伤程度。
|
| 图 3 ABA对低温胁迫下小桐子幼苗叶片MDA含量的影响 |

|
| 图 4 ABA对低温胁迫下小桐子幼苗根系活力的影响 |
图 4显示,2℃低温胁迫能大幅降低小桐子幼苗的根系活力,4 d内小桐子幼苗的根系活力下降了36.6%(P<0.01)。但是,150 μmol/L ABA处理2-4 d 显著减缓了低温胁迫下小桐子幼苗根系活力的下降(P<0.05)。
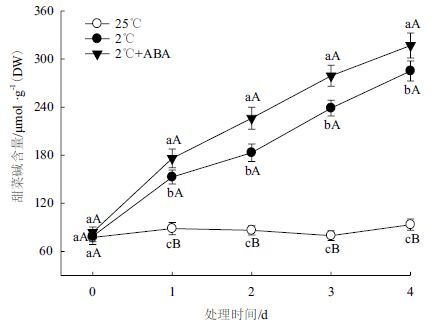
2.2 ABA对低温胁迫下小桐子幼苗甜菜碱积累的影响图 5为150 μmol/L ABA处理4 d对小桐子幼苗甜菜碱含量变化的影响,结果显示,低温胁迫下小桐子幼苗的甜菜碱含量呈逐渐上升趋势,与对照相比,低温胁迫4 d可使小桐子幼苗的甜菜碱含量上升2.61倍(P<0.01);而 ABA处理能显著增加低温胁迫下小桐子幼苗甜菜碱的积累,尤其在处理的第2天(P<0.01),表明外源ABA可促进低温胁迫下小桐子幼苗甜菜碱的积累。
|
| 图 5 ABA对低温胁迫下小桐子幼苗甜菜碱含量的影响 |
图 6表明,2℃低温胁迫能大幅上调BADH的活性,4 d内小桐子幼苗的BADH活性上升了1.64倍,150 μmol/L ABA处理可进一步上调低温胁迫下BADH的活性。这表明外源ABA处理可提高低温胁迫下小桐子幼苗的BADH活性。

|
| 图 6 ABA对低温胁迫下小桐子幼苗BADH活性的影响 |
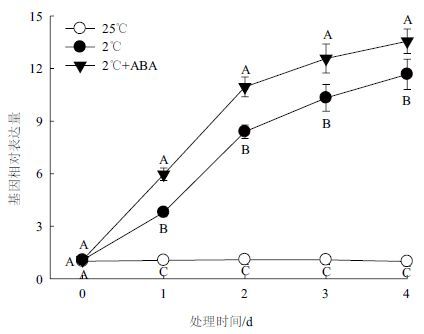
图 7为150 μmol/L ABA处理4 d对小桐子幼苗JcBADH基因表达的影响,结果显示,低温胁迫可大幅上调小桐子JcBADH基因的表达水平,与25℃培养的幼苗相比,经2℃胁迫4 d的小桐子幼苗JcBADH的表达上调了约9.94倍。150 μmol/L ABA处理可进一步上调低温胁迫下JcBADH的表达水平,表明ABA可活化低温胁迫下小桐子幼苗JcBADH基因的表达。
|
| 图 7 ABA对低温胁迫下小桐子幼苗JcBADH基因表达的影响 |
脱落酸(ABA)是一种非常重要的植物内源激素,除了参与植物的生长发育调控之外,还在植物响应高盐、干旱、低温等逆境胁迫反应中起重要作用[22-24]。许多研究表明,低温胁迫下ABA 可通过增加渗透调节物质脯氨酸、甜菜碱和可溶性糖等的含量,及提高超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶的活性来增强植物的耐冷性[22, 25]。然而,到目前为止,ABA提高植物耐冷性的机制还不完全清楚。本研究结果表明,外源ABA处理可显著提高低温胁迫下小桐子幼苗的存活率和根系活力,降低电解质渗漏率和MDA含量,表明ABA可有效提高小桐子幼苗的耐冷性。此外,低温胁迫下ABA也诱发了小桐子幼苗体内甜菜碱的大量积累。Kumar等[26]研究发现,外源甜菜碱可显著提高茶叶在低温胁迫下的抗氧化能力;Zhang等[22]报道,小麦体内高浓度的甜菜碱有助于增强其对低温的耐受性。鉴于甜菜碱在植物抗逆性形成中的重要作用,我们认为ABA诱发的小桐子幼苗耐冷性的提高可能与甜菜碱的积累密切相关。
研究表明,干旱、盐胁迫和低温均可诱发植物体内甜菜碱的积累,而大量甜菜碱的积累可有效应对干旱、盐、温度等胁迫带来的不利影响[27-29]。低温胁迫下,植物体内高浓度的甜菜碱可起到保护质膜和增强抗氧化能力的作用[6, 22]。然而,低温诱发植物体内甜菜碱积累的报道还很少,也不清楚其具体调节机理。本研究结果显示,低温胁迫可促进小桐子幼苗体内的甜菜碱积累,且这种积累作用是低温胁迫上调了甜菜碱合成关键酶BADH活性和JcBADH基因表达水平的结果。
某些物质,如ABA、Ca2+和硫化氢(hydrogen sulfide,H2S)等信号分子均可诱发植物体内甜菜碱的积累[15, 30, 31],暗示着甜菜碱的积累受到诸多因素的调控和涉及较复杂的信号转导过程。ABA是公认的植物感应逆境胁迫的信号分子,作为重要的胁迫激素在感受温度胁迫信号、提高植物的抗冷性中起着重要作用[2, 16]。
已有研究显示,ABA可提高干旱胁迫下植物体内的甜菜碱水平,并上调BADH的活性[15]。宋志辉等[32]研究发现,水分胁迫下梨树叶片中甜菜碱水平是随内源ABA水平的升高而升高,这为ABA介导干旱胁迫原初物理信号、启动细胞内甜菜碱的生物合成与积累提供了又一明确的证据。Kumar等[33]曾报道,高温胁迫下,ABA可通过促进甜菜碱、脯氨酸等渗透调节物质的积累提高鹰嘴豆的耐热性。然而,到目前为止,人们对低温胁迫下ABA与甜菜碱代谢之间的关系还知之甚少。本研究结果显示,150 μmol/L的ABA可显著提高低温胁迫下小桐子幼苗的甜菜碱含量,上调甜菜碱合成关键酶BADH的活性和JcBADH基因的表达水平。这些结果表明,ABA参与了低温胁迫下小桐子幼苗甜菜碱积累的调控过程,且ABA可通过活化甜菜碱合成的第二步反应来促进低温胁迫下小桐子幼苗甜菜碱的积累。
4 结论外源ABA处理可显著提高低温胁迫下小桐子幼苗的耐冷性及甜菜碱的含量,上调BADH的活性和JcBADH基因的表达水平。鉴于甜菜碱在植物抗逆性中的重要作用,ABA诱发的小桐子幼苗耐冷性增强很可能与甜菜碱积累密切相关。
| [1] | 陈杨玲, 王海波, 陈凯, 等. 能源植物小桐子抗逆性研究进展. 中国农学通报 , 2013, 29 (10) : 1–6. |
| [2] | 邓凤飞, 杨双龙, 龚明. ABA对低温胁迫下小桐子幼苗脯氨酸积累及其代谢途径的影响. 植物生理学报 , 2015, 51 (2) : 221–226. |
| [3] | Openshaw K. A review of Jatropha curcas L.: an oil plant of unfulfilled promise. Biomass Bioenerg , 2000, 19 : 1–5. DOI:10.1016/S0961-9534(00)00019-2 |
| [4] | Maes WH, Trabucco A, Achten WMJ, et al. Climatic growing conditions of Jatropha curcas L.. Biom Bioener , 2009, 33 : 1481–1485. DOI:10.1016/j.biombioe.2009.06.001 |
| [5] | Ao PX, Li ZG, Fan DM, et al. Involvement of antioxidant defense system in chill hardening-induced chilling tolerance in Jatropha curcas seedlings. Acta Physiol Plant , 2013, 35 : 153–160. DOI:10.1007/s11738-012-1058-z |
| [6] | Ao PX, Li ZG, Gong M. Involvement of compatible solutes in chill Hardening-induced chilling tolerance in Jatropha curcas seedlings. Acta Physiol Plant , 2013, 35 : 3457–3464. DOI:10.1007/s11738-013-1381-z |
| [7] | Wang HB, Zou ZR, Gong M, et al. Global analysis of transcriptome responses and gene expression profiles to cold stress of Jatropha curcas L.. PLoS One , 2013, 8 (12) : e82817. DOI:10.1371/journal.pone.0082817 |
| [8] | Yadav SK. Cold stress tolerance mechanisms in plants. Agron Sustain Dev , 2010, 30 : 515–527. DOI:10.1051/agro/2009050 |
| [9] | 王连臻, 杜小凤, 吴传万, 等. 应用二次回归正交旋转组合法进行小麦抗低温胁迫复配植物生长调节剂研发. 中国农学通报 , 2015, 31 (9) : 63–67. |
| [10] | Thakura P, Kumara S, Malika JA, et al. Cold stress effects on reproductive development in grain crops: An overview. Environ Exp Bot , 2010, 67 : 429–443. DOI:10.1016/j.envexpbot.2009.09.004 |
| [11] | Robinson SP, Jones GP. Accumulation of glycinebetaine in chloroplast provides osmotic adjustment during salt stress. Aust J Plant Physiol , 1986, 13 : 659–668. DOI:10.1071/PP9860659 |
| [12] | Moghaieb REA, Saneoka H, Fujita K. Effect of salinity on osmotic adjustment, glycine-betaine accumulation and the betaine aldehyde dehydrogenase gene expression in two halophytic plants, Salicornia europaea and Suaeda maritime. Plant Sci , 2004, 166 : 1345–1349. DOI:10.1016/j.plantsci.2004.01.016 |
| [13] | Fan W, Zhang M, Zhang H, et al. Improved tolerance to various abiotic stresses in transgenic sweet potato(Ipomoea batatas)expressing spinach betaine aldehyde dehydrogenase. PLoS One , 2012, 7 (5) : e37344. DOI:10.1371/journal.pone.0037344 |
| [14] | Legaria J, Rajsbaum R, Munoz-Clares RA, et al. Molecular characterization of two genes encoding betaine aldehyde dehydrogenase from amaranth. Gene , 1998, 218 : 69–76. DOI:10.1016/S0378-1119(98)00381-3 |
| [15] | Gao XP, Pan QH, Li M, et al. Abscisic acid is involved in the water stress-induced betaine accumulation in pear leaves. Plant Cell Physiol , 2004, 45 : 742–750. DOI:10.1093/pcp/pch089 |
| [16] | Popko J, H?nsch R, Mendel RR, et al. The role of abscisic acid and auxin in the response of poplar to abiotic stress. Plant Biol , 2010, 2 : 242–258. |
| [17] | Yang SL, Chen K, Wang SS, et al. Osmoregulation as a key factor in drought hardening-induced drought tolerance in Jatropha curcas. Biol Plantarum , 2015, 59 (3) : 529–536. DOI:10.1007/s10535-015-0509-y |
| [18] | 王莎莎, 盛业龙, 马文广, 等. 抗氧化系统参与不同抗性烟草品种幼苗对干旱和低温综合抗性的形成. 生物技术通报 , 2014 (1) : 134–142. |
| [19] | 张志勇, 卜晶晶, 王素芳, 等. 冠菌素对不同钾水平下TTC法测定的棉花根系活力的影响. 植物生理学报 , 2015, 51 (5) : 695–701. |
| [20] | 许锁链, 李忠光, 龚明. 外源甜菜碱对PEG 胁迫下小桐子种子萌发和幼苗生长的保护作用. 种子 , 2011, 30 (9) : 29–33. |
| [21] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using realtime quantit-ative PCR and the 2-ΔΔCT method. Methods , 2001, 25 : 402–408. DOI:10.1006/meth.2001.1262 |
| [22] | Zhang XY, Liang C, Wang GP, et al. The protection of wheat plasma membrane under cold stress by glycine betaine overproduction. Biol Plantarum , 2010, 54 (1) : 83–88. DOI:10.1007/s10535-010-0012-4 |
| [23] | Yang ZM, Yu JJ, Merewitz E, et al. Differential effects of abscisic acid and glycine betaine on physiological responses to drought and salinity stress for two perennial grass species. J Amer Soc Hort Sci , 2012, 137 (2) : 96–106. |
| [24] | Bakht J, Bano A, Shafic M, et al. Effect of abscisic acid applications on cold tolerance in chickpea(Cicer arietinum L.. Europ J Agronomy , 2013, 44 : 10–21. DOI:10.1016/j.eja.2012.07.006 |
| [25] | 于晶, 张林, 苍晶, 等. 外源ABA对寒地冬小麦东农冬麦1号幼苗生长及抗冷性的影响. 麦类作物学报 , 2008, 28 (5) : 883–887. |
| [26] | Kumar V, Yadav SK. Proline and betaine provide protection to antioxidant and methylglyoxal detoxification systems during cold stress in Camellia sinensis(L. )O. Kuntze. Acta Physiol Plant , 2009, 31 : 261–269. DOI:10.1007/s11738-008-0227-6 |
| [27] | Zhang J, Tan W, Yang XH, et al. Plastid-expressed choline monooxyge-nase gene improves salt and drought tolerance through accumulation of glycine betaine in tobacco. Plant Cell Rep , 2008, 27 : 1113–1124. DOI:10.1007/s00299-008-0549-2 |
| [28] | Chaitanya KV, Rasineni GK, Reddy AP. Biochemical responses to drought stress in mulberry (Morus alba L. ): evaluation of proline, glycine betaine and abscisic acid accumulation in five Cultivars. Acta Physiol Plant , 2009, 31 : 437–443. DOI:10.1007/s11738-008-0251-6 |
| [29] | Zhu XY, Chen WX, Li XP. Molecular cloning of betaine aldehyde dehydrogenase(BADH)gene from harvested papaya(Carica papaya)fruit and its response to temperature stress. Res J Biotechnol , 2015, 10 : 33–42. |
| [30] | Abdul Jaleel C, Manivannan P, Sankar B, et al. Water deficit stress mitigation by calcium chloride in Catharanthus roseus: Effects on oxidative stress, proline metabolism and indole alkaloid accumulation. Colloid Surface B , 2007, 60 (1) : 110–116. DOI:10.1016/j.colsurfb.2007.06.006 |
| [31] | Li ZG, Zhu LP. Hydrogen sulfide donor sodium hydrosulfide-induced accumulation of betaine is involved in the acquisition of heat tolerance in maize seedlings. Braz J Bot , 2015, 38 (1) : 31–38. DOI:10.1007/s40415-014-0106-x |
| [32] | 宋志辉, 任永玲, 闫根柱, 等. 水分胁迫下梨树叶片中脱落酸与甜菜碱水平的变化. 山西农业科学 , 2015, 43 (7) : 807–809. |
| [33] | Kumar S, Kaushal N, Nayyar H, Gaur P. Abscisic acid induces heat tolerance in chickpea (Cicer arietinum L. )seedlings by facilitated accumulation of osmoprotectants. Acta Physiol Plant , 2012, 34 : 1651–1658. DOI:10.1007/s11738-012-0959-1 |






