2. 东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040
2. State Key Laboratory of Forest Genetics and Tree Breeding,Northeast Forestry University,Harbin 150040
铁是植物生长必需的微量元素之一,它对于植物叶绿体的合成和酶的合成是必不可少的,能够促进植物的光合作用和呼吸作用[1];植物缺铁会导致叶绿素含量减少、叶片黄化,使植物出现失绿症甚至死亡[2]。而过量的Fe2+导致氧化胁迫,Fe2+催化Fenton反应生成具有强氧化性的羟自由基,损害细胞膜系统甚至导致植物细胞死亡[3, 4],在酸性条件下土壤会释放出大量的Fe2+造成铁污染,潜育性水稻土中Fe2+毒害是限制水稻生长的原因之一[5, 6]。铁蛋白(Ferritin)是一种可以储存铁离子的储藏结合蛋白,由24个同源或异源亚基组成的450 kD复合体,每个铁蛋白分子可以储藏0-4 500个可溶的、无毒的、可利用的铁离子。铁蛋白的一个主要作用是储存铁离子,作为植物体光合作物和固氮的铁源;另一个主要作用是作为胁迫反应蛋白,促进过剩铁离子的储藏[7-9]。研究表明烟草铁蛋白基因NtFer1在转基因烟草中的过量表达能够提高转基因植株抗氧化能力、叶片总铁含量和最大光化学量子产量[10]。大豆铁蛋白基因转入莴苣中,转基因植株铁含量比对照高出20%-70%,生长速度也高于对照[11]。豌豆铁蛋白基因转化到秀水11中增加了转基因植株中铁的贮藏量,降低了植株游离铁含量从而减轻了转基因植株的氧化损伤,氧化胁迫的耐受能力有不同程度的增强[12]。
本研究利用农杆菌介导法将铁蛋白基因NtFer1转入粳稻空育131,在缺铁和铁过量条件下培育T2代转基因植株,通过比较转基因植株和对照在不同Fe2+条件下生理响应等方面差异,分析铁蛋白基因NtFer1功能,旨为粳稻分子抗逆育种提供理论依据。
1 材料与方法 1.1 材料试验用粳稻空育131种子由东北农业大学水稻研究所提供。烟草铁蛋白基因NtFer1(GenBank登录号:AB083924)前期研究获得,cDNA编码区全长756 bp,编码251个氨基酸。植物表达载体PBI121由东北林业大学林木遗传育种国家重点实验室提供。
1.2 方法 1.2.1 载体构建和菌株培养将烟草铁蛋白基因NtFer1 cDNA片段插入植物表达载体PBI121替代GUS基因,启动子CaMV35S,终止子NOS,筛选标记NPTII基因,利用冻融法将经测序检验的质粒导入农杆菌EHA105。将农杆菌EHA105- NtFer1涂布LB(Kan 50 mg/L和Rif 50 mg/L)固体培养基,27℃暗培养,挑取若干单菌斑至LB(Kan 50 mg/L和Rif 50 mg/L)液体培养基,27℃、160 r/min 培养12-16 h,取500 μL上述菌液加入至100 mL YEB 培养液中,待OD=0.5时侵染备用。
1.2.2 农杆菌介导法遗传转化空育131成熟种子除去颖壳,消毒处理播至愈伤诱导培养基,14 d剥离愈伤组织至愈伤继代培养基,10 d后转至预培养基暗培养4 d,将愈伤组织浸没于农杆菌EHA105- NtFer1菌液中30 min,置于共培养基20℃暗培养3 d,经筛选、分化和生根培养(Kan 50-120 mg/L)将幼苗移入壮苗营养液中培养,选出长势较好的若干株进一步研究。
1.2.3 T0代植株分子检测用试剂盒(原平皓,HF224) 提取叶片基因组DNA。应用Primer Premier 5.0设计特异引物,NtFer1-F(5'-CCACTATCCTTCG-CAAGACCCTTCC-3')和NtFer1-R(5'-CATCGCAAG-ACCGGCAACAGGATTC-3')。PCR反应体系:模板0.5 μg,100 μmol/L引物各0.1 μL,10×Buffer(with Mg2+)2.0 μL,2.5 mmol/L dNTP 2 μL,5 U/μL Taq 0.2 μL,总体积20 μL。反应条件:94℃ 2 min;94℃ 30 s,58.5℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。PCR产物经1%凝胶电泳分离成像。用DIG标记探针试剂盒(Roche)标记烟草铁蛋白基因NtFer1cDNA为探针,参照《分子克隆实验指南》方法进行Southern杂交。用Trizol 法提取叶片总RNA,取30 μg 65℃水浴5 min,经1%甲醛变性胶电泳分离后进行Northern杂交,方法同Southern杂交。
1.2.4 T2代植株分子检测用Trizol 法提取叶片和根部总RNA,参照试剂盒(Toyobo,Japan)说明书反转录成cDNA,以水稻Actin1基因为内参基因,外源基因特异引物为:NtFer1-RT-F(5'-AGGAGTT-GATGCTTGTACCC-3')和NtFer1-RT-R(5'-TTCTCA-GCGTGCTCTCTTTC-3'),内参基因特异引物为:Actin1-RT-F(5'-ATCCTTGTATGCTAGCGGTCGA-3')和Actin1-RT-R(5'-ATCCAACCGGAGGATAGCATG-3')。扩增反应程序:95℃ 30 s,94℃ 30 s、58℃ 30 s、72℃ 30 s,42个循环;熔解程序:94℃ 30 s,94℃-60℃台阶温度0.5℃保持1 min,94℃ 30 s。DNA提取和PCR检测同1.2.3。
1.2.5 生理指标测定经抗性筛选和分子检验后,将T2代转基因植株和非转基因对照移置于壮苗营养液中培养(Fe2+ 5 μmol/L和300 μmol/L),40 d测定植株上部叶片超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和丙二醛(MDA)含量,以及叶绿素相对含量和PSⅡ最大光化学量子产量Fv/Fm(经20 min暗适应),均重复3次。SOD活性用氮蓝四唑光化学还原法测定,POD活性用愈创木酚法测定,MDA含量用硫代巴比妥酸比色法测定,叶绿素相对含量用叶绿素仪SPAD-502(Japan)测定,PSⅡ最大光化学量子产量Fv/Fm用叶绿素荧光仪PAM-2500(德国WALZ)经20 min暗适应后测定。
1.2.6 叶片、糙米总Fe含量测定根据Fe标准物绘制标准曲线,湿式消解-原子吸收法测定总Fe含量(原子吸收分光光度计Z-2000,Japan),并计算样品加标回收率。取T2代转基因植株和非转基因对照(Fe2+ 5 μmol/L和300 μmol/L,40 d)上部叶片烘干后测定总Fe含量,重复3次;成熟籽粒去除颖壳、烘干粉碎测定糙米中总Fe含量,重复3次。
1.2.7 根系生长量测定在Fe2+ 5 μmol/L和300 μmol/L营养液中培育40 d,蒸馏水冲洗干净根系表面使根系充分展开,应用植物根系分析系统根系分析仪LA-S测定植株根系总长度和不同直径范围根系长度,重复测定3次。
1.2.8 糙米氨基酸含量测定T2代转基因植株成熟种子等质量混合以及非转基因对照(Fe2+ 300 μmol/L营养液培养),去除颖壳、粉碎、过筛、烘干,称取100 mg,加入8 mL 6 mol/L HCl 吹入氮气封口,110℃水解22 h,冷却过滤定容至50 mL,取1 mL真空冻干加入1 mL 0.02 mol/L HCl,离心取上清0.8 mL,过滤后用全自动氨基酸分析仪(德国阿米诺西斯,A200)测定氨基酸含量,并重复3次。
1.2.9 瘟病抗性分析采集黑龙江省粳稻主要产区2010-2012年稻瘟病小种样本,分离培养62个单孢菌株,菌体悬浮液浓度 2×105 孢子/mL,每个菌株取10 mL悬浮液加入0.02% Tween20混匀,喷雾器接种于T2代转基因植株和非转基因对照的三叶一心的幼苗(Fe2+ 300 μmol/L营养液培养),27℃、湿度90%,暗培养24 h,然后保持27℃、湿度90%、12 h/d光照培养,按照国际水稻所稻瘟病抗性评价分级标准叶瘟分级标准,0、8、10和12 d调查叶瘟级别,根据病情指数公式计算稻瘟病病情指数[13, 14]。
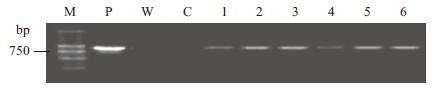
2 结果 2.1 转基因植株分子检测对T0代抗性植株PCR检测,抗性植株和质粒在750 bp处均扩增出目的条带(图 1),初步证明外源基因NtFer1整合到空育131基因组中。从中选出3株长势较好的抗性植株,进行Southern blot检测,其均能与探针杂交出条带(图 2-A),进一步证明外源基因已整合到粳稻空育131基因组中;分离总RNA进行Northern blot检测,在转基因植株中均检测到了相应的外源基因NtFer1表达的mRNA信号(图 2-B),表明外源基因NtFer1已在转录水平表达。
|
| 图 1 T0代转基因植株PCR检测 M:DNA Marker2000;P:阳性对照;W:空白对照;C:非转基因对照;1-6:转基因植株 |

|
| 图 2 T0代转基因植株Southern(A)和Northern(B)杂交检测 M:DNA Marker 2000;P:阳性对照;C:非转基因对照;1-3:转基因植株 |
经连续2代自交对上述3个转基因株系(Nt1、Nt2和Nt3)PCR检测(图 3),抗性植株和质粒均产生特异扩增条带,而非转基因对照则无特异扩增条带;RT-PCR检测(图 4)在不同Fe2+胁迫条件下NtFer1基因在转基因株系中均有表达,且相同株系在不同Fe2+条件下相对表达量无显著差异。表明NtFer1基因在转基因植株中能够稳定遗传表达。

|
| 图 3 T2代转基因植株PCR检测 M:DNA Marker2000;P:阳性对照;W:空白对照;C:非转基因对照;1-4:转基因株系Nt1;5-8:转基因株系Nt2;9-12:转基因株系Nt3 |

|
| 图 4 T2代转基因植株RT-PCR检测 |
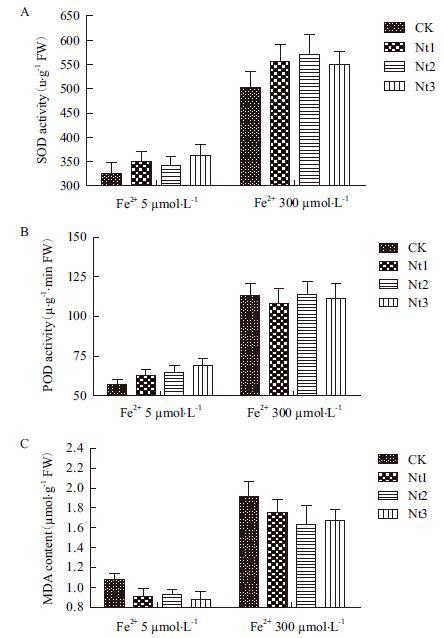
在Fe2+ 5 μmol/L和300 μmol/L培养液条件下生长的转基因株系SOD活性显著高于对照8.0%-11.4%和9.3%-13.3%(图 5-A),而MDA含量显著低于对照13.9%-18.5%和8.3%-15.1%(图 5-C);在低浓度Fe2+条件下转基因株系POD活性显著高于对照10.5%-21.0%(图 5-B),而在高浓度Fe2+条件下其与对照的差异不显著。表明在一定Fe2+条件下NtFer1基因在转基因粳稻中的表达能够提高叶片细胞的抗氧化酶活性从而降低质膜过氧化作用,保护细胞膜系统。
|
| 图 5 SOD活性(A)、POD活性(B)和MDA含量(C) |
在缺铁(Fe2+ 5 μmol/L)条件下转基因株系叶绿素相对含量显著高于对照8.3%-15.9%(图 6),PSⅡ最大光化学量子产量Fv/Fm显著高于对照5.2%-6.4%(图 7);在铁过量(Fe2+ 300 μmol/L)条件下转基因株系和对照叶绿素相对含量无显著差异,而PSⅡ最大光化学量子产量Fv/Fm有高于对照的趋势。在缺铁条件下NtFer1基因在转基因粳稻中的表达能够提高转基因植株叶绿素相对含量和PSⅡ最大光化学量子产量Fv/Fm,说明转基因植株对缺铁耐性要强于对照,并能够减缓光能转换效率的降低。

|
| 图 6 叶绿素相对含量 |

|
| 图 7 PSⅡ最大光化学量子产量Fv/Fm |
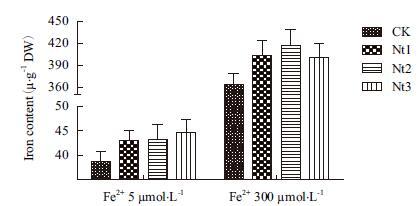
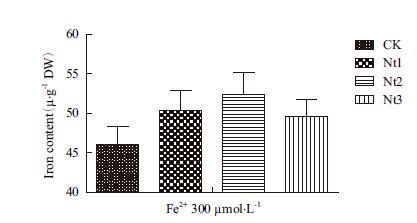
在Fe2+ 5 μmol/L和300 μmol/L培养液条件下转基因株系叶片总铁含量显著高于对照10.8%-15.1%和10.4%-14.9%(图 8);在Fe2+ 300 μmol/L培养液条件下转基因株系糙米总铁含量显著高于对照7.6%-13.7%(图 9),在Fe2+ 5 μmol/L培养液条件下转基因株系和对照由于严重缺铁而导致植株不能成熟收获籽粒。表明NtFer1基因转入表达提高了转基因植株在缺铁和铁过量条件下叶片储藏铁离子的能力,铁过量条件下能够提高转基因植株糙米总铁含量。
|
| 图 8 叶片铁含量 |
|
| 图 9 糙米铁含量 |
对7个不同直径范围内的根系长度和根系总长度(直径≥0.10 mm)比较发现,在Fe2+ 5 μmol/L培养液条件下转基因株系根系总长度(直径≥0.10 mm)显著高于对照16.7%(P﹤0.05),其中直径≥0.45 mm的根系长度高于对照24.9%(P﹤0.05);在Fe2+ 300 μmol/L培养液条件下转基因株系根系总长度(直径≥0.10 mm)显著高于对照6.4%(P﹤0.05),其中直径≥0.45 mm的根系长度分高于对照3.2%(图 10)。表明NtFer1基因转入表达能够提高转基因植株在缺铁和铁过量条件下根系生长量。
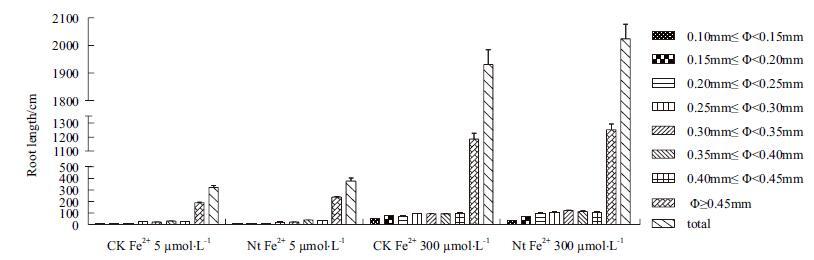
|
| 图 10 不同直径范围的根系长度及根系总长度 |
在过量Fe2+条件下转基因植株和非转基因对照16种氨基酸和游离氨基酸总质量含量略高于对照,但差异未达显著,其中丙氨酸Ala等7种氨基酸质量含量高于对照、丝氨酸Ser等7种氨基酸质量含量与对照持平、苏氨酸Thr等3种氨基酸略呈下降趋势,其中仅丙氨酸Ala和脯氨酸Pro含量高于对照6.1%和8.5%(图 11)差异达到显著。

|
| 图 11 糙米氨基酸含量 |
在过量 Fe2+条件下3个转基因株系稻瘟病叶瘟指数在3个统计时间点均低于对照,其中第10天和12天分别低于对照7.8%和13.1%且差异达到显著(图 12)。表明NtFer1基因的转入表达能够提高转基因植株稻瘟病叶瘟抗性,从而抑制稻瘟病病菌对叶片的侵害、降低叶瘟指数。
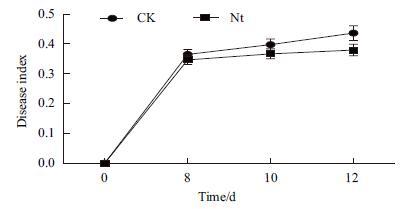
|
| 图 12 稻瘟病叶瘟指数 |
SOD和POD是活性氧清除剂,均属于抗氧化类酶,在植物抗氧化胁迫中具有清除氧自由基、防止脂膜过氧化以及维持活性氧代谢平衡的功能[15, 16]。MDA是脂质氧化的终产物,其会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,含量高低可作为细胞膜过氧化作用强弱和质膜破坏程度的指标[17, 18]。在不同Fe2+条件下转基因株系的SOD活性显著高于对照,而MDA含量显著低于对照。一方面外源铁蛋白基因NtFer1的转入表达促进植株细胞将有毒害游离Fe2+以无毒的状态储藏在铁蛋白中,从而降低了由Fe2+催化Fenton反应产生的羟自由基(·OH)含量;另一方面铁是SOD酶重要金属辅基之一,铁蛋白能够将有毒害的Fe2+转化成无毒的、可利用的状态供给细胞合成SOD酶,从而提高细胞抗氧化酶活性、降低过氧化物对细胞质膜的伤害。转铁蛋白基因NtFer1的转入表达能够提高转基因植株在不同Fe2+条件下的抗氧化性。
SPAD-502型叶绿素仪测定叶片SPAD值与叶片实际测定的叶绿素含量之间呈极显著正相关,可用SPAD值表示叶绿素相对含量[19-21]。Fv/Fm是PSⅡ最大光化学量子产量,反映PSⅡ反应中心内禀光能转换效率或最大PSⅡ的光能转换效率,叶片暗适应20 min后测得。非胁迫条件下该参数的变化极小,不受物种和生长条件的影响,胁迫条件下该参数明显下降[22]。在缺铁条件下转基因植株叶片总铁含量显著高于对照,铁蛋白能够储藏较多铁离子并将具有强氧化性Fe2+转化为无毒的、可利用的状态供给叶绿体合成等,从而减缓叶绿素含量的降低,抑制PSⅡ最大光化学量子产量Fv/Fm下降,铁蛋白基因NtFer1的转入表达提高了转基因植株缺铁的耐性,但在长期持续严重缺铁情况下转基因植株仍无法正常生长。在缺铁条件下(Fe2+ 5 μmol/L)转基因植株和对照由于缺铁叶片从三叶一心期开始,叶片逐渐失绿变黄致死亡,但转基因植株的失绿缓于对照;而在铁过量时,转基因株系和对照MDA含量极显著高于缺铁时对应转基因株系和对照,过量Fe2+产生的氧化胁迫强度高于Fe2+不足时产生的氧化胁迫强度,但在过量Fe2+条件下转基因植株和对照能够生长至成熟收获籽粒。根据上述情况推测在缺铁条件下植株的死亡主要原因是由于叶绿素合成不足导致光能转化效率低所造成。
铁蛋白基因NtFer1能够提高转基因粳稻糙米总铁含量,而所测17种氨基酸总质量含量无显著变化,有显著增加的丙氨酸Ala和脯氨酸Pro是人体所需的氨基酸,因此可为改善饮食铁缺乏症状研究提供参考。
接种稻瘟病混合菌种转基因株系叶片稻瘟病指数显著低于对照,结合叶片总铁含量的差异推测可能原因是,转基因植株叶片较高铁含量抑制了稻瘟病病菌对叶片的侵害,当病菌侵染叶片后受侵染部位细胞响应使铁蛋白释放出储存的铁离子,Fe2+催化Fenton反应生成具有强氧化性的羟自由基抑制稻瘟病病菌增长,而在没有受到病菌侵染的部位铁离子仍以可溶的、无毒的状态储存在铁蛋白中。试验用空育131属高纬寒地中、早熟粳稻品种,具有产量高、米质优和抗倒伏等优点,但属稻瘟病易感品种严重影响其推广种植,转NtFer1空育131植株稻瘟病抗性显著提高,可为利用基因工程技术提高粳稻抗病育种提供参考。
4 结论在缺铁(Fe2+ 5 μmol/L)条件下,T2代转基因植株叶片抗氧化酶活性(SOD、POD)、叶绿素相对含量、叶片总铁含量和根系生长量均较对照有显著提高,而MDA含量显著低于对照。外源铁蛋白基因NtFer1的转入表达能够提高转基因植株低铁胁迫的耐性、抗氧化性和铁离子储藏能力。
在铁过量(Fe2+ 300 μmol/L)条件下,T2代转基因植株叶片抗氧化酶活性(SOD)、叶绿素相对含量、叶片总铁含量、糙米总铁含量和根系生长量均较对照有显著提高,而MDA含量显著低于对照;接种稻瘟病病菌后转基因植株叶瘟指数显著低于对照。外源铁蛋白基因NtFer1的转入表达还能够提高转基因植株铁稻瘟病抗性。
| [1] | Kobayashi T, Nishizawa NK. Iron uptake, translocation and regulation in higher plants. Annu Rev Plant Biol , 2012, 63 : 131–152. DOI:10.1146/annurev-arplant-042811-105522 |
| [2] | Guerinot ML. It’s elementary: enhancing Fe3+ reduction improves rice yields. Proc Natl Acad Sci , 2007, 104 : 7311–7312. DOI:10.1073/pnas.0701954104 |
| [3] | Arosio P, Ingrassia R, Cavadini P. Ferritins:A family of molecules for iron storage, antioxidation and more. Biochim Biophys Acta , 2009, 1790 : 589–599. DOI:10.1016/j.bbagen.2008.09.004 |
| [4] | Ravet K, Touraine B, Boucherez J, et al. Ferritins control interaction between iron homeostasis and oxidative stress in Arabidopsis. The Plant Journal , 2009, 57 : 400–412. DOI:10.1111/tpj.2009.57.issue-3 |
| [5] | 龚子同, 张效朴, 韦启璠. 我国潜育性水稻土的形成、特性及增产潜力. 中国农业科学 , 1990, 23 (1) : 45–53. |
| [6] | 彭显龙, 刘元英, 罗盛国. 铁胁迫下硒对水稻养分吸收的影响. 东北农业大学学报 , 2011, 42 (8) : 92–95. |
| [7] | Harrison PM, Arosio P. The ferritin:Molecular properties, iron storage function and celluar regulation. Biochim Biophys Acta , 1996, 12 : 161–203. |
| [8] | Jiang TB. Isolation and expression pattern analysis of two ferritin genes in tobacco. Journal of Integrative Plant Biology , 2005, 47 (4) : 477–486. DOI:10.1111/jipb.2005.47.issue-4 |
| [9] | Jiang TB, Ding BJ, Li FJ, et al. Differential expression of endogenous ferritin genes and iron homestasis alteration in transgenic tobacco overexpressing soybean ferritin gene. Acta Gene Sin , 2006, 33 : 1120–1126. DOI:10.1016/S0379-4172(06)60150-9 |
| [10] | Tang X, Zou D, Zhang L, et al. Different between ferritin genes overexpressing in transgenic tobacco. Genetics and Molecular Research , 2014, 13 : 3167–3185. |
| [11] | Goto F, Yoshihara T, Saiki H. Iron accumulation and enhanced growth in transgenic lettuce plants expressing the iron-binding protein ferritin. Theor Appl Genet , 2000, 100 : 658–664. |
| [12] | 徐晓晖, 郭泽建, 程志强, 等. 铁蛋白基因的水稻转化及其功能初步分析. 浙江大学学报:农业与生命科学版 , 2003, 29 (1) : 49–54. |
| [13] | 张俊华, 孙洪利, 刘洋大川, 等. 黑龙江省稻瘟病菌生理小种鉴定. 植物保护 , 2009, 35 (3) : 137–140. |
| [14] | 宋成艳. 黑龙江省水稻新品种(系)抗稻瘟病性鉴定及利用. 植物保护 , 2011, 37 (4) : 142–145. |
| [15] | YasmeenA, Nouman W, et al. Morphological and physiological response of tomato(Solanumlycopersicum L.)to natural and synthetic cytokinin sources:a comparative study. Acta Physiologiae Plantarum , 2014, 36 (12) : 3147–3155. DOI:10.1007/s11738-014-1662-1 |
| [16] | Attipalli RR, Kolluru VC, Munusamy V. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. J Plant Physiol , 2004, 161 (11) : 1189–1202. DOI:10.1016/j.jplph.2004.01.013 |
| [17] | Lee TJ, Luitel BP, KangWH. Growth and physiological response to manganese toxicity in Chinese cabbage(Brassica rapa L. ssp. campestris). Horticulture, Environment and Biotechnology , 2011, 52 (3) : 252–258. DOI:10.1007/s13580-011-0224-3 |
| [18] | Tang ZH, ZhangAJ, Wei M, et al. Physiological response to potassium deficiency in three sweet potato(Ipomoea batatas [L.]Lam.)genotypes differing in potassium utilization efficiency. Acta Physiologiae Plantarum , 2015, 37 : 184. DOI:10.1007/s11738-015-1901-0 |
| [19] | Coste S, Baraloto C, Leroy C, et al. Assessing foliar chlorophyll contents with the SPAD-502 chlorophyll meter:a calibration test with thirteen tree species of tropical rainforest in French Guiana. Ann For Sci , 2010, 67 : 607. DOI:10.1051/forest/2010020 |
| [20] | Shizuka M, Katushi Y, Hiroshi F. Classification of brown rice with different content using the diagnosis of leaf color during the ripening period in shonai area of yamagata prefecture. Jpn J Crop Sci , 2010, 79 (2) : 113–119. DOI:10.1626/jcs.79.113 |
| [21] | Uddling J, Gelang-Alfredsson J, et al. Evaluating the relationship between leaf chlorophyll concentration and SPAD-502 chlorophyll meterreadings. Photosynth Res , 2007, 91 (1) : 37–46. DOI:10.1007/s11120-006-9077-5 |
| [22] | Demmig-Adams B, Adams WW Ⅲ, Barker DH, et al. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation. Physiol Plant , 1996, 98 : 253–264. |




