螺旋霉素(spiramycin,SPM)是一种由生二素链霉菌(S. ambofaciens)所产生的多组分大环内酯类抗生素,主要组分包括螺旋霉素Ⅰ、Ⅱ、Ⅲ,结构式见文献[1]。螺旋霉素具有一个十六元聚酮内酯环,由Ⅰ型聚酮合酶(PKSⅠ)合成。其中十六元环上有3个脱氧己糖,分别是福洛氨糖(forosamine)、碳霉氨糖(mycaminose)和碳霉糖(mycarose);其分子式为C43H74N2O14,分子量为843.052 7[1]。螺旋霉素为白色或微黄色、味苦,是一种无定形碱性抗生素;易溶于醇类,可溶于氯仿、己烷、酮、苯和醋酸酯,难溶于水;且其硫酸盐溶于水和低级醇。在发酵液中,组分I的含量最高,为60%;其次,是组分Ⅱ,含量为24%;最后是组分Ⅲ,含量为13%,各组分活性相近[2]。螺旋霉素的熔点:组分Ⅰ为134-137℃;组分Ⅱ为130-133℃;组分Ⅲ为128-131℃。比旋度[α]D20(C=I,甲醇):组分Ⅰ为-96°;组分Ⅱ为-86°;组分Ⅲ为-85 °。在231-232 nm处有紫外吸收峰,本身带有发色基团;遇浓硫酸或盐酸呈紫色反应。螺旋霉素的麦芽酚反应、茚三酮反应、坂口反应、双缩反应、斐林反应均为阴性[3, 4]。
螺旋霉素属中谱抗生素,对呼吸道感染、军团菌病、弓形虫病、隐孢子病、非淋球菌性尿道炎及其他炎症(如丹毒、猩红热、扁桃体炎、中耳炎、牙周炎、急性鼻窦炎及急性乳腺炎等)均有满意疗效;对革兰阳性菌和部分革兰阴性菌,如脑膜炎双球菌、链球菌、百日咳杆菌、梭状芽胞杆菌等有效,对青霉素、链霉素、四环素、氯霉素的耐药菌也有效;对立克次体有效,对衣原体和支原体有一定抗菌作用;但因肠道革兰阴性杆菌通常耐药,故螺旋霉素对其抗菌作用差[5]。螺旋霉素的抗菌谱虽然与红霉素相似,但其抗生素后效应(PAE)较红霉素持续时间更长,不良反应明显低于红霉素;且无诱导耐药性,不良反应较低,交叉耐药性也小[6];因而可用以治疗一些新发现的感染[7]。螺旋霉素的抗菌作用机制与其他大环内酯类抗生素相同,通过特异性地与细菌70S核糖体上的50S亚基结合,选择性地抑制蛋白质的合成延伸,从空间上阻滞新生肽链的延伸和促进pt-tRNA的脱落而发挥抑菌作用;且螺旋霉素强烈抑制PolyC、PolyA及PolyU对脯氨酸、赖氨酸及苯丙氨酸的吸收[8]。
国产螺旋霉素的产生菌是由中国医学科学院医药生物技术研究所于1974年从甘肃水福县土壤中分离得到的链霉菌L799,它产生的抗生素与国外报道的螺旋霉素相同[9]。临床常用的螺旋霉素类药物是由螺旋霉素乙酰化而成,进入体内后必须脱乙酰基再转化为螺旋霉素方可发挥抗菌作用。螺旋霉素虽体外抗菌作用差;但体内过程独特,组织亲和力、组织浓度高,能增强吞噬细胞的吞噬作用[10];因而在临床上占有重要的地位。由于螺旋霉素在临床上的广泛应用,因此,如何在其生物合成过程中提高产量是当前本领域研究的一个重要课题。为此,本文从分子水平、基因水平及发酵工艺等3个方面,对螺旋霉素生物合成过程的调控技术进行简要综述,重点介绍其中的基因调控技术。
1 螺旋霉素分子水平的生物合成调控技术从分子水平看,由于螺旋霉素为大环内酯类抗生素,属于一大类聚酮化合物(polyketide),因此在其生物合成过程中,内酯环的形成是主要限制因素。内酯环的合成是通过聚酮体途径、由聚酮合酶(PKS)催化而成的,即以乙酰CoA、丙酰CoA丁酰CoA为起始单位,以丙二酰CoA、甲基丙二酰CoA和乙基丙二酰CoA为延长单位,在酶的作用下“头尾”相连形成一条脂肪链,再在环合酶和修饰酶的作用下形成内酯环。内酯环合成后,再经过酶的修饰,即单、双、三糖基化作用,形成最终化合物,即先是在C-5位点连接上第一个糖(mycaminose),再将C-9的酮基还原并在此位点连接第二个糖(forosamine),最后是在碳霉氨糖上连接一个碳霉糖。
由于上述过程中起始单位可由短链脂肪酸或部分氨基酸降解而成,表明短链脂肪酸及起始和延伸单位是合成螺旋霉素的重要前体。因此,添加前体或对前体有重要作用的物质是在分子水平上调控螺旋霉素生物合成的重要方法。李友元等[11]通过二价阳离子(Zn2+、Mn2+、Co2+和Cu2+等)对酰基激酶和酰基CoA合成酶影响的研究发现:Mn2+和Co2+对酰基激酶和酰基CoA合成酶都有较强的激活作用;Cu2+虽对后者也有较强的激活作用,但对前者却有更为明显的抑制作用;Zn2+作用均不明显。毛全贵等[12]通过不同时间添加不同浓度的金属离子对SPM发酵影响的研究发现,在SPM发酵前期添加适当浓度(2.5 μg/mL)的Fe2+,产物效价比对照实验平均提高了19.7%,且在放大实验中效果良好。新近的研究还确认在SPM发酵中加入富含亚油酸的脂肪酸可提高其效价,且脂肪酸种类的复杂程度和效价的高低成正比,虽然还未能证明产生此结果的原因,但这项研究成果显然对工业生产提高SPM产量大有好处[13]。
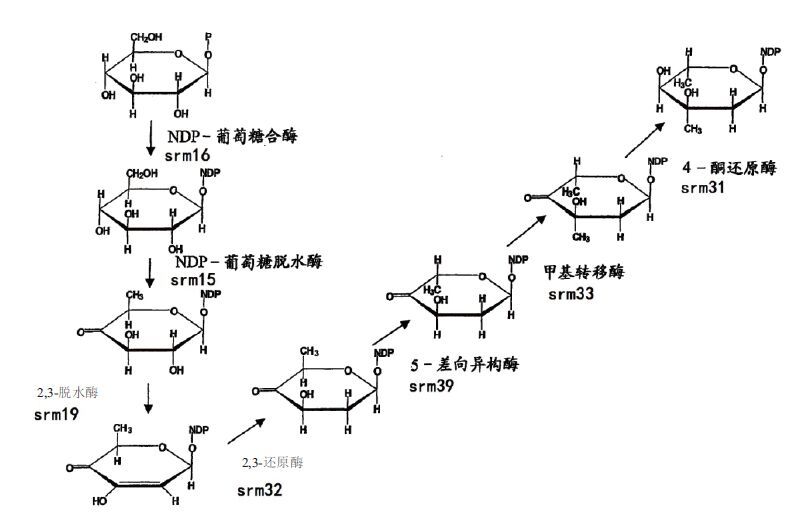
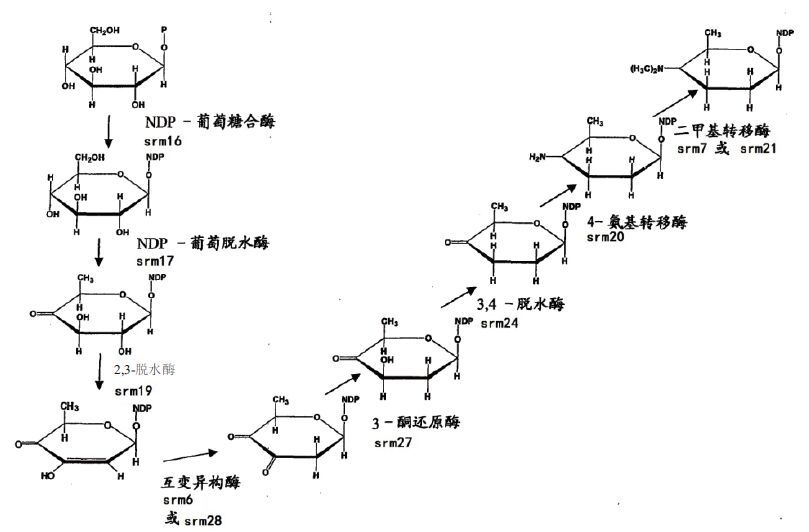
2 螺旋霉素基因水平的生物合成调控技术2007年,Karray等[14]确定了螺旋霉素生物合成的50个调控基因,其中包含5个PKS基因(srmGV、srmGⅣ、srmGⅢ、srmGⅡ、srmGⅠ)、11个PKS下游基因(orf1*c、orf2*c、orf3*c、orf4*c、orf5*、orf6*、orf7*c、orf8*、orf9*、orf10*、orf11*)和34个PKS上游基因(orf1、orf2、orf3、orf4、orf5、orf6、orf7、orf8、orf9、orf10、orf11c、orf12、orf13c、orf14、orf15c、orf16、orf17、orf18、orf19、orf20、orf21、orf22c、orf23c、orf24c、orf25c、orf26、orf27、orf28、orf29、orf30c、orf31、orf32c、orf33和orf34c),基因命名中的c为反向编码序列。此后,M-H·布隆德莱-鲁奥等[1]将已鉴定出的10个PKS下游基因及34个上游基因,应用BLAST和FASTA等程序将这些开放阅读框导出的蛋白序列与其他数据库中的蛋白质序列进行比较,检索出与基因产物呈显著相似性的蛋白质,并记录下这些蛋白质的来源和具体功能;再应用基因敲除及液相色谱串联质谱(LC-MS-MS)分析等技术,确定了这些基因在螺旋霉素生物合成过程中的具体作用。近几年对参与螺旋霉素生物合成基因的研究中,Karray等[15]又将原先确定的50个调控基因缩减为44个,并对其重新命名为“srm1、srm2、srm3……srm42、srm43及srm44”,如图 1所示。下面着重介绍螺旋霉素生物合成过程中一些主要基因的功能及其对螺旋霉素产量的调控。
首先是PKS的多酶体系是螺旋霉素生物合成过程中最为重要组成部分。在基因工程研究中,研究者认为对PKS的组成单元进行基因操作可提高螺旋霉素的产量或产生新的化合物。如过量表达5个PKS基因可以提高螺旋霉素的产量。其次,这44个基因大部分为螺旋霉素生物合成过程中所需要的酶,部分具体功能如图 2-图 4所示。因此,在螺旋霉素的生物合成过程中,可通过定向过量表达这些重要酶的基因,来提高螺旋霉素产量[14-16]。
其中srm3编码O-甲基转移酶,参与合并入内酯环前体的形成,这对于螺旋霉素的生物合成途径是必需的,因此该基因失活会导致螺旋霉素完全停止产生。srm14编码异构酶,该酶负责螺旋霉素分子中一种糖(可能是mycarose)生物合成所必须的异构化反应。srm15编码3-氨基转移酶,该酶负责螺旋霉素一种氨基糖生物合成所必须的氨基转移反应。srm20编码氨基转移酶,该酶负责forosamine生物合成所必须的氨基转移反应。srm24基因编码3,4-脱水酶,该酶负责forosamine生物合成所必须的脱水反应,若该基因失活则不产生forosamine。srm26编码还原酶,该基因失活虽依旧产生生物合成中间体platenolide A,但却不产生中间体platenolide B。srm43基因编码还原酶。上述这7个基因的失活实验显示:其所得到的菌株不再产生螺旋霉素,证明这8个基因是螺旋霉素生物合成中所必须的[14-16]。
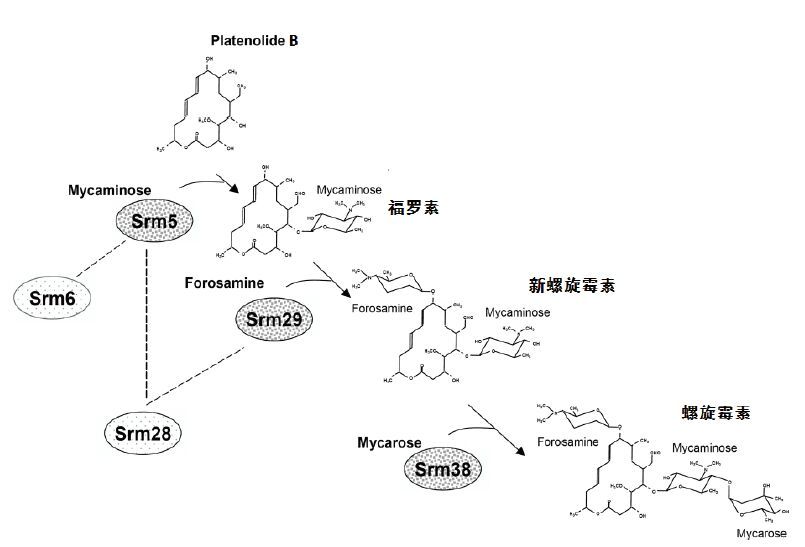
此后,Hoang等[17, 18]研究又发现:螺旋霉素的糖基化主要受srm5、srm6、srm28、srm29和srm38这5个基因的调控,糖基化分为3步且为依次进行,srm5、srm29和srm38分别为3个糖苷化酶,而srm6、srm28均为NDP己糖3,4-异构酶,为辅助性蛋白(图 5)。因而,通过激活相应的糖苷化反应并使其处于最优活性,也可显著提高产量。
尤其值得提出的是srm22,该基因早就被命名为srmR[19],其在螺旋霉素生物合成过程中极为关键。通过构建重组质粒来确定srm22翻译起始位点的实验,研究者已确定其翻译起始位点位于最上游的ATG基因,并证明了srm22的5′-截短的信使是无活性的,而5′末端对于激活srm22基因的功能却是必须的。因此为了提高螺旋霉素的产量,必须过量表达有效的srm22,而不表达srm22基因的5′-截短的信使。同时,srm22可调节srm40的表达,而srm40基因编码调节蛋白质,是螺旋霉素生物合成的激活子,控制着螺旋霉素生物合成中很多其他基因的表达,在其各自的沉默和过表达实验中发现,srm40对于螺旋霉素生物合成过程是必须的,且倍增这两个基因可造成螺旋霉素产量的提升[14, 17]。
综上所述,可归纳出螺旋霉素生物合成途径及其中的主要调控基因如图 6所示。

|
| 图 6 螺旋霉素生物合成途径及其中的主要调控基因 |
螺旋霉素发酵通常采用二级发酵工艺。发酵培养基成分为淀粉、鱼粉、玉米浆、碳酸钙、硝酸铵、氯化钠、硫酸镁、磷酸二氢钾等[7]。实验表明,添加丙三醇可以增加糖酵解(EMP)途径和三羧酸(TCA)循环的代谢流,促进细胞代谢;添加甲基化试剂(如氯化胆碱)可增大TCA循环通量并减少杂质;添加维生素(如VB1和硫辛酸)可提高酶活力及促进菌体生长代谢;通过这3种方式均可提高螺旋霉素的产量[20-22]。祝立新等[23]发现,当发酵进行到40 h左右,添加Mn2+溶液,使得发酵液中Mn2+浓度为15-40 mmol/L,可提高螺旋霉素产量约25%。
通过高产菌株的选育和及时分离产物来提高产量也是工业生产中常用的方法,如选育缬氨酸耐性突变株[24]、耐油突变株等[25]。韩少卿等[26]发现,利用超滤、纳滤技术分离提取螺旋霉素,其收率可高达76.3%。
此外,微生物代谢工程通过分析细胞代谢网络并以基因工程方面的技术手段作为辅助来提高螺旋霉素的发酵效率,也是当前本领域研究的一个重要问题[27]。如通过对螺旋霉素生物合成代谢网络节点的研究发现:添加葡萄糖作为螺旋霉素发酵过程中的激活剂,可在防止葡萄糖效应的同时,有效促进C3酰化酶的催化作用,以此也可提高螺旋霉素的产量[28]。
4 小结以前,螺旋霉素的生物合成主要从分子层面入手,通过添加前体及前体类似物来提高产量。近年,随着生物技术的快速发展,从基因层面入手,通过过量表达某些重要的基因以优化菌种来提高产量,已成为一种高效的新途径。此外,在生产实践的发酵过程中,寻找发现成本更低、安全性更高的对前体合成有利物质,仍是当前需要继续深入研究的问题。
| [1] | M-H·布隆德莱-鲁奥, H·多明格斯, E·达尔邦-龙热尔, 等. 参与螺旋霉素生物合成的多肽、编码这些多肽的核苷酸序列及其应用:中国, CN101302528A[P]. 2008. |
| [2] | 刘德玉, 赵群飞, 高淑红, 等. 生二素链霉菌orf1*c基因的功能研究及菌株改造. 江苏农业学报 , 2013, 29 (1) : 39–45. |
| [3] | 王印. 螺旋霉素的生产与研究探讨. 现代农业科技 , 2010 (10) : 36–38. |
| [4] | 赵明垚. 简析螺旋霉素的生产工艺与研究进展. 中国科技博览 , 2012 (24) : 433. |
| [5] | 庞玮, 庞莉. 螺旋霉素及其临床应用. 实用医技杂志 , 1997, 4 (3) : 203–204. |
| [6] | 司良. 大环内酯类抗生素的作用机制与应用进展. 现代预防医学 , 2010, 37 (22) : 4397–4398. |
| [7] | 江国庆, 吴荣昌, 金淑文. 应对螺旋霉素重新评价. 中国药学杂志 , 1995, 30 (5) : 299–300. |
| [8] | 孙丽文. 螺旋霉素类抗生素体内过程探讨. 国外医药(抗生素分册) , 1998, 19 (5) : 358–361. |
| [9] | 阴荫, 冯晶. 螺旋霉素的制备技术探析. 中国科技博览 , 2013 (33) : 278. |
| [10] | 朱峰, 王尔健. 螺旋霉素的再评价. 中国抗生素杂志 , 1991, 16 (3) : 231–236. |
| [11] | 李友元, 陈长华, 李永东, 等. 酰基激酶和酰基CoA合成酶对螺旋霉素合成的影响. 华东理工大学学报 , 2001, 27 (3) : 251–253. |
| [12] | 毛全贵, 赵胜利, 韩德全, 等. 金属离子对螺旋霉素生物合成的影响. 中国抗生素杂志 , 2005, 30 (11) : 647–648. |
| [13] | 曾俊, 叶蕊芳, 管莹, 等. 不同种类植物油及脂肪酸对螺旋霉素生物合成影响. 粮食与油脂 , 2015, 28 (1) : 49–52. |
| [14] | Karray F, Darbon E, Oestreicher N, et al. Organization of the biosynthetic gene cluster for the macrolide antibiotic spiramycin in Streptomyces ambofaciens. Microbiology , 2007, 153 (12) : 4111–4122. DOI:10.1099/mic.0.2007/009746-0 |
| [15] | Karry F, Darbon E, Hoang CN, et al. Regulation of the biosynthesis of the macrolide antibiotic spiramycin in Streptomyces ambofaciens. Journal of Bacteriology , 2010, 192 (21) : 5813–5821. DOI:10.1128/JB.00712-10 |
| [16] | Aigle B, Lautru S, Spiteller D, et al. Genome mining of Streptomyces ambofaciens. Journal of Industrial Microbiology & Biotechn-ology , 2014, 41 (2) : 251–263. |
| [17] | Hoang CN, Karray F, Lautru S, et al. Glycosylation steps during spiramycin biosynthesis in Streptomyces ambofaciens:Involvement of three glycosyltransferases and their interplay with two auxiliary proteins. Antimicrobial Agents and Chemotherapy , 2010, 54 (7) : 2830–2839. DOI:10.1128/AAC.01602-09 |
| [18] | Hoang CN, Darbon E, Thai R, et al. Post-PKS tailoring steps of the spiramycin macrolactone ring in Streptomyces ambofaciens. Antimicrobial Agents & Chemotherapy , 2013, 57 (8) : 3836–3842. |
| [19] | Geistlich M, Losick R, Turner JR, et al. Characterization of a novel regulatory gene governing the expression of apolyketide synthase gene in streptomyces ambofaciens. Molecular Microbiology , 1992, 6 (14) : 2019–2029. DOI:10.1111/mmi.1992.6.issue-14 |
| [20] | 胡蓉, 陈长华, 张琪, 等. 丙三醇对螺旋霉素生物合成过程的影响. 华东理工大学学报:自然科学版 , 2009, 35 (1) : 30–34. |
| [21] | 罗俊, 高淑红, 陈长华, 等. 甲基化试剂对螺旋霉素发酵的影响. 化学与生物工程 , 2011, 28 (5) : 46–50. |
| [22] | 叶蕊芳, 史婷婷, 张燕, 等. 维生素对螺旋霉素发酵的影响. 化学与生物工程 , 2008, 25 (10) : 64–67. |
| [23] | 祝立新, 唐慧慧, 毛全贵. 螺旋霉素发酵工艺. 技术与市场 , 2010, 17 (2) : 71. |
| [24] | 宋友礼, 屠小平, 胡巍, 等. 螺旋霉素高产株的推理选育和工业生产. 中国医药工业杂志 , 2003, 34 (11) : 18–20. |
| [25] | 孙新强. 螺旋霉素高产菌种选育及发酵工艺优化[D]. 杭州:浙江工业大学, 2002. http://cdmd.cnki.com.cn/Article/CDMD-10337-2002110185.htm |
| [26] | 韩少卿, 叶骥, 薛强, 等. 超滤和纳滤膜分离技术提取螺旋霉素. 中国抗生素杂志 , 2005, 30 (1) : 52–55. |
| [27] | 郝伟丽, 刘景芝, 赵宝华. 微生物代谢工程原理与应用. 生物技术通报 , 2007 (5) : 18–23. |
| [28] | Colombié V, Bideaux C, Goma G, et al. Effects of glucose limitation on biomass and spiramycin production by Streptomyces ambofaciens. Bioprocess and Bosystems Engineering , 2005, 28 (1) : 56–61. |