2. 湖南城市学院化学与环境工程学院,益阳 413000
2. School of Chemical and Environmental Engineering,Hunan City University,Yiyang 413000
随着工业和经济的发展,生活和生产中产生大量污染废水,已超过自然净化能力,污染物腐败变质,细菌病毒快速繁殖,致病性微生物污染影响人类身体健康和安全。光催化技术是发展较快的高级氧化技术之一,多用于去除水中污染物质,对微生物也有很强的灭活作用[1]。
目前应用最为广泛的氯气和臭氧消毒法虽然具备高效性,但越来越多的研究表明杀菌过程中会产生三卤甲烷和溴酸盐等潜致癌消毒副产物,从而对人体健康造成潜在威胁[2, 3]。无机抗菌材料因其安全、稳定、不易产生二次污染等特点逐渐为人们所重视,光催化杀菌因为其杀菌彻底、效率高以及无二次污染被认为是一项非常有潜力的微生物治理技术[4]。其中TiO2光催化杀菌材料更是成为研究热点,但由于TiO2在紫外下才能有光响应[5],因此开发可见光光响应的光催化杀菌材料具有重要意义。
近年来,铋系材料在光催化领域受到广泛关注和研究,铋系化合物如Sillén族的BiOX(X=Cl、Br、I)有很好的可见光活性[6]。目前对溴氧化铋材料的研究主要集中在光催化氧化降解有机污染物方面,由于大肠杆菌是水体污染的指示菌种,具有实际应用意义,Matsunaga[7]、Wei[8]和Huang[9]等的研究都把大肠杆菌(E. coli)作为实验菌种。本研究选用E.coli为微生物代表,以五水合硝酸铋为原料,通过溶剂热法一步合成制备三维分级微球结构的溴氧化铋,研究BiOBr光催化材料可见光下的抗菌效果及初步机理分析,以期为新型光催化剂可见光灭菌提供技术参数。
1 材料与方法 1.1 材料试剂:五水合硝酸铋,聚乙烯吡咯烷酮(K30),溴化钾,氯化钠,营养肉汤,营养琼脂,乙二醇,无水乙醇等均为分析纯;大肠杆菌ATCC8099;L-13152活/死细菌染色试剂盒。
仪器:JSM-5600LV 型环境扫描电子显微镜;S-4800型日本日立扫描电镜;D/max-2550 PC 型X射线衍射仪;UV-Lambda 35型紫外-可见漫反射光谱仪;电感耦合等离子体发射光谱仪;光化学反应仪;IX71型倒置荧光显微镜。
1.2 方法 1.2.1 BiOBr光催化材料的制备将2.8 mmol Bi(NO3)3·5H2O 和0.15 g 的聚乙烯吡咯烷酮(PVP),溶解于50 mL乙二醇中,搅拌均匀。之后加入2.8 mmol KBr,继续搅拌,得到透亮混合液。将混合液倒入100 mL不锈钢高压反应釜中,再加入30 mL乙二醇溶剂,混合均匀,160℃下反应保温12 h。取出反应釜自然冷却,釜内混合物抽滤,用乙醇和去离子水多次洗涤后,将滤饼于70℃下干燥5 h,即可得到BiOBr光催化材料。
1.2.2 BiOBr光催化材料的表征所制备的样品晶型结由日本Rigaku的D/max-2550 PC 型X射线衍射仪XRD进行测定,采用铜Kα辐射(λ=0.154 0 nm),扫描范围是10°-80°;样品的微观形貌特征由日本JEOL的JSM-5600LV 型环境扫描电子显微镜SEM和S-4800型日本日立扫描电镜进行测定;样品对光谱的吸收性能由美国PerkinElmer的 UV-Lambda 35型紫外-可见漫反射光谱仪UV-vis进行测定。
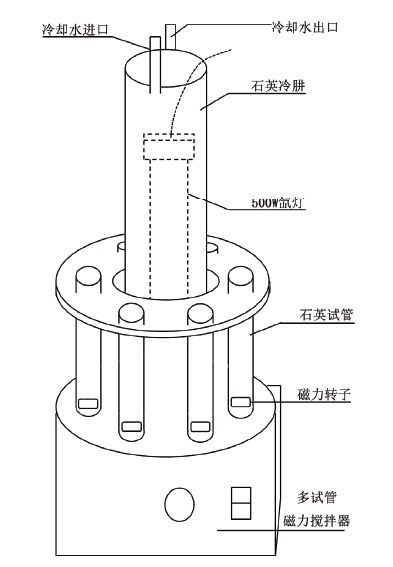
1.2.3 光催化灭菌实验选择大肠杆菌ATCC8099为试验菌,光照反应在光化学反应仪(南京胥江XPA系列)中进行,该反应仪装有500 W氙灯,光源和反应管之间用滤光片滤去420 nm以下波长的紫外光。实验装置简易图如图 1所示。取在37℃培养箱中振荡培养18 h的菌液以8 000 r/min离心,重悬于0.9%无菌生理盐水中,配成不同浓度(CFU/mL)的大肠杆菌菌悬液。将5 mL大肠杆菌菌悬液,45 mL 0.9%无菌生理盐水及一定量催化剂置于无菌石英试管中,磁力搅拌器混合均匀,室温条件下进行灭菌实验。每隔一段时间,取样稀释,涂布在营养琼脂平板上,将平板置于37℃恒温培养箱中培养24 h后计数,并计算大肠杆菌存活率。空白组仅加以光照未加光催化剂,对照组仅加光催化剂而没有光照,其余操作均与实验组相同。每个实验均重复3次。
实验用细菌存活率作为指标来评价光催化剂对大肠杆菌的灭菌作用,细菌存活率计算公式如下:

|
| 图 1 实验装置简易图 |
美国Leeman Prodigy的电感耦合等离子体发射光谱仪ICP-OES进行测定反应过程中体系内K+的含量。用日本JEOL的JEM-2100透射电镜观察可见光催化灭菌前后细菌细胞结构的变化。
为了更直接观察细菌的存活情况,采用了美国Invitrogen公司的活/死细菌染色试剂盒(LIVE/DEAD BacLight Bacterial Viability Kit L-13152)。该试剂盒选用两种不同颜色的荧光探针,同时鉴别活细菌和死细菌。具有完整细胞膜的活细菌,会被荧光染料STYO 9染成绿色;细胞膜破损的死细菌被PI荧光染料染成红色。按试剂盒说明进行两种染料的稀释配制,与不同光照时间的菌悬液进行混合孵育,之后吸取5 µL混合液滴在载玻片上,用盖玻片覆盖封片后,置于荧光显微镜下观察并拍照。
光催化反应是利用反应过程中产生的活性基团如羟基自由基·OH,空穴h+等与物质结合发生氧化反应,最终将污染物质分解[10]。本实验通过在反应过程中引入不同的捕获剂来考察不同活性基团在光催化过程中的作用,实验中催化剂用量为0.5 mg/mL,菌悬液浓度为105 CFU/mL,分别加入捕获剂异丙醇0.5 mmol,草酸钠0.5 mmol,六价铬0.05 mmol。其中,异丙醇是常用的·OH捕获剂,草酸钠是h+捕获剂,六价铬e-捕获剂。研究表明[11, 12],该浓度水平下捕获剂对大肠杆菌没有毒性。活性基团捕获剂的加入可初步判定光催化灭菌过程中的主要活性基团。
2 结果 2.1 BiOBr光催化材料的表征结果 2.1.1 SEM图所制得BiOBr光催化材料的SEM图表征结果如图 2所示,该法制备的光催化材料具有三维分级结构微球的特点,直径为2 µm左右。这种分级微球结构由大量的花瓣状二维纳米片组装而成,中间有空隙。

|
| 图 2 BiOBr的SEM图 |
经过与标准卡片(JCPDS Card NO.09-0393)对比分析,由XRD 图(图 3)可以看出,BiOBr 样品为四方晶相结构(JCPDS Card NO.09-0393)。在样品的XRD 谱图中,没有发现其他杂质衍射峰的存在。这说明所制备的样品为单一的BiOBr晶体。

|
| 图 3 BiOBr的XRD谱图 |
谱图 样品的UV-vis谱图结果如图 4所示。由图 4-A 可知,BiOBr 的吸收带边位置为430 nm,在可见光区有一定的吸收,通过经验公式:
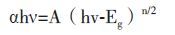

|
| 图 4 BiOBr的(A)UV-vis谱图及(B)(αhv)1/2-(hv)图 |
其中,α,h,ν,Eg和A 分别为吸收系数、普朗克常数、光频率、带隙能和常数。n 值由半导体的光学跃迁方式决定。对于BiOBr而言,n 值均为4。利用(αhν)1/2对(hν)作图,如图 4-B得BiOBr 的禁带宽度约为2.68 eV。由此可见,制备得到的样品可以被可见光激发。
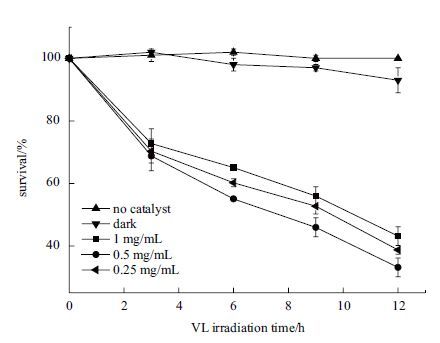
2.2 灭菌实验结果 2.2.1 光催化材料浓度对灭菌效果影响图 5为菌悬液浓度为105 CFU/mL时,不同BiOBr浓度的可见光催化灭菌效果。结果显示,随着材料浓度的增加,可见光灭菌效果不与之成正相关。黑暗和未加催化剂两组对照实验中,大肠杆菌浓度几乎没有变化。当光催化剂浓度为0.25、0.5和1.0 mg/mL时,光照反应6 h时,灭菌效果分别为40%、45%和35%,其中浓度为0.5 mg/mL时,灭菌效果最强。光照12 h后,0.5 mg/mL浓度的灭菌率达到70%左右,24 h后细菌可全部被杀死。由于材料本身有颜色,在光照反应过程中,会对光有一定的散射、反射效果,因此材料浓度越大,其对光利用率下降,进而影响灭菌效果。
|
| 图 5 三种不同浓度BiOBr材料对大肠杆菌的灭菌效果图 |
光催化材料浓度为0.5 mg/mL时,3种不同的菌初始浓度条件下,光催化灭菌效果(图 6)显示,当大肠杆菌菌悬液浓度为103 CFU/mL时,9 h内灭菌率就可达100%。随着菌初始浓度的增加,灭菌率越来越低。

|
| 图 6 不同初始菌浓度条件下光催化灭菌效果 |
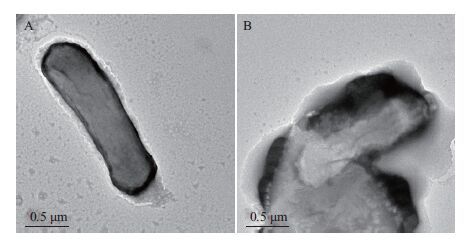
收集反应初始和光照12 h后的反应液,首先用戊二醛溶液(2.5%)在4℃固定12 h,之后对其进行离心,无菌蒸馏水水洗,用磷钨酸钠对细菌进行染色,方便TEM观察。光照12 h前后大肠杆菌的TEM图(图 7),光照反应前大肠杆菌菌体完整,细胞壁和细胞膜完整、光滑,全被染色。光照反应12 h后,大肠杆菌菌体的外形轮廓痕迹仍在,但是菌体破裂,细胞壁、细胞膜被破坏,内部物质渗出。
|
| 图 7 可见光照射12 h前(A)后(B)大肠杆菌的TEM图 |
通过反应过程中K+释放来检测细菌细胞的损坏程度。光照时间0 h和6 h时的钾离子浓度(图 8)显示,在可见光照条件下,反应6 h后,3种不同材料浓度(0.25、0.5和1.0 mg/mL)时的钾离子浓度均有明显增加,分别增加了31%、23%和17%左右。
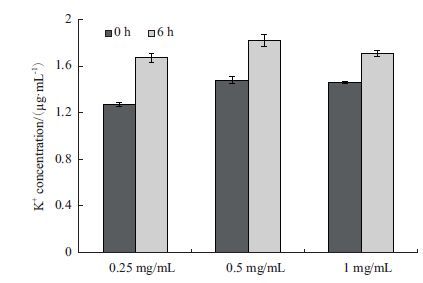
|
| 图 8 0 h和6 h时溶液中钾离子释放量 |
细菌经过PI和STYO 9染料染色孵育后,荧光显微镜下观察的活/死细菌荧光效果图(图 9)显示,活细菌在特定波长段中发出绿色荧光,而死细菌在特定波长段中发出红色荧光。从图中可直观看出随着光照时间增长,绿色荧光强度越来越弱,活细菌数量也越来越少,而红色荧光强度越来越强,死细菌越来越多。图 9-A和9-B荧光显微镜图中发出的绿色荧光分布密集且荧光强度高,说明这些细菌有完整的细胞膜。随着反应的进行,图 9-C和9-D显示,光照6 h后,绿色荧光强度有所减弱且分布稀疏,红色荧光有所增强,因而可以推断这些发出绿色荧光的细菌虽然细胞膜仍旧保持完整,但已经失去了活性,死细菌数目有所增多。随着反应的进一步进行,光照12 h后,绿色荧光几乎没有,红色荧光分布密集,表明多数细菌细胞膜都被破坏,死细菌数目显著增加。与大肠杆菌TEM和钾离子测试结果相吻合。

|
| 图 9 活死细菌染色图(bar=200 μm) |
从图 10中可以明显看出,向反应体系中加入0.5 mmol的草酸钠,细菌存活率比未加捕获剂增加了30%,增加幅度最大。加入异丙醇和六价铬之后,存活率变化不是很大。说明h+在光催化过程中起主要作用,是灭活细菌的主要活性基团。

|
| 图 10 活性基团捕获剂对灭菌性能影响 |
BiOBr光催化材料表征结果表明,所制得三维分级BiOBr光催化材料分级微球结构由大量的花瓣状二维纳米片组装而成,BiOBr的生长可以分为成核、纳米片的生长和组装等步骤[13, 14]。大量纳米片组装成花状微球,有利于导带电子扩散到纳米片的表面,提高催化剂的比表面积和光线的利用率以及电子-空穴对分离效率;纳米片状结构和空隙结构增大了样品的比表面积,有利于提高吸附强度。因此,该结构对于提高材料光催化性能有积极的作用[15-17]。材料BiOBr有沿[110]晶面取向生长的趋势,这种明显的晶面控制生长,主要与PVP 分子参与的选择性吸附过程有关。这种有特定晶面暴露取向生长的光催化材料通常有更强的光催化活性[18]。
灭菌实验结果表明,光催化材料浓度为0.5 mg/mL时,灭菌效果最强。光照12 h灭菌率达到70%左右,24 h后细菌可全部被杀死。可见光光照下,光催化材料价带上产生光生空穴,半导体内部形成电子-空穴对,光生电子和光生空穴可直接与细胞壁、细胞膜以及细胞的组成成分反应,引起细菌死亡[19]。同时,光生空穴也可以将光催化材料表面吸附的OH-或H2O氧化成羟基自由基,而光生电子则与表面吸附的O2反应生成超氧自由基,进一步生成羟基自由基和H2O2等多种活性氧类,对细菌进行破坏,导致死亡[20]。
目前,光催化材料杀菌机理主要有两种,一是光催化剂与目标细菌直接接触导致细胞死亡[21],二是由于光催化反应过程中,细胞壁被破坏,细菌稳定性降低,内部物质泄漏最终导致细菌死亡[22]。细菌灭活机理实验表明,由于钾离子在细菌的多核糖体循环和细胞蛋白质的合成中起重要作用,因此可用大肠杆菌中钾离子的释放量来考察细胞膜的渗透性变化[23, 24]。结果表明细菌细胞的钾离子释放变化趋势低于相对应的灭菌率,因为部分细菌的膜可能受损不严重,尤其是细胞质膜仍未损坏,不泄漏出钾离子,但是细胞已经失去活性[25, 26]。因此,可初步判定BiOBr光催化材料灭菌机理为细胞壁等被破坏导致细菌失去活性,最终死亡。
4 结论采用溶剂热一步合成法制备的光催化材料BiOBr,通过SEM、XRD、UV-vis表征测试表明材料为直径为2 µm左右的3D分级微球结构,利于电子空穴对的分离,对可见光有一定的光响应。通过3种材料浓度灭菌研究表明,材料浓度为0.5 mg/mL时光催化灭菌效果最佳,可见光照射12 h后,大肠杆菌的灭活率可达70%。菌液初始浓度越高,灭菌效果越差。通过初步分析灭菌机理,可见光照射前后大肠杆菌TEM图,钾离子泄漏量和活/死细菌染色荧光显微镜图表明细菌细胞膜被破坏。BiOBr光催化灭菌过程中空穴为主要的活性基团。
| [1] | 吴东海, 尤宏, 刘巍巍, 等. 载银TiO2薄膜制备及其光催化灭菌性能. 化工学报 , 2009, 60 (7) : 1693–1699. |
| [2] | 董丽丽, 黄骏雄. 饮用水消毒副产物及其分析技术. 化学进展 , 2005, 17 (2) : 350–358. |
| [3] | Koivunen J, Tanski H. Inactivation of enteric microorganisms with chemical disinfectants, UV irradiation and combined chemical/UV treatments. Water Research , 2005, 39 (8) : 1519–1526. DOI:10.1016/j.watres.2005.01.021 |
| [4] | 常青云, 贺泓, 曲久辉, 等. Ag-Ce/AlPO4催化剂在水中催化杀菌的影响因素. 催化学报 , 2008, 29 (3) : 215–220. |
| [5] | 崔玉民, 王洪涛. 二氧化钛光催化技术在污水处理领域中应用. 水处理技术 , 2009, 35 (4) : 9–12. |
| [6] | 刘佳佳, 王军, 张霞, 等. 一种新型铋基光催化剂的合成及其可见光催化性能. 环境工程学报 , 2015, 9 (6) : 2923–2930. |
| [7] | Matsunaga T, Tomoda R, Nakajima T, et al. Continuous sterilization system that uses photo semiconductor powders. Applied and Environmental Microbiology , 1988, 54 (6) : 1330–1333. |
| [8] | Chang W, Lin W, Zulkarnain Z, et al. Bactericidal activity of TiO2 photocatalyst in aqueous media:toward a solar-assisted water disinfection system. Environmental Science and Technology , 1994, 28 : 934–938. DOI:10.1021/es00054a027 |
| [9] | Huang Z, Maness P, Blake D, et al. Bactericidal mode of titanium dioxide photocatalysis. Journal of Photochemistry and Photobiology A:Chemistry , 2000, 130 : 163–170. DOI:10.1016/S1010-6030(99)00205-1 |
| [10] | Yang L, Yu L, Madhumita B, et al. Photocatalytic oxidation of paracetamol:Dominant reactants, intermediates, and reaction mechanisms. Environmental Science & Technology , 2009, 43 (2) : 460–465. |
| [11] | Zhao H, Yu H, Quan X, et al. Fabrication of atomic single layer graphitic-C3N4 and its high performance of photocatalytic disinfection under visible light irradiation. Applied Catalysis B:Environmental , 2014 (152) : 46–50. |
| [12] | Wang W, Yu Y, An T, et al. Visible-light-driven photocatalytic inactivation of E. coli K-12 by bismuth vanadate nanotubes:Bactericidal performance and mechanism. Environ Sci Technol , 2012 (46) : 4599–4606. |
| [13] | 刘红旗, 顾晓娜, 陈锋, 等. BiOCl纳米片微球的制备及其形成机理. 催化学报 , 2011, 32 (1) : 129–134. |
| [14] | Liu H, Cao W, Su Y, et al. Synthesis, characterization and photocatalytic performance of novel visible light induced Ag/BiOI. Applied Catalysis B:Environmental , 2012, 111 : 271–279. |
| [15] | Zhang D, Wen M, Jiang B, et al. Ionothermal synthesis of hierarchical BiOBr microspheres for water treatment. Journal of Hazardous Materials , 2012, 211 : 104–111. |
| [16] | Shi X, Chen X, Chen X, et al. Solvothermal synthesis of BiOI hierarchical spheres with homogeneous sizes and their high photocatalytic performance. Material Letters , 2012, 68 : 296–299. DOI:10.1016/j.matlet.2011.10.063 |
| [17] | Cheng H, Huang B, Wang Z, et al. One-pot Miniemulsion-Mediated route to BiOBr hollow microspheres with highly efficient photocatalytic activity. Chemistry-A European Journal , 2011 (17) : 8039–8043. |
| [18] | 林立, 黄满红, 龙立平, 等. 分级微球BiOBr和BiOI的制备及光催化活性比较. 应用化工 , 2014, 43 (8) : 1377–1380. |
| [19] | 张丽, 刘又年. 光催化杀菌机理研究进展. 湖南理工学院学报:自然科学版 , 2011, 24 (3) : 62–65. |
| [20] | Benabbou AK, Derriche Z, Felix C, et al. Photocatalytic inactivation of Escherichia coli-Effect of concentration of TiO2 and microorganism, nature, and intensity of UV irradiation. Applied Catalysis B-Environmental , 2007, 76 (3) : 257–263. |
| [21] | Matsunaga T, Tomada R, Nakajima T, et al. Photo-electro chemical sterilization of microbial-cells by semiconductor powders. FEMS Microbiol Lett , 1985 (29) : 211–214. |
| [22] | Saito T, Iwase T, Morioka T. Mode of photocatalytic bactericidal action of powdered semiconductor TiO2 on mutans streptococci. J Photochem Photobiol B , 1992 (14) : 369–379. |
| [23] | 郭健, 胡学康, 王爱民, 等. NiO/SrBi2O4可见光催化杀菌的研究. 环境化学 , 2007, 26 (2) : 207–209. |
| [24] | Lu Z, Zhou L, Zhang Z, et al. Cell damage induced by photo-catalysis of TiO2 thin films. Langmuir , 2009, 19 (21) : 8765. |
| [25] | Li Y, Ma M, Wang X, et al. Inactivated properties of activated carbon-supported TiO2 nanoparticles for bacteria and kinetic study. Journal of Environmental Sciences-China , 2008, 20 : 1527–1533. DOI:10.1016/S1001-0742(08)62561-9 |
| [26] | Ren J, Wang W, Zhang L, et al. Photocatalytic inactivation of bacteria by photocatalyst Bi2WO6 under visible light. Catalysis Communications , 2009, 10 : 1940–1943. DOI:10.1016/j.catcom.2009.07.006 |




