抗体类药物具有靶点明确、副作用小等优点,已被广泛应用于癌症、自身免疫性疾病、器官移植后排异以及各类炎症的治疗[1]。运用动物细胞大规模培养技术高效生产抗体类药物已成为了当今生物医药产业的核心技术。其中CHO细胞具有高效的蛋白质翻译后修饰功能以及较低的宿主蛋白分泌,已被广泛应用于复杂蛋白质,尤其是抗体类药物的生产。作为一类糖蛋白,抗体类药物在动物细胞表达过程中会发生一系列的翻译后修饰,如糖基化、C末端赖氨酸的切除、N末端谷氨酰胺的环化等,同时存在许多物理和化学降解,如天冬酰胺的去酰胺化、天冬氨酸的异构化、二硫键的还原等,从而导致单克隆抗体异质性的产生[2]。这些抗体的异质性往往体现在糖型的差异、电荷的差异、分子量的差异以及疏水性的差异。
抗体的电荷异质性是由于翻译后修饰和降解导致抗体所带的净电荷或电荷空间分布发生了改变。这类变体可以通过离子交换色谱、疏水作用色谱和毛细管等电聚焦等方法进行分离和鉴定。在阳离子交换色谱中,抗体的酸性变体和碱性变体分别指洗脱时间小于和大于主峰的那部分电荷变体。其中酸性变体主要由天冬酰胺去酰胺化、赖氨酸的糖化、二硫键的错误连接、糖基化(唾液酸)等引起,而碱性变体则主要由赖氨酸变体、焦谷氨酸的形成、天冬氨酸的异构化、甲硫氨酸的氧化等引起。赖氨酸变体是由于抗体C末端赖氨酸的不完全酶切而引起的,它的存在会抑制补体的激活,进而影响抗体补体依赖的细胞毒作用(Complement dependent cytotoxicity,CDC)活性,是一类重要的碱性变体[3]。此外,抗体电荷变体的存在还会引起抗体稳定性、生物学活性、药物动力学、免疫原性等抗体结构和功能的改变[4],是抗体类药物的关键质量属性(Critical quality attribution,CQA)之一。因此,在单克隆抗体生产过程中,需要对其电荷变体含量进行严格的监测和控制。
金属离子是动物细胞无血清培养过程中一类重要的添加剂。研究表明,培养基中金属离子的浓度对CHO细胞的生长、代谢以及抗体的表达都具有一定的影响[5]。近年来,越来越多的研究开始关注金属离子对抗体质量方面的影响,如聚体[6]、碎片[7]、糖基化[8]、脯氨酸酰胺化[9]等。然而,细胞培养过程是一个复杂的非均相反应体系,其中涉及细胞的生理状态、底物的供给和相互交织的调控网络。因此,在保证抗体产量的前提下如何有效控制抗体的电荷异质性仍是抗体类药物生产过程中遇到的关键问题之一。为此,本研究以表达单克隆抗体的CHO细胞为研究对象,考察铜离子和锌离子在细胞生长、抗体表达以及抗体电荷分布中发挥的作用,旨在为动物细胞培养基中金属离子的浓度提供合理的操作空间,从而为抗体类药物生产过程中电荷异质性的有效控制奠定基础。
1 材料与方法 1.1 材料本研究所用细胞为一株表达人源化单克隆抗体的重组CHO细胞株。所使用的培养基为本实验室开发具有自主知识产权的无血清培养基。专利号为:CN 104328158 A。培养基配制所用试剂均购自Sigma-Aldrich公司。培养基配制完后经0.22 µm微孔滤膜(Millipore)过滤除菌使用。
1.2 方法 1.2.1 种子细胞培养从细胞库中复苏CHO细胞,以5.0×105 cells/mL的活细胞密度接种于125 mL摇瓶(Corning),接种体积为30 mL,置于37℃、5% CO2饱和湿度的培养箱中进行悬浮培养,摇床转速为120 r/min。每隔2 d进行种子细胞传代扩增,传代后活细胞密度控制在5.0×105 cells/mL左右。
1.2.2 批式培养取指数生长期的CHO种子细胞,经1 000 r/min离心5 min,弃上清,用新鲜(不含铜离子和锌离子)培养基进行重悬。以1.0×106 cells/mL的活细胞密度接种于125 mL摇瓶,接种体积为30 mL。根据实验设计额外添加所需的硫酸铜和硫酸锌浓缩液。将摇瓶置于37℃、5% CO2湿度饱和的培养箱中进行悬浮培养,摇床转速为120 r/min。每组实验重复3次。培养过程中每天取样1 mL进行细胞计数,经10 000 r/min离心5 min后取上清液于-80℃保存,用于抗体产量和质量的检测。
1.2.3 细胞计数细胞密度采用血球计数板进行计算,并用台盼蓝拒染法确定细胞的活性。
1.2.4 抗体浓度检测抗体浓度采用亲和色谱的方法进行检测,色谱柱为POROS Protein A affinity column,4.0×50 mm(Applied Biosystems),具体步骤见参考Yang等[10]的方法。
1.2.5 抗体纯化抗体纯化采用亲和层析的方法,层析柱为HiTrap Protein A HP(GE Healthcare),具体方法步骤见产品说明书。
1.2.6 抗体电荷变体检测抗体的电荷变体采用弱阳离子交换色谱进行检测,色谱柱为ProPac WCX-10 column,4.0×250 mm(Dionex),具体步骤参考Zhang等[11]方法。为了检测碱性变体中赖氨酸变体的含量,将纯化后抗体用羧肽酶B进行酶切(37℃,30 min),对比酶切前后抗体的弱阳离子交换色谱图即可计算出赖氨酸变体的含量。图 1为典型的弱阳离子交换色谱图及羧肽酶酶切示意图。
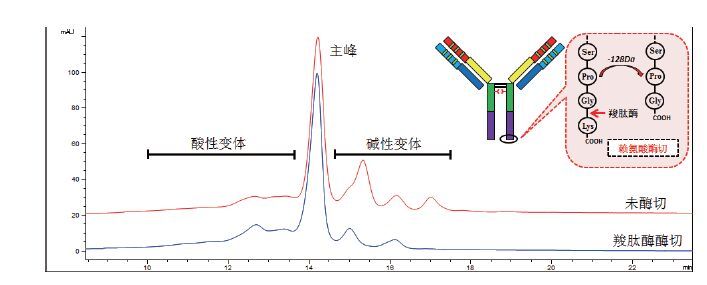
|
| 图 1 典型弱阳离子交换色谱图 |
抗体的比生成速率qmAb(mg/109cells/day)通过以下公式进行计算:
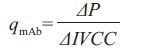
其中,P为抗体浓度(mg/L);IVCC为活细胞密度对时间的积分(109 cells·day/L)。
2 结果 2.1 铜离子对CHO细胞生长、抗体表达以及抗体电荷分布的影响为了研究铜离子对CHO细胞生长、抗体表达以及抗体电荷分布的影响,向起始培养基中添加不同量的硫酸铜浓缩液使铜离子浓度分别为0、10、50、120、200、400、1 000和50 000 nmol/L。同时将锌离子浓度调整到10 µmol/L(无血清培养基中锌离子的原始浓度)。
2.1.1 铜离子对CHO细胞生长、抗体表达的影响批式培养过程中,CHO细胞在不同铜离子浓度条件下的生长曲线(图 2-A)显示,当培养基中不含铜离子(0 nmol/L)时,细胞生长到第3天时达到最大活细胞密度为4.0×106 cells/mL,随后细胞逐渐死亡,培养结束时(10 day),活细胞密度仅为0.4×106 cells/mL。随着铜离子浓度的升高,批式培养所能达到的最大活细胞密度呈现出先上升后下降的趋势。当铜离子浓度为120 nmol/L时,批式培养所能达到的最大活细胞密度最高,为5.9×106 cells/mL。同时更有利于活细胞密度的维持,培养结束时,活细胞密度仍有4.5×106 cells/mL。随着铜离子浓度的进一步升高(>120 nmol/L),培养过程所能达到的最大活细胞密度逐渐下降。当铜离子浓度达到50 000 nmol/L时,批式培养所能达到的最大活细胞密度下降到4.8×106 cells/mL。此外,随着铜离子浓度的升高,活细胞密度对时间的积分(IVCC,图 2-B)、最终抗体浓度(Titer,图 2-C)以及抗体的比生成速率(qmAb,图 2-D)也呈现出先上升后下降的趋势。当铜离子浓度为120 nmol/L时,IVCC和最终抗体浓度都达到最高值,分别为不含铜离子条件下的1.65倍和2.39倍。而当铜离子浓度为1 000 nmol/L时,抗体的比生成速率达到最大,为不含铜离子条件下的1.62倍。

|
| 图 2 不同铜离子浓度下CHO细胞的生长(A)、活细胞密度对时间的积分(B)、抗体浓度(C)以及抗体比生产速率(D)情况 *P<0.05与不含铜离子条件相比 |
此外,考察了不同铜离子浓度条件下抗体的电荷分布情况,结果(图 3)显示,当培养基中不含铜离子时,抗体中酸性变体、主峰以及碱性变体含量分别为33.17%、49.63%和17.19%。通过羧肽酶B的酶切实验发现,其中7.14%的碱性变体来自于赖氨酸变体。当铜离子浓度小于50 nmol/L时,随着铜离子浓度的升高,抗体酸性变体含量随之下降,而主峰、碱性变体以及赖氨酸变体含量则随之上升。对比碱性变体和赖氨酸变体含量(图 3-C)发现,碱性变体含量的提高是由于赖氨酸变体含量的上升所导致的。当铜离子浓度为50 nmol/L时,抗体的主峰含量达到最高,为54.10%。此时,抗体酸性变体、碱性变体以及赖氨酸变体含量分别为26.6%、19.3%和9.3%。随着铜离子浓度的进一步升高(<400 nmol/L),抗体的酸性变体含量进一步下降,主峰含量由上升转为下降,同时碱性变体以及赖氨酸变体含量进一步上升。当铜离子浓度为400 nmol/L时,抗体的酸性变体含量达到最低,为24.46%,而抗体的碱性变体以及赖氨酸变体同时达到最高,分别为23.20%和13.59%。当进一步提高铜离子浓度时(>400 nmol/L),抗体的酸性变体含量由下降转为上升,同时主峰含量进一步下降,碱性变体和赖氨酸变体的含量略有下降。
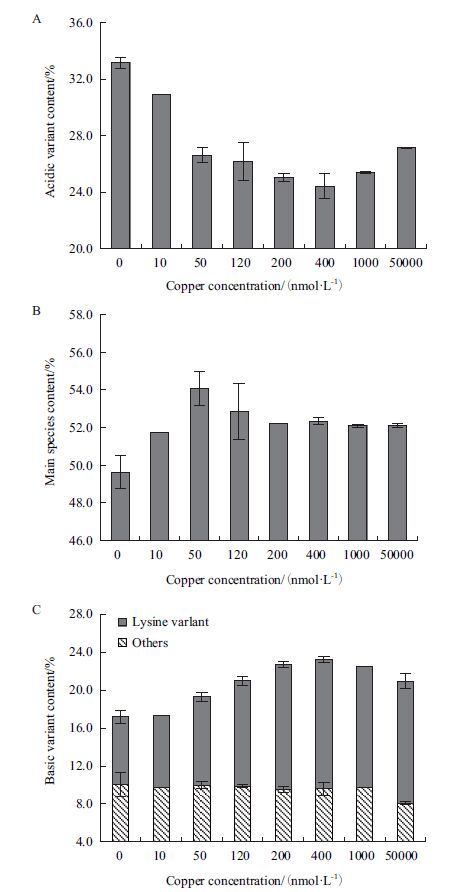
|
| 图 3 不同铜离子浓度下抗体电荷分布情况 A:酸性变体含量;B:主峰含量;C:碱性变体含量 |
以上结果表明,铜离子对CHO细胞的生长、抗体表达以及抗体的电荷分布均有显著影响。其中120 nmol/L的铜离子浓度最适合细胞的生长以及抗体的表达,而50 nmol/L的铜离子浓度则最有利于减少抗体的电荷变体,获得较高的主峰含量。
2.2 锌离子对CHO细胞生长、抗体表达以及抗体电荷分布的影响为了研究锌离子对CHO细胞生长、抗体表达以及抗体电荷分布的影响,向起始培养基中添加不同量的硫酸锌浓缩液使锌离子浓度分别为0、0.2、0.4、0.6、1、10、50和200 µmol/L。同时将铜离子浓度调整到120 nmol/L(无血清培养基中铜离子的原始浓度)。
2.2.1 锌离子对CHO细胞生长、抗体表达的影响批式培养过程中,CHO细胞在不同锌离子浓度条件下的生长曲线(图 4-A)显示,当培养基中不含锌离子时,细胞生长到第2天时就达到最大活细胞密度为2.2×106 cells/mL。随后细胞迅速进入衰亡期,培养到第6天时,活细胞密度下降到0。随着培养基中锌离子浓度的升高,批式培养所能达到的最大活细胞密度呈现出先上升后下降的趋势。当锌离子浓度为50 µmol/L时,批式培养所能达到的最大活细胞密度最高,为4.9×106 cells/mL,同时延长了活细胞密度的维持,培养结束时,活细胞密度仍有3.1×106 cells/mL。随着锌离子浓度的进一步升高(>50 µmol/L),培养过程所能达到的最大活细胞密度逐渐下降。当锌离子浓度达到200 µmol/L时,批式培养所能达到的最大活细胞密度下降到4.0×106 cells/mL。此外,随着锌离子浓度的升高,IVCC(图 4-B)和最终抗体浓度(图 4-C)也呈现出先上升后下降的趋势。当锌离子浓度为50 µmol/L时,IVCC和最终抗体浓度同时达到最高值,分别为不含锌离子条件下的3.74倍和11.28倍。而抗体的比生成速率随着锌离子浓度的升高而一直上升(图 4-D),当锌离子浓度达到最高时(200 µmol/L),抗体的比生成速率为不含锌离子条件下的2.49倍。

|
| 图 4 不同锌离子浓度下CHO细胞的生长(A)、活细胞密度对时间的积分(B)、抗体浓度(C)以及抗体比生产速率(D)情况 *P<0.05和不含锌离子条件相比 |
此外,考察了不同锌离子浓度条件下抗体的电荷分布情况,结果(图 5)显示,当培养基中不含锌离子时,抗体中酸性变体、主峰以及碱性变体含量分别为31.97%、32.38%和35.65%,其中21.79%的碱性变体来自于赖氨酸变体。当锌离子浓度小于50 µmol/L时,随着锌离子浓度的升高,抗体酸性变体、碱性变体以及赖氨酸变体含量都随之下降,同时主峰含量逐渐上升。对比碱性变体和赖氨酸变体含量发现,碱性变体含量的下降主要是由于赖氨酸变体含量的降低所导致的。当锌离子浓度为50 µmol/L时,抗体酸性变体含量达到最低,为18.64%,同时主峰含量达到最高,为54.53%。随着锌离子浓度的进一步升高(>50 µmol/L),抗体酸性变体含量由下降转为上升,主峰含量由上升转为下降,同时碱性变体和赖氨酸变体含量进一步下降。当锌离子浓度达到200 µmol/L时,抗体的酸性变体、主峰、碱性变体以及赖氨酸变体含量分别为24.18%、53.52%、22.30%和3.05%。

|
| 图 5 不同锌离子浓度下抗体电荷分布情况 A:酸性变体含量;B:主峰含量;C:碱性变体含量 |
以上结果表明,锌离子对CHO细胞的生长、抗体表达以及抗体电荷分布具有显著影响。其中锌离子浓度为50 µmol/L时最适合细胞的生长以及抗体的表达,同时有利于减少抗体的电荷变体,获得较高的主峰含量。
2.3 铜离子和锌离子对抗体电荷分布的影响从以上结果可以看出,铜离子和锌离子对抗体赖氨酸变体含量起着相反的作用。为此,进一步考察了铜离子和锌离子两者之间的比例对抗体赖氨酸变体的影响。17个不同铜离子和锌离子比例条件下赖氨酸变体的含量情况(图 6-A)显示,当铜/锌[(nmol/L)/(µmol/L)]比例为0.6时,赖氨酸变体的含量只有3.05%。随着铜/锌比例的升高,赖氨酸变体的含量也随之上升。当铜/锌比例为600时,赖氨酸变体的含量上升到了21.79%。这些数据进一步说明了铜离子和锌离子在抗体C末端赖氨酸的酶切过程中所发挥的相反的作用,调节两者之间的比例是控制抗体赖氨酸变体含量的有效手段。

|
| 图 6 铜离子和锌离子对抗体电荷分布的影响 A:铜离子和锌离子比例对抗体赖氨酸变体的影响;B:铜离子和锌离子对抗体主峰的影响 |
抗体电荷变体的有效控制是抗体类药物生产过程中过程优化和控制的关键。根据质量设计(quality by design,QbD)的基本理念,为了确定合适的操作空间,进一步考察了不同铜离子和锌离子条件下抗体的主峰含量,并做出主峰含量的等高线图(图 6-B)。如图所示,在我们的考察范围内(图 6-B右侧实线范围内),颜色越深,代表主峰含量越高。当锌离子低于10 µmol/L时,抗体主峰含量均低于50%,且随着锌离子浓度的增加,抗体主峰含量显著上升。当锌离子高于10 µmol/L时,抗体主峰含量均高于50%,且当铜离子浓度为50 nmol/L左右时,抗体主峰含量达到最高。可以看出,抗体的主峰含量由铜、锌离子浓度以及两者的配比共同决定。为了有效地控制电荷变体含量,需要将铜、锌离子控制在一个合适的浓度范围内,即操作空间。
3 讨论作为动物细胞培养过程中不可或缺的一部分,金属离子在细胞的生长、代谢、抗体的表达以及抗体质量等方面都发挥着重要的作用。本研究以一株表达单克隆抗体的CHO细胞为对象,综合考察了铜离子和锌离子对细胞生长、抗体表达以及抗体电荷分布的影响。
在细胞生长和抗体表达方面,过低或过高的铜离子和锌离子均抑制了CHO细胞的生长和活细胞密度的维持,进而影响了抗体的表达。铜离子是细胞培养过程中一种重要的微量元素,它是细胞有氧代谢途径中诸多关键酶的辅因子[12]。在铜离子不足的情况下,细胞的有氧代谢将受到抑制,乳酸等代谢副产物会大量积累,最终导致抗体表达水平的下降和细胞的死亡。同时,铜离子具有调节细胞氧化还原状态的作用,高浓度的铜离子会使胞内累积大量的活性氧物质(ROS),对细胞产生毒副作用,进而影响细胞的生长和抗体的表达。锌离子是细胞培养过程中另一种重要的微量元素,细胞内有超过300个关键性的细胞过程,包括DNA和蛋白质的合成、有丝分裂、细胞扩增、能量代谢和信号转导,需要锌离子的参与[13]。在动物细胞无蛋白悬浮培养过程中,锌离子往往被作为胰岛素的替代物来添加[14]。此外,锌离子还具有提高mRNA稳定性和抗细胞凋亡的作用[15]。因此,锌离子的不足将直接影响到葡萄糖的利用和细胞代谢,进而影响到细胞的生长以及产物的表达。同时,作为重金属,高浓度的锌离子同样会给细胞带来毒副作用。本研究发现,50 µmol/L的锌离子浓度最适合CHO细胞的生长以及抗体的表达,该结果与Kim等[13]的研究结论基本一致。
在抗体的电荷分布方面,高浓度的铜离子提高了抗体赖氨酸变体含量,进而提高了碱性变体含量(图 3-C)。相反,高浓度的锌离子则降低了抗体赖氨酸变体含量,进而降低了碱性变体含量(图 5-C)。两者之间的比例对抗体赖氨酸变体的含量发挥着重要的调节作用(图 6-A)。赖氨酸变体是由于抗体重链C末端赖氨酸的不完全酶切而引起的,是一类重要的碱性电荷变体。在我们前期的研究中发现,碱性羧肽酶B(CpB)和碱性羧肽酶H(CpH)是CHO细胞中两种主要的负责抗体C末端赖氨酸酶切的羧肽酶,它们的表达及活性受温度、pH以及各类抑制剂的调节[11, 16]。此外,有文献[17]报道,铜离子和锌离子分别是碱性羧肽酶的抑制剂和辅因子,它们的浓度和比例将直接影响到羧肽酶的活性,进而影响抗体赖氨酸变体以及碱性变体的含量。另一方面,过高或过低的铜离子和锌离子均导致了较高的酸性变体(图 3-A和图 5-A),这可能与铜离子和锌离子所发挥的氧化还原作用有关。Hossler等[18]研究表明,培养基中氧化还原剂的添加可以有效地调节抗体的酸性变体。此外,铜离子和锌离子还会影响到抗体聚体和碎片的含量[6, 7],而聚体和碎片恰恰与抗体的电荷分布密切相关[19]。
抗体的电荷异质性是评价抗体质量优劣的一项重要指标。然而,电荷变体由于其种类繁多、分离鉴定困难且形成机制复杂,如何有效地控制其含量已成为抗体类药物生产过程中一个普遍的难题。本研究通过对铜、锌离子重要性的研究,以及对其操作空间的讨论,为动物细胞无血清培养基的开发及抗体类药物电荷异质性的有效过程控制奠定了基础。
4 结论本研究通过运用过程分析技术(Process analyti-cal technology,PAT)对影响抗体电荷分布的两个关键过程参数(Critical process parameters,CPPs)铜离子和锌离子进行了考察。结果表明,铜离子和锌离子对CHO细胞的生长、抗体表达以及抗体的电荷分布都有显著影响。调节两者的浓度和配比是控制抗体电荷变体的有效手段。
| [1] | Aggarwal RS. What’s fueling the biotech engine-2012 to 2013. Nat Biotechnol , 2014, 32 : 32–39. DOI:10.1038/nbt.2794 |
| [2] | Liu H, Gaza-Bulseco G, Faldu D, et al. Heterogeneity of monoclonal antibodies. J Pharm Sci , 2008, 97 (7) : 2426–2447. DOI:10.1002/jps.21180 |
| [3] | Van den Bremer ET, Beurskens FJ, Voorhorst M, et al. Human IgG is produced in a pro-form that requires clipping of C-terminal lysines for maximal complement activation. MAbs , 2015, 7 (4) : 672–680. DOI:10.1080/19420862.2015.1046665 |
| [4] | Eon-Duval A, Broly H, Gleixner R. Quality attributes of recombinant therapeutic proteins:an assessment of impact on safety and efficacy as part of a quality by design development approach. Biotechnol Prog , 2012, 28 (3) : 608–622. DOI:10.1002/btpr.1548 |
| [5] | Luo J, Vijayasankaran N, Autsen J, et al. Comparative metabolite analysis to understand lactate metabolism shift in Chinese hamster ovary cell culture process. Biotechnol Bioeng , 2012, 109 (1) : 146–156. DOI:10.1002/bit.v109.1 |
| [6] | Chaderjian WB, Chin ET, Harris RJ, et al. Effect of copper sulfate on performance of a Serum-Free CHO Cell culture process and the level of free thiol in the recombinant antibody expressed. Biotechnol Prog , 2005, 21 (2) : 550–553. |
| [7] | Kao YH, Hewitt DP, Trexler-Schmidt M, et al. Mechanism of antibody reduction in cell culture production processes. Biotechnol Bioeng , 2010, 107 (4) : 622–632. DOI:10.1002/bit.22848 |
| [8] | Surve T, Gadgil M. Manganese increases high mannose glycoform on monoclonal antibody expressed in CHO when glucose is absent or limiting:Implications for use of alternate sugars. Biotechnol Prog , 2015, 31 (2) : 460–467. DOI:10.1002/btpr.v31.2 |
| [9] | Kaschak T, Boyd D, Lu F, et al. Characterization of the basic charge variants of a human IgG1:effect of copper concentration in cell culture media. MAbs , 2011, 3 (6) : 577–583. DOI:10.4161/mabs.3.6.17959 |
| [10] | Yang JD, Lu C, Stasny B, et al. Fed-batch bioreactor process scale-up from 3-L to 2500-L scale for monoclonal antibody production form cell culture. Biotechnol Bioeng , 2007, 98 (1) : 141–154. DOI:10.1002/(ISSN)1097-0290 |
| [11] | Zhang X, Tang H, Sun YT, et al. Elucidating the effects of arginine and lysine on a monoclonal antibody C-terminal lysine variation in CHO cell cultures. Appl Microbiol Biotechnol , 2015, 99 (16) : 6643–6652. DOI:10.1007/s00253-015-6617-y |
| [12] | Yuk IH, Russell S, Tang Y, et al. Effects of copper on CHO cells:cellular requirements and product quality considerations. Biotechnol Prog , 2015, 31 (1) : 226–238. DOI:10.1002/btpr.v31.1 |
| [13] | Kim BG, Park HW. High zinc ion supplementation of more than 30 muM can increase monoclonal antibody production in recombinant Chinese hamster ovary DG44 cell culture. Appl Microbiol Biotechnol , 2016, 100 (5) : 2163–2170. DOI:10.1007/s00253-015-7096-x |
| [14] | Wong VV, Ho KW, Yap MG. Evaluation of insulin-mimetic trace metals as insulin replacements in mammalian cell cultures. Cytotechnology , 2004, 45 (3) : 107–115. DOI:10.1007/s10616-004-6173-2 |
| [15] | Cao H. Expression, purification, and biochemical characterization of the antiinflammatory tristetraprolin:a zinc-dependent mRNA binding protein affected by posttranslational modifications. Biochemistry , 2004, 43 (43) : 13724–13738. DOI:10.1021/bi049014y |
| [16] | Zhang X, Sun YT, Tang H, et al. Culture temperature modulates monoclonal antibody charge variation distribution in Chinese hamster ovary cell cultures. Biotechnol Lett , 2015, 37 (11) : 2151–2157. DOI:10.1007/s10529-015-1904-3 |
| [17] | 吴珊, 李素霞. 重组猪羧肽酶B的酶学性质及稳定性研究. 食品与药品 , 2012, 14 (5) : 159–162. |
| [18] | Hossler P, Wang M, McDermott S, et al. Cell culture media supplementation of bioflavonoids for the targeted reduction of acidic species charge variants on recombinant therapeutic proteins. Biotechnol Prog , 2015, 31 (4) : 1039–1052. DOI:10.1002/btpr.2095 |
| [19] | Du Y, Walsh A, Ehrick R, et al. Chromatographic analysis of the acidic and basic species of recombinant monoclonal antibodies. MAbs , 2012, 4 (5) : 578–585. DOI:10.4161/mabs.21328 |




