2. 大连大学医学院,大连 116622;
3. 辽东学院农学院,丹东 118003
2. Medical College,Dalian University,Dalian 116622;
3. Agriculture College of Eastern Liaoning University,Dandong 118003
大肠杆菌是内膜和外膜组成的双层膜结构,在内外膜之间的区域称为周质空间(Periplasmic Space)[1-3],在大肠杆菌周质空间的氧化环境有利于重组蛋白正确折叠,形成正确的二硫键,直接形成具有生物活性的重组蛋白,在周质空间中蛋白质更稳定[4]。而胞内表达重组蛋白多为包涵体,这种表达方式产量虽高,但要经过变性-复性等复杂步骤后才能获得活性蛋白,且只能部分蛋白获得活性[1-5]。分泌表达是在信号肽Mel、OmpA、PelB、PheA 的引导下,分泌到大肠杆菌周质空间,同时完成二硫键形成与肽链折叠,成为有活性的蛋白分子,但是这种表达方式产量较低,不易分离纯化[5]。
类弹性蛋白(Elastin-like polypeptide,ELP)是基因工程方法合成,对温度敏感的新型重组蛋白分离纯化标签。由五肽重复序列单元(VPGXG)n串联组成,其中X(除脯氨酸外的任意一种氨基酸)称为客座残基,n代表ELP链中五肽重复次数[6]。ELP具有温度诱导的可逆相变性质,并且ELP融合蛋白仍然具有这种特性[7, 8]。多次可逆相变循环(Inverse transition cycling,ITC)之后,可以选择性地分离出ELP融合蛋白。这种非色谱分离纯化重组蛋白方法,具有技术简单、成本低廉,节省时间,易于扩大等优点[9]。目前,类弹性蛋白作为蛋白质分离纯化标签在大肠杆菌胞内已经有系统的研究报道,但是尚未见在大肠杆菌周质空间中表达研究报道,ELP标签能否在分泌信号引导下在大肠杆菌周质空间中正确表达需要进行研究。
本研究拟采用硫氧还蛋白(Thioredoxin,Trx)[10]为模式蛋白[7, 11, 12],对周质空间中表达的ELP[I]40和ELP[I]40+Trx理化性质进行分析,并考察不同影响因子对ELP[I]40、ELP[I]40+Trx的影响,旨在研究ELP[I]40及ELP[I]40+Trx在大肠杆菌周质空间中表达情况。
1 材料与方法 1.1 材料限制性内切酶EcoRⅤ、HindⅢ、EcoRⅠ、XhoⅠ、NcoⅠ、T4 DNA连接酶、T4 DNA聚合酶、碱性磷酸酶(BAP)、DL2000 DNA Marker及IPTG购自TaKaRa公司;DNA KB Marker购自Invitrogen公司;限制性内切酶Dra Ⅲ、1 kb DNA Ladder、PageRulerTM Prestained Protein Ladder购自Fermentas公司;氨苄青霉素(Amp)购自生工生物工程(上海)有限公司;TMB显色液购自Sigma公司;ELP[I]40基因由本实验室设计并构建[13],大肠杆菌周质空间表达载体pIG6LH(图 1)由瑞士苏黎世大学Andreas Plückthun 教授惠赠(Professor Andreas Plückthun,University of Zurich,Switzerland),该载体在目的基因上游引入编码大肠杆菌分泌信号肽ompA序列,可使表达的目的蛋白分泌到质周腔中,有利于表达具有二硫键的目的蛋白;甲醇为分析纯;根据pET28(+)含有的6×his与pIG6基因序列设计PCR引物:P1为5'-CCGATATCACCATGGGCAGCAGCCA-3',P2为5'-CCGATATCTTAGCAGCCGGATCTCAGTG-3';P1含有EcoRⅤ、NcoⅠ酶切位点,P2含有EcoRⅤ酶切位点,引物委托生工生物工程(上海)有限公司合成,HAP纯化。

|
| 图 1 pIG6LH表达载体 |
为了ELP[I]n初次分泌到大肠杆菌周质空间表达后,能够利用6×his标签进行常规检测,本实验构建了含有6×his的表达载体pIG6LH。以pET28(+)为模板,用引物P1:5'-CCGATATCACCATGGGCAGCAGCCA-3'(下划线为EcoR V、Nco Ⅰ酶切位点)、P2:5'-CCGATATCTTAGCAGCCGGATCTCAGTG-3'(下划线为EcoR V酶切位点),进行目的基因6×his的PCR扩增,EcoR V单酶切PCR产物,得到目的基因,大小为196 bp;质粒pIG6进行Hind Ⅲ单酶切,使其线性化并露出3'-末端凹陷的黏性末端。利用T4 DNA 聚合酶对黏性末端补平,EcoRⅤ单酶切由Hind Ⅲ单酶切且末端平滑化的载体片段。将目的基因与线性化载体片段进行连接、转化构建重组质粒,并使用EcoRⅤ、Nco I/Xho I、EcoR V/Nco I对重组质粒进行酶切鉴定。
1.2.2 pIG6LH/ELP[I]40的构建使用限制性内切酶Nco I和Xho I双酶切质粒pAK400LH/ELP[I]40[13],凝胶回收酶切产物(目的基因ELP[I]40,大小为701 bp),将回收产物与周质空间表达载体pIG6LH相连接,连接产物转化入E. coli JM109感受态细胞,用LB/Amp(100 μg/mL)平板筛选阳性克隆,挑单菌落进行PCR验证、NcoⅠ/XhoⅠ双酶切验证,筛选阳性克隆送往南京金斯瑞生物科技有限公司测序。构建成功的表达载体命名为pIG6LH/ELP[I]40。
1.2.3 pIG6LH/ELP[I]40+Trx的构建根据GenBa-nk中Trx基因序列,设计在其两端引入EcoR I、Hind Ⅲ酶切识别位点,合成Trx基因序列,由生工生物工程(上海)有限公司合成质粒pUC57/Trx。EcoR Ⅰ/Hind Ⅲ双酶切质粒pUC57/Trx与载体pIG6LH/ELP[I]40,将酶切后的目的基因Trx与pIG6LH/ELP[I]40载体骨架连接,构建的重组质粒命名为pIG6LH/ELP[I]40+Trx,送至南京金斯瑞生物科技有限公司测序鉴定。
1.2.4 ELP[I]40和ELP[I]40+Trx小量表达与Western blot检测提取1.2.2和1.2.3构建正确的表达质粒pIG6LH/ELP[I]40、pIG6LH/ELP[I]40+Trx,并转化入表达宿主菌E. coli BLR(DE3),在LB/Amp(100 μg/mL)平板上筛选转化子。挑取生长状态良好的单克隆,接种于LB/Amp(100 μg/mL)培养液中,37℃振荡过夜培养,次日按1∶100的比例转接于5 mL新鲜LB/Amp(100 μg/mL)中,37℃振荡培养至细菌密度达到OD600=0.6-0.8加入终浓度为0.1 mmol/L的IPTG,25℃诱导3 h后,以1 OD为单位离心收集菌体样品。SDS裂解液裂解菌体,进行Western blot检测表达情况。
1.2.5 ELP[I]40、ELP[I]40+Trx大量表达、纯化与SDS-PAGE电泳分析将表达体系扩大到500 mL,按1.2.4的方法进行蛋白诱导表达,3 600 r/min离心6 min收集菌体,置冰浴中超声波裂解细胞,离心收集上清;加入DNase(DNA酶)使终浓度为50 μg/mL,冰浴20 min,10 000 r/min、离心15 min,弃沉淀,将上清移入新管;向上清液中添加NaCl至终浓度为 2 mol/L,37℃水浴、20 min,10 000 r/min、离心15 min,弃上清,然后加入20 mL预冷的PBS重悬沉淀,冰浴20 min,10 000 r/min、离心15 min,弃沉淀,将上清移入新管(为一轮ITC,此步骤重复3次);经过3轮ITC纯化得到ELP[I]40、ELP[I]40+Trx纯化蛋白,取样进行SDS-PAGE电泳分析。
1.2.6 ELP[I]40和ELP[I]40+Trx蛋白定量与相变温度测定干燥称量法定量ELP[I]40、ELP[I]40+Trx存储液。先将ELP[I]40、ELP[I]40+Trx母液各取1 mL分别于1.5 mL离心管中,将上述母液121℃温度下高压蒸汽灭菌20 min并于60℃干燥箱干燥称量至重量不再变化为止,计算出样品净重。用PBS将ELP[I]40、ELP[I]40+Trx存储母液稀释成25 μmol/L浓度,按每孔100 μL接种于96孔板中,以1℃为梯度用酶标仪(Multiskan GO)测定从16℃-39℃蛋白溶液在350 nm处的吸光度值,升温速率为1℃/5 min。当某个温度下OD350是最大吸光值一半时,该温度为Tt[7]。
1.2.7 ELP[I]40、ELP[I]40+Trx蛋白浓度对相变温度的影响ELP 融合蛋白表达浓度一般较低,利用ITC 技术纯化ELP及ELP融合蛋白的实际应用中,ELP浓度与Tt的关系非常重要,本研究测定了ELP[I]40和ELP[I]40+Trx浓度对Tt的影响。分别将ELP[I]40、ELP[I]40+Trx存储母液配制成浓度依次为10、25、50、75和100 μmol/L,按照1.2.6的测定方法测定0℃-45℃每个蛋白浓度下的Tt。
1.2.8 NaCl对ELP[I]40、ELP[I]40+Trx相变温度的影响本研究所构建的ELP[I]n表达的蛋白,经过Tt测定,已经证实比现有的同分子量的ELP标签的Tt低,是蛋白分离纯化标签的首选,但是考虑到某些亲水性目的蛋白“融合ΔTt效应”,测定了在ITC纯化ELP融合蛋白时常用的盐离子NaCl与Tt的关系。配制2 mol/L的NaCl母液. 用PBS将ELP[I]40、ELP[I]40+Trx储存母液稀释为25 μmol/L,并配成浓度为0.25、0.5、0.75、1.00 和1.25 mol/L的NaCl。按照1.2.6的测定方法测定0℃-45℃范围不同浓度的NaCl对终浓度分别为25 μmol/L的ELP[I]40、ELP[I]40+Trx的Tt影响。
2 结果 2.1 pIG6LH表达载体的构建重组质粒pIG6LH用限制性内切酶EcoRⅤ单酶切,初步鉴定阳性克隆;Nco I/Xho I双酶切,对照重组质粒pIG6LH图谱,切出140 bp基因片段的为修饰正确的载体,第二步鉴定阳性克隆;EcoRⅤ/Nco I双酶切,根据pIG6LH图谱,切出180 bp左右大小的为修饰方向不正确的载体,切出5 kb左右大小的为修饰方向正确的载体,酶切产物经琼脂糖凝胶电泳(图 2)分析,图 2中泳道1最后鉴定为阳性,并送公司测序鉴定。
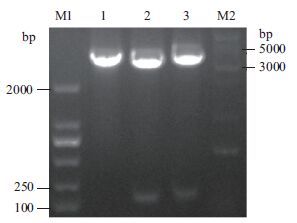
|
| 图 2 EcoR V/Nco I双酶切pIG6LH载体 M1:DL2000 DNA Marker;M2:DNA KB Marker;1:EcoR V单酶切pIG6LH;2:Nco I/Xho I双酶切pIG6LH;3:EcoR V/Nco I双酶切pIG6LH |
Nco I/Xho I双酶切鉴定pIG6LH/ELP[I]40,目的基因为701 bp(图 3);EcoRⅠ/Hind Ⅲ双酶切鉴定pIG6LH/ELP[I]40+Trx,目的基因为417 bp(图 4),经1%琼脂糖凝胶电泳分析表明,均有预计大小的特异性条带,分别选一阳性克隆进行测序鉴定,结果证实周质空间表达载体pIG6LH/ELP[I]40、pIG6LH/ELP[I]40+Trx开放阅读框完全正确,载体构建成功。

|
| 图 3 NcoⅠ/XhoⅠ双酶切pIG6LH/ELP[I]40 M1:DL2000 DNA Marker;M2:DNA KB Marker;1:NcoⅠ/XhoⅠ双酶切pIG6LH/ELP[I]40 |
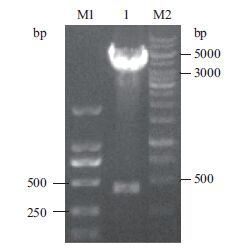
|
| 图 4 EcoRⅠ/HindⅢ双酶切pIG6LH/ELP[I]40+Trx M1:DL2000 DNA Marker;M2:1 kb DNA Ladder;1:EcoRⅠ/Hind Ⅲ双酶切pIG6LH/ELP[I]40+Trx |
将含表达载体pIG6LH/ELP[I]40和pIG6LH/ELP[I]40+Trx的BLR(DE3)菌株经IPTG诱导后分别在37℃和25℃表达,Western blot检测结果(图 5)表明,重组蛋白ELP[I]40和ELP[I]40+Trx均成功分泌到周质空间,分别表达约为20.36 和34.77 kD的特异蛋白条带。但是在37℃诱导表达时,有部分蛋白没有过膜现象,残留信号肽,如图 5-A和5-B中的第2泳道中有两条特异条带,表明有部分重组蛋白未能穿过细胞膜到达质周腔,有信号肽残留。由结果可以看出检测到的蛋白分子量比实际分子量偏大,符合ELP的相关报道[14, 15]。
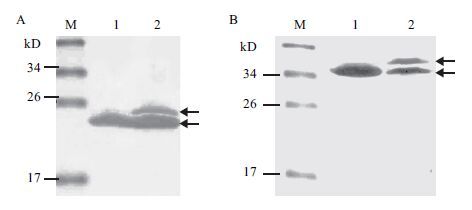
|
| 图 5 Western blot检测ELP[I]40的表达 M:Prestained protein ladder;1:ELP[I]40(A)和ELP[I]40+Trx(B)分别在25℃的表达;2:ELP[I]40(A)和ELP[I]40+Trx(B)分别在37℃的表达 |
选择25℃进行ELP[I]40、ELP[I]40+Trx大量表达,超声破碎后,通过控制温度利用ITC技术纯化蛋白,经3轮ITC循环纯化ELP[I]40(20.36 kD)、ELP[I]40+Trx(34.77 kD)。SDS-PAGE分析(图 6)表明,经3轮ITC纯化得到了ELP[I]40、ELP[I]40+Trx纯蛋白;Gel DocTM EZ imager凝胶成像系统分析表明,蛋白纯度高达90%。说明ELP[I]40作为纯化标签在大肠杆菌周质空间成功应用。

|
| 图 6 SDS-PAGE分析ELP[I]40及ELP[I]40+Trx的表达与纯化 M:Prestained Protein Ladder;1:诱导前总蛋白;2:ELP[I]40诱导后总蛋白;3:ELP[I]40+Trx 诱导后总蛋白;4:经过3轮ITC纯化后的ELP[I]40;5:经过3轮ITC纯化后的ELP[I]40+Trx |
干燥称量法定量ELP[I]40、ELP[I]40+Trx母液浓度。用PBS将ELP[I]40、ELP[I]40+Trx储存母液稀释成25 μmol/L浓度,按每孔100 μL接种于96孔板中,以1℃为梯度用酶标仪测定从16℃-39℃蛋白溶液在350 nm处的吸光度值,升温速率为1℃/5 min。实验结果(图 7)表明ELP[I]40的Tt为29℃,ELP[I]40+Trx的Tt为29.5℃ 。

|
| 图 7 ELP[I]40和ELP[I]40+Trx(浓度均为25 μmol/L)相变温度测定 |
本研究分别测定ELP[I]40、ELP[I]40+Trx 在10、25、50、75和100 μmol/L浓度下的Tt,结果表明,ELP[I]40的Tt依次为31.5℃、29℃、27℃、26℃和25℃,ELP[I]40+Trx的Tt依次为31.8℃、29.5℃、27.5℃、26℃和25.5℃。如图 8所示,蛋白浓度为10 μmol/L时ELP[I]40、ELP[I]40+Trx的Tt分别为31.5℃、31.8℃,将蛋白浓度升高为100 μmol/L时,Tt分别低至25℃、25.5℃。ELP及ELP融合蛋白浓度与Tt呈反比关系,即随着蛋白浓度增加,Tt降低,利于ELP及其融合蛋白的分离纯化工作。蛋白浓度对ELP[I]40和ELP[I]40+Trx的Tt的影响具有相似的趋势。

|
| 图 8 ELP[I]40及ELP[I]40+Trx蛋白浓度对相变温度的影响 |
测定结果(图 9)显示,随着NaCl浓度增高,Tt明显降低,ELP及其融合蛋白具有相似性质[7, 8]。其中在ELP[I]40、ELP[I]40+Trx终浓度为25 μmol/L的条件下,1.25 mol/L的NaCl使Tt分别降至11.5℃、11.8℃。在利用ITC技术纯化ELP融合蛋白的实际应用中,一般需要添加1-3 mol/L的NaCl才能使Tt降至37℃左右[16-18],而本实验设计的ELP[I]40在不添加任何盐离子的情况下,就能达到理想的Tt。

|
| 图 9 NaCl对ELP[I]40、ELP[I]40+Trx相变温度的影响 |
ELP作为重组蛋白分离纯化标签在大肠杆菌周质空间成功应用。Trx作为模式蛋白与ELP[I]40融合构建了ELP[I]40+Trx融合蛋白,优化了表达温度。Western blot检测结果(图 4)表明,当表达温度为37℃,目的蛋白不能完全跨膜表达,当表达温度为25℃时,目的蛋白完全跨膜分泌表达,并成功分泌大肠杆菌周质空间表达。利用ITC技术纯化,得到ELP[I]40、ELP[I]40+Trx纯蛋白,结果显示蛋白纯度高达90%。当ELP[I]40、ELP[I]40+Trx母液浓度为25 μmol/L,测定ELP[I]40的Tt为29℃,ELP[I]40+Trx的Tt为29.5℃。ELP 融合蛋白表达浓度一般不高,利用ITC技术纯化ELP及ELP融合蛋白的实际应用中,ELP浓度与Tt的关系非常重要。本实验考察了ELP[I]40、ELP[I]40+Trx蛋白浓度对Tt的影响,测定ELP[I]40、ELP[I]40+Trx在不同蛋白浓度下的Tt,结果表明随着蛋白浓度的升高,Tt降低;考虑到某些亲水性目的蛋白“融合ΔTt效应”,本研究考察了不同浓度的NaCl对ELP[I]40、ELP[I]40+Trx的Tt影响,测定结果表明,随着NaCl浓度增高,Tt明显降低。ELP及其融合蛋白对盐离子敏感,可以通过添加盐离子来提高分离纯化效率。不同种类盐离子对ELP的Tt影响遵循霍夫迈斯特离子序[19](Hofmeister series),即阴离子SO42-> HPO42-> CH3COO-> Cl-> Br-> NO3->ClO4-> SCN-,阳离子NH4+ >K+ >Na+ >Mg2+ >Ca2+ >Mn2+ >Cu2+。
4 结论ELP作为大肠杆菌周质空间重组蛋白纯化标签初步应用,为重组蛋白的分离纯化工作提供了简便、快速、高效的方法。pIG6LH/ELP[I]40在大肠杆菌周质空间成功表达,解决了蛋白分泌到周质空间一般表达量低,纯化效率低等问题,与传统纯化方法相比,具有效率高、成本低、时间短、不需要复杂仪器设备等优点,同时还极大地提高了目的蛋白的纯度。
| [1] | Hewitt L, McDonnell JM. Screening and optimizing protein production in E. coli[M]. Methods Mol Biol, 2004 : 1. |
| [2] | Shokri A, Sanden AM, Larsson G. Cell and process design for targeting of recombinant protein into the culture medium of Escherichia coli. Appl Microbiol Biotechnol , 2003, 60 (6) : 654–664. DOI:10.1007/s00253-002-1156-8 |
| [3] | Takayama Y, Akutsu H. Expression in periplasmic space of Shewanella oneidensis. Protein Expr Purif , 2007, 56 (1) : 80–84. DOI:10.1016/j.pep.2007.06.005 |
| [4] | Talmadge K, Gilbert W. Cellular location affects protein stability in Escherichia coli. Proc Natl Acad Sci USA , 1982, 79 (6) : 1830–1833. DOI:10.1073/pnas.79.6.1830 |
| [5] | 汪希雅, 余平. 单链抗体的构建及其在医学上的应用. 中国病原生物学杂志 , 2009, 4 (10) : 790–792. |
| [6] | Banki MR, Feng L, Wood DW. Simple bioseparations using self-cleaving elastin-like polypeptide tags. Nat Methods , 2005, 2 (9) : 659–661. DOI:10.1038/nmeth787 |
| [7] | Lim DW, Trabbic-Carlson K, Mackay JA, et al. Improved non-chromatographic purification of a recombinant protein by cationic elastin-like polypeptides. Biomacromolecules , 2007, 8 (5) : 1417–1424. DOI:10.1021/bm060849t |
| [8] | Meyer DE, Chilkoti A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nat Biotechnol , 1999, 17 (11) : 1112–1115. DOI:10.1038/15100 |
| [9] | Hassouneh W, Christensen T, Chilkoti A. Elastin-like polypeptides as a purification tag for recombinant proteins[M]. Current Protocols in Protein Science, 2010 : 1-6. |
| [10] | 郑琼, 马旭俊, 杨传平. 硫氧还蛋白(Trx)的研究进展. 分子植物育种 , 2006, 4 (6) : 78–82. |
| [11] | Christensen T, Amiram M, Dagher S, et al. Fusion order controls expression level and activity of elastin-like polypeptide fusion proteins. Protein Sci , 2009, 18 (7) : 1377–1387. DOI:10.1002/pro.157 |
| [12] | 林衡, 李军明, 葛高顺, 等. 聚乙二醇对ELP[I]40相变温度的影响. 中国生物工程杂志 , 2013, 5 (33) : 81–85. |
| [13] | 林衡, 李军明, 张立超, 等. 疏水性ELP基因设计与基因库构建. 微生物学通报 , 2013, 40 (4) : 584–592. |
| [14] | Meyer DE, Trabbic-Carlson K, Chilkoti A. Protein purification by fusion with an environmentally responsive elastin-like polypeptide:Effect of polypeptide length on the purification of thioredoxin. Biotechnol Prog , 2001, 17 (4) : 720–728. DOI:10.1021/bp010049o |
| [15] | Chen TH, Bae Y, Furgeson DY. Intelligent biosynthetic nanobiomaterials(IBNs)for hyperthermic gene delivery. Pharmaceutical Research , 2008, 25 (3) : 683–691. DOI:10.1007/s11095-007-9382-5 |
| [16] | Fong BA, Wu WY, Wood DW. Optimization of ELP-intein mediated protein purification by salt substitution. Protein Expr Purif , 2009, 66 (2) : 198–202. DOI:10.1016/j.pep.2009.03.009 |
| [17] | Conley AJ, Joensuu JJ, Jevnikar AM, et al. Optimization of elastin-like polypeptide fusions for expression and purification of recombinant proteins in plants. Biotechnol Bioeng , 2009, 103 (3) : 562–573. DOI:10.1002/bit.v103:3 |
| [18] | Joensuu JJ, Brown KD, Conley AJ, et al. Expression and purification of an anti-Foot-and-mouth disease virus single chain variable antibody fragment in tobacco plants. Transgenic Res , 2009, 18 (5) : 685–696. DOI:10.1007/s11248-009-9257-0 |
| [19] | 黄凯宗, 李晶晶, 李巍, 等. 类弹性蛋白多肽的从头设计、非色谱纯化及盐效应. 生物工程学报 , 2011, 27 (4) : 653–658. |




