石油是一种重要的战略性资源,近年来,随着海洋石油开采业的发展和远洋运输业的繁荣,海上溢油事故时有发生,严重污染了海洋环境,给海洋生态平衡带来了严重的威胁[1]。2010年,美国墨西哥湾钻井平台“深水地平线”发生爆炸,使墨西哥湾沿岸生态环境遭遇了“灭顶之灾”;同年,我国大连新港“7.16”爆炸事故导致上万吨原油泄漏进入渤海湾,这是我国历史上发生的最为严重的海上溢油事故[2, 3]。据统计联合国环境规划署报告,每年流入海洋的石油约为2×106-2×107 t,海洋石油污染已成为一个世界性的环境问题[4]。
治理海洋石油污染主要有物理方法、化学方法及生物方法,其中,生物修复法是利用微生物对污染物的降解作用达到去除油污的目的,具有成本低廉、无二次污染、可原位修复等显著优点[5, 6],筛选优良的微生物资源用于石油污染的修复,已受到人们的广泛关注。Hassanshahiand等[7]分离到一株柴油食烷菌(Alcanivorax dieselolei)PG-12;郭平等[8]从表层海水分离到一株厦门栖东海菌(Donghicola xiamenensis)HD-1;姜肸等[9]从南海筛选到6株石油降解菌,分属于芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、交替单胞菌(Alteromonas)等菌属,均表现出良好的石油降解效果。但由于石油是由各类烷烃、芳烃及其他成分构成的复杂混合物,不同的菌株对不同碳链的烷烃、芳烃的降解情况差别较大[10],利用菌株间的共生、协同等作用构建复合菌,则可扩大对石油类底物的利用范围和效率,进而实现对污染物的高效降解[11, 12]。张海玲等[13]采用4株细菌构建了石油降解菌系;Van Hamme 等[14]将假单胞菌与红球菌混合培养构建复合菌系;Li等[15]富集得到了菌群KO5-2,相比于单一菌株,均显著提高了原油的生物降解率。目前,采用复合菌系修复海洋石油污染的过程中,尚缺乏对环境因素作用的系统分析;单一菌株与复合菌系降解特性比较方面的研究也相对较少。
近岸海域与人类的关系较为密切,该区域内的石油降解菌较远洋中可能存在较大的差别,目前尚未有专门针对该区域的石油降解复合菌系的研究。本研究即是以原油为唯一碳源,从深圳近岸海域筛选高效石油降解菌,采用复配、正交试验等方法构建石油降解复合菌系,并对其降解特性展开充分的研究,旨在为工业化菌剂的开发及应用提供参考及借鉴。
1 材料与方法 1.1 材料 1.1.1 海水及石油样品海水样品取自深圳市蛇口港和盐田港,在113.9°E-114.2°E,22.4°N-22.5°N范围内5个不同位点取样;实验用油为惠州大亚湾石化工业区提供的原油,25℃下密度约为0.9 g/mL。
1.1.2 培养基及试剂MMC培养基[16](g/L):NaCl 24,MgSO4·7H2O 7,NH4NO3 1,KCl 0.7,KH2PO4 2,Na2HPO4 3,pH7.4,1.0×105 Pa灭菌30 min。补加微量元素混合液(g/L):CaCl2 0.02,FeCl3·6H2O 0.5,CuSO4 0.005,MnCl2·4H2O 0.005,ZnSO4·7H2O 0.1。固体培养基另加琼脂15-20 g。平板表面均匀涂抹一层原油,制备成油平板。
2216E培养基(g/L)(用于菌种的培养):蛋白胨5,酵母膏1,柠檬酸铁0.10,NaCl 19.45,MgCl2 5.98,CaCl2 3.24,KCl 0.55,Na2CO3 0.16,KBr 0.080,SrCl2·6H2O 0.034,H3BO3 0.022,Na2SiO3·9H2O 0.004,NaF 0.002 4,NaNO3 0.001 6,Na2HPO4 0.008,pH 7.4-7.8,固体培养基另加琼脂15-20 g。
石油培养基(用于降解菌的富集、降解率的测定试验):每100 mL MMC培养基中加入1 g原油作为唯一碳源。
兔血平板培养基(用于表面活性剂的定性检测):固体2216E培养基融化后冷却至50℃,加入2-3滴无菌兔血摇匀后倒平板。
本研究所用的酶、dNTP等分子生物学试剂购自北京全式金生物技术有限公司;GC-MS实验所用流动相、标准品等购自国药集团;其他试剂均为国产分析纯。
1.2 方法 1.2.1 石油降解菌的筛选及产表面活性剂测定取5 mL海水样品加入100 mL石油培养基中,30℃、180 r/min培养7 d,取5 mL培养液转接至新鲜的石油培养基,重复以上步骤,连续转接富集培养4次,培养基中原油量依次提升至1.0、1.5和2.0 g。将乳化现象明显的样品梯度稀释,取0.1 mL涂布于石油平板,30℃培养3-5 d,挑取周围有透明圈的菌落于2216E平板纯化、待测。
将各菌株用无菌牙签依次挑至兔血平板培养基上,30℃培养2-3 d,根据菌落周围透明圈的大小判断表面活性剂的浓度[17]。将活化后的菌株以5%的比例接种到石油培养基中,以不接菌的培养基作为空白对照,30℃、180 r/min培养5 d。采用铂金环式表面张力测定仪测定培养液的表面张力。
1.2.2 石油降解率的测定石油浓度的测定采用紫外法,参考蒋瑞萍[18]的方法制作吸光度-石油浓度的标准曲线,略有改动。在一系列50 mL的容量瓶中加入不同量的原油母液(1 g/L),用二氯甲烷定容,260 nm处测定吸光度。为保证结果准确,加标回收率控制在95%-105%之间。
各菌株接至2216E培养基中培养至对数期,离心收集菌体,用无菌MMC洗涤2次,平板涂布法测定细胞数目并稀释浓度≈108 CFU/mL,以5%的比例(V/V)接种至石油培养基中,30℃、180 r/min振荡培养7 d,以未接菌的培养基作为对照。向各样品中加入50 mL二氯甲烷,200 r/min振荡20 min,再于40℃下超声15 min萃取其中的残余油污,离心去除菌体碎片。从二氯甲烷相吸取0.2 mL 溶液定容于50 mL容量瓶,260 nm处测定吸光度,根据标准曲线计算样品中残余的石油浓度:
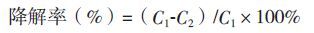
其中,C1为对照中石油浓度,C2为样品中石油浓度。每个样品3次重复,下同。
1.2.3 石油降解复合菌系的构建根据降解率和产表面活性剂情况,优选5株细菌分别接种至2216E中培养至对数末期,种子液离心、洗涤后用平板涂布法调节为一致的浓度(108 CFU/mL)。各菌以等比例随机配伍的方式接至石油培养基中,总接种量为5%(体积比),30℃、180 r/min培养7 d后测定石油降解率。选择降解率最高的1个组合,通过3水平(0.5%、1.0%和2.0%)的正交实验确定各菌株的接种量。
1.2.4 菌株的鉴定生理生化实验及16S rRNA基因序列分析参照吴秉奇等[19]方法,PCR产物由上海生工生物工程有限公司测序,结果提交GenBank获取登录号,采用MEGA软件构建系统发育树。
1.2.5 石油降解条件的优化在石油培养基中接种复合菌系,摇床培养7 d,设置不同的培养条件。(1)培养温度:22、26、30、34和38℃;(2)培养基初始pH值:6.4、7.0、7.6、8.2和8.8;(3)摇床转速:160、180、200、220和240 r/min;(4)初始油浓度:1.0、5.0、10.0、20.0和40.0 g/L。石油降解率的测定方法同1.2.2。
将以上因素设置为最佳条件,定时取样测定复合菌系对石油的降解情况,同时采用平板计数法对培养液中细菌进行菌落计数。
1.2.6 复合菌系对石油的降解特性采用GC-MS法测定石油生物降解后各烷烃组分的残留情况。将复合菌系以最佳接种量接种至石油培养基,30℃、180 r/min条件下培养7 d。培养液前处理同1.2.2,取待测液用干燥无水Na2SO4脱水,再经0.22 μm有机系滤膜过滤,氮气吹干后用二氯甲烷重新溶解。GC-MS运行条件:全扫描模式;色谱柱为RYX-5(30 m×0.25 mm×0.25 μm);柱温45℃,以 5℃/min的速度升至300℃,停留20 min;进样口、离子源、四级杆温度分别为250、230和150℃;载气为氦气;进样量1 μL。数据分析用安捷伦5975-7890A工作站。
1.2.7 数据统计及分析使用SPSS 18.0和ORIGIN 8.6软件对数据进行整理;采用新复极差法,在0.05水平上分析差异显著性(P<0.05)。菌株16S rRNA基因序列通过DNAMAN 7.02拼接后进行BLAST分析,利用MEGA 6程序的Neighbor-joining算法构建系统发育树。
2 结果 2.1 石油降解菌的筛选及产表面活性剂情况对5个取样点的样品进行驯化,选择乳化现象较为明显的样品分离细菌,共获得68株石油降解菌,分别测定各菌株对石油的降解率及培养液的表面张力。如图 1所示,共有22株细菌对石油的去除情况较好,接种7 d后,菌株S1-3A、S1-12、S1-38等3株细菌对石油的降解率超过50%,其中S1-38可达52.2%。同时发现,菌株S1-5、S1-12、S1-22、S1-30、S1-37、S1-41B和S2-13等7株细菌在兔血平板上可产生较为明显的透明圈,其培养液的表面张力相比于对照也有大幅下降,最高达44.6%,初步推断以上菌株能够产生表面活性剂,促进石油的乳化、分散;其余接菌处理培养液的表面张力也有不同程度的降低。
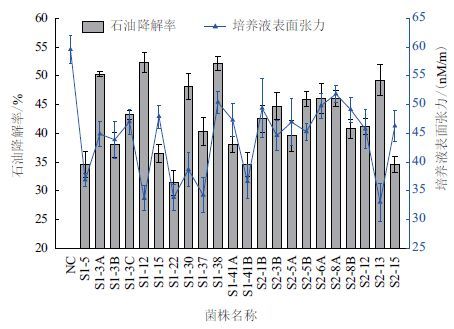
|
| 图 1 菌株对石油的降解率及培养液表面张力测定 |
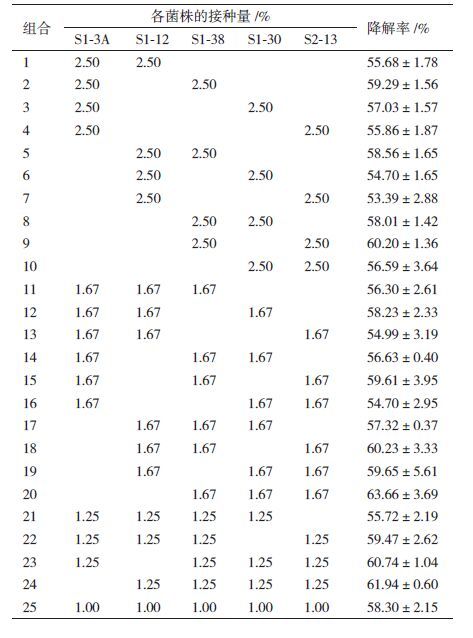
根据降解石油及产表面活性剂情况,排除菌株间的拮抗作用,选择S1-3A、S1-12、S1-30、S1-38、S2-13等5株细菌,通过等比例接种的方式分别构建二阶至五阶复合菌系,共计25种组合,测定各组合对石油的降解率,结果见表 1。
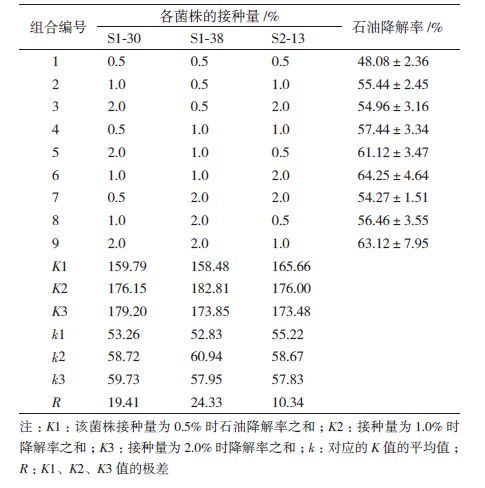
结果(表 1)显示,复合菌对石油的降解率在53.4%-63.7%之间,均高于单一菌株;凡同时接种S1-38和S2-13的组合均具有较高石油降解率,由S1-38、S1-30、S2-13等3株细菌构成的复合菌系对石油的去除情况最好,7 d内对石油降解率可达63.7%。设计3因素3水平的正交实验对该组合中各菌株的接种量加以优化,结果见表 2。
表 2中R值显示,接种量对S1-38的影响最大,其次为 S1-30,对S2-13的影响较小;当S1-30取2.0%水平,S1-38取1.0%水平,S2-13取1.0%水平时,各自具有最高的K值,理论上采用该接种量时,复合菌应该具有最高的石油降解率。按此接种量制备复合菌系,培养7 d测得其对石油的降解率为68.3%,高于正交实验中的任一组合,与预期相符,将该菌系命名为SQ1。
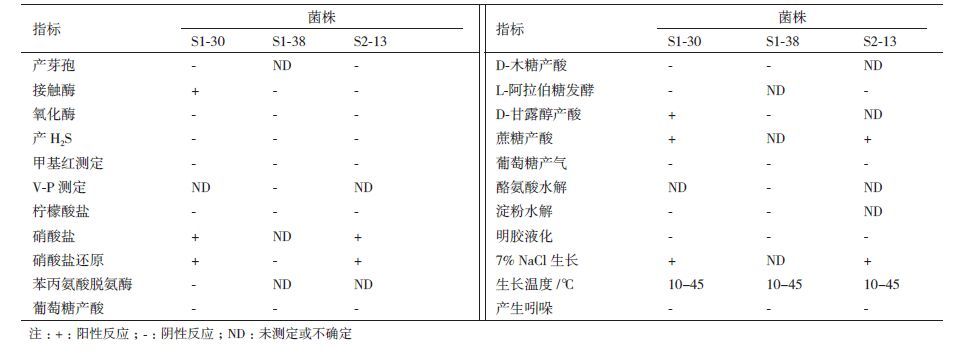
2.3 石油降解菌的鉴定3株细菌在2216E 平板上培养48-72 h后,S1-30呈不透明的淡黄色圆形菌落,直径0.5-1.5 mm,表面光滑、凸起、湿润;镜检为(1 000×)G+,菌体呈短杆状,(0.3-0.6)×(1.0-4.0)μm,单生或簇生。S1-38呈淡红色圆形菌落,直径0.2-1.0 mm,表面光滑、凸起,有黏液,边缘整齐;镜检为G+,菌体呈球状,(0.5-1.0)×(0.5-1.0)μm。S2-13呈灰白色不规则圆形菌落,直径2.0-3.0 mm,凸起;镜检为G-,菌体呈杆状,(0.5-1.0)×(1.0-5.0)μm,单生。生理生化实验结果见表 3。
采用通用引物扩增3株细菌的16S rRNA基因序列,得到大小约为1 400-1 500 bp的片段,测序后将序列与GenBank中近缘模式种进行BLAST分析,选择相似度较高的菌株序列采用邻接法构建系统发育树,以Methanococcus vannielii作为外群,结果见图 2。
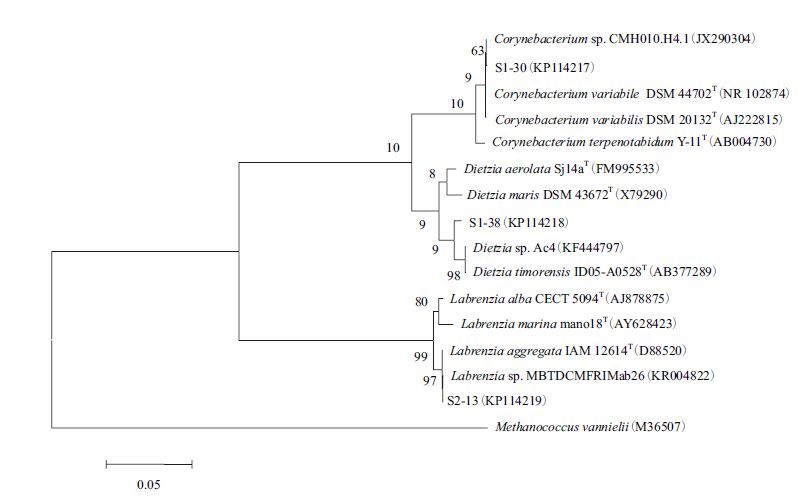
|
| 图 2 基于16S rRNA基因的菌株系统发育树 |
由图 2可见,菌株S1-30与棒杆菌属(Coryneba-cterium)下的几种细菌模式种聚为一个类群,与菌株Corynebacterium variabile DSM 44702T、Corynebacteri-um sp. CMH010.H4.1和Corynebacterium variabilis DSM 20132T的相似度均为99%;S1-38与迪茨氏菌属(Dietzia)下几种细菌模式种聚为同一类群,与Dietzia timorensis ID05-A0528T、Dietzia sp. Ac4等菌株的相似度均为99%;S2-13与拉布伦茨氏菌属(Lab-renzia)细菌聚为同一类群,与菌株Labrenzia sp. MBTDCMFRIMab26的相似度达100%。结合生理生化实验结果,将菌株S1-30鉴定为棒杆菌,将S1-38鉴定为迪茨氏菌,将S2-13鉴定为拉布伦茨氏菌;GenBank登录号分别为KP114217、KP114218、KP114219。
2.4 SQ1降解石油条件的优化通过单因素实验,测定培养温度、摇床转速(通气量)、初始pH值、初始石油浓度等4种因素对复合菌系SQ1降解石油的影响,结果见图 3。
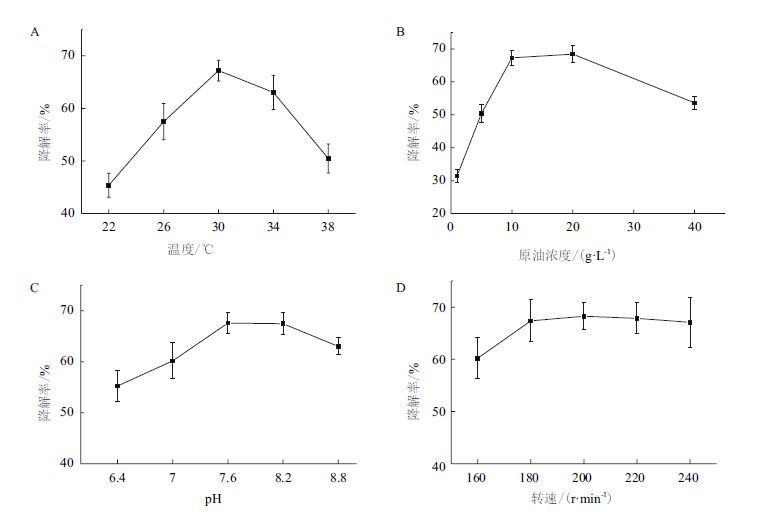
|
| 图 3 环境因素对SQ1降解石油的影响 |
如图 3-A所示,30℃是SQ1降解石油的最适温度,降解率为67.2%;过低或过高的温度对SQ1降解石油均具有负面影响,22℃和38℃时的去除率仅为45.4%和50.5%。石油浓度(图 3-B)对SQ1降解石油的影响同样显著,当石油浓度为1 g/L时,其生物降解率仅为31.4%;随着浓度的提升,SQ1对石油的去除率也逐渐升高,当浓度为20 g/L时,其降解率可达67.3%;但当石油的浓度进一步升至40 g/L时,SQ1对石油的降解率出现明显的下降。图 3-C所示,初始pH方面,SQ1在pH为7.0-8.8范围内对石油均有较高的降解率(>60%),当pH为7.6时,SQ1对石油的降解率最高,可达67.6%。通气量(图 3-D)对石油去除率的影响较小,当摇床转速达到180 r/min以上时,SQ1对石油的降解情况无显著差别。
2.5 培养过程中石油降解及菌系SQ1的变化根据2.4的结果,将温度、pH、转速和石油浓度分别调节至 30℃、7.6、200 r/min和20 g/L,定时取样测定SQ1对石油的降解和反应体系中各细菌的生长情况。
结果(图 4)显示,复合菌系SQ1对石油表现出持续的降解能力。接种后1-7 d内,石油的降解情况呈指数增长,此后石油的生物降解速率有所下降,培养11 d时,石油的去除率达到最高(73.5%)。在石油的降解的过程中,复合菌系SQ1中3种细菌的生长状况差异较大,S1-38在培养1-5 d内大量生长,7 d后活菌数呈不断下降的趋势;S2-13在培养3-9 d内活菌激增,此后有小幅下降;S1-30的生长速度较其他2株菌慢,但其活菌数始终处于增长状态,表现出持续的石油降解能力。
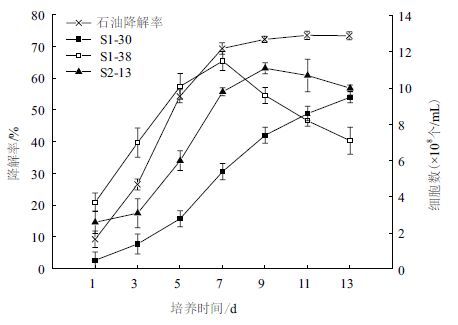
|
| 图 4 培养时间对石油降解及细菌生长的影响 |
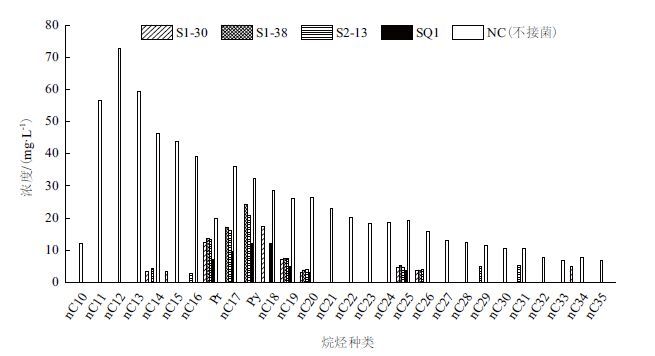
采用GC-MS法对石油生物降解后的残留组分定量分析,结果见图 5。
图 5显示,菌株S1-30、S1-38、S2-13和复合菌系SQ1对石油总烷烃的去除率分别为87.55%、73.11%、87.55%和91.69%,均能够降解C10-C35之间的大部分正构烷烃,其中对C10-C13、C21-C24、C27、C30、C32、C33等烷烃的降解率为100%。相比于单一细菌,复合菌系SQ1降解烷烃的能力更强,对C10-C16和C21-C35之间(除C25)烷烃的降解率也达到了100%,对本研究中较难以降解的C16-C20之间烷烃的去除效果也要好于单一细菌。
|
| 图 5 降解后石油中烷烃含量 |
已有报道表明,海洋环境中存着数百种微生物能够参与石油烃类的降解,其中大部分为细菌,如:不动杆菌(Acinetobacter)、假单胞菌、红球菌(Rhodococcus)、嗜盐单胞菌(Halomonas)、食烷菌(Alcanivorax)、海杆菌(Marinobacter)和 微杆菌(Microbacterium)等[7, 20, 21]。本研究从深圳近海分离到的22株石油降解菌,对石油的降解率最高为52.4%,与其他已报道的菌株相比,其降解能力处于中间水平[8, 9, 22],但本研究分离到菌株广泛分布于副球菌(Paracoccus)、拉布伦茨氏菌、鞘氨醇盒菌(Sphingopyxis)、假单胞菌以及迪茨氏菌等菌属,其中,拉布伦茨菌在海洋石油降解方面的作用为首次报道。
研究表明,分泌表面活性剂是一些菌株能够高效利用石油烃的重要因素,例如:菌株Pseudomonas sp. BP10即是通过产表面活性剂降低了培养液表面的张力,提高了对石油的摄取作用[23];Bacillus methylotrophicus USTBa不仅能够分泌表面活性剂,其产物对某些细菌还具有一定的拮抗作用[24]。依据在血平板上产生透明圈的大小和培养液的表面张力降低幅度,本研究将S1-12等7株细菌初步判定为表面活性剂高产菌,但7株细菌中S1-12、S1-30和 S2-13等3株菌的石油降解能力明显强于另外4株,这说明除了产表面活性剂外,菌株的生长状态、分泌的降解酶系等因素与石油降解能力也密切相关。有报道表明,细菌产表面活性剂的多少与降解石油的能力呈正相关[25, 26],但本研究的结果却有所不同,如:S1-3A和S1-38虽然表面活性剂的产生特征不明显,但对石油的降解能力却较强,这可能与其细胞表面特性有关,也可能是分泌的其他代谢产物的缘故。由于培养条件、底物浓度等外界因素与细菌产表面活性剂息息相关[24],本研究菌株所产表面活性剂的类型及产量还需通过红外法、薄层层析法等手段做进一步分析。
依据对石油的降解能力和产表面活性剂的情况,本研究选择5株石油降解菌进行复配,并通过正交实验优化接种量,构建了由棒杆菌S1-30、迪茨氏菌S1-38和拉布伦茨氏菌S2-13组成的复合菌系SQ1。结果显示,SQ1对石油的降解率可达68.3%,相比于单一细菌至少高出16.1%,GC-MS结果也表明SQ1对石油的去除效果要好于单一菌株。与其他报道的复合菌系相比,SQ1的降解能力略低于Bao等[27]采用苍白杆菌(Ochrobactrum sp.)和类短短芽孢杆菌(Brevibacillus parabrevis)构建的四元复合菌系(79%);在2%的原油浓度下,与Sathishkumar[28]构建的四元菌系降解能力相近(72%-76%);高于张海玲等[12]构建的复合菌系(61.3%)。但SQ1对石油总烷烃的去除率可达91.7%,对石油组分降解情况较为特殊。一般来说,石油中的短链和中链组分更易于生物降解[29, 30],但SQ1对石油中C21-C35等长链烷烃的降解率几乎为100%,对C10-C16等中链烷烃的降解却不是很彻底,这可能是由于SQ1中的3株细菌含有长链烷烃降解需要的特殊酶系基因[31]。此外,3株细菌表现出明显的协同作用,一方面是由于菌株S1-30和S2-13通过产生表面活性剂,提高了S2-13对各种碳源的利用,也可能是3株细菌在底物利用和代谢途径上具有互补性[32]。
本研究发现,反应体系的温度、石油浓度及pH对SQ1降解石油的影响较为显著。温度不仅可以影响微生物本身的代谢活性,对石油的物理状态、化学组成也具有一定的影响,直接关系到石油的生物降解率;而作为唯一碳源,石油浓度过低则养分不足,过高又会对微生物产生毒害;pH是通过对微生物的代谢及酶活性的调节产生影响[28, 33]。总体来看,SQ1适于在中等温度、较高的石油浓度以及偏弱碱性的环境下发挥降解作用,这与我国南方的海洋环境较为接近。此外,微生物生物量的增长与石油污染的降解密切相关[2, 34],从体系中3株细菌在生长情况来看,迪茨氏菌S1-38在培养初期即大量生长,这可能是因为其他2株细菌通过产表面活性剂乳化了石油,刺激了S1-38的快速摄取利用,推测其在石油降解初期发挥主要作用;此后拉布伦茨氏菌S2-13和棒杆菌S1-30进入对数期;9 d后,由于细菌进入稳定期和衰亡期,石油降解产物也可能对细菌产生反馈抑制,反应体系中石油的降解较为缓慢,但由于S1-30生物量始终处于增长状态,对复合菌系SQ1持续降解石油起到一定的作用。
本研究分离到的石油降解菌全部来自近岸海域,与人类活动的关系更为密切,其环境适应能力较强。构成菌系SQ1的3株细菌中,棒杆菌和迪茨氏菌在海洋石油降解方面的作用已有所报道[22, 35],但有关拉布伦茨氏菌的报道主要集中于降解利用氨基酸、产酶等方面[36, 37],本研究是首次发现其在海洋石油降解方面的作用,有关3株细菌在复合菌系SQ1中的具体作用及代谢规律等,还需要做进一步研究。另外,由于海洋环境的复杂性,SQ1对石油污染的修复效果也有待现场试验加以证实。
4 结论从深圳近岸海域筛选得到22株高效石油降解菌,分布于副球菌、拉布伦茨氏菌、鞘氨醇盒菌、假单胞菌以及迪茨氏菌等菌属,实验室条件下,7 d内对石油的降解率最高为52.2%。
采用棒杆菌S1-30、迪茨氏菌S1-38和拉布伦茨氏菌S2-13由构建了高效石油降解复合菌系SQ1,对石油的降解率可达68.3%,比接种单菌高出16.1%。
SQ1的最适环境因素为30℃、石油浓度20 g/L、pH7.6。SQ1可降解石油大部分的烷烃组分,对长链烷烃的去除率几乎达到100%,在海洋石油污染修复中具有较强的应用潜力。
| [1] | Head IM, Jones DM, R?ling WF. Marine microorganisms make a meal of oil. Nature Reviews Microbiology , 2006, 4 (4) : 173–82. |
| [2] | 王鑫, 王学江, 刘免, 等. 高效石油降解菌群构建及降解性能. 海洋环境科学 , 2014, 33 (4) : 576–579. |
| [3] | 陈澎, 李颖, 余小凤, 等. "7. 16"大连新港石油管道爆炸事故中的热红外溢油监测. 环境工程学报 , 2013, 7 (2) : 796–800. |
| [4] | 崔志松, 李倩, 高伟, 等. 复合菌液在模拟溢油岸滩修复中的应用. 应用与环境生物学报 , 2013, 19 (2) : 324–329. |
| [5] | Mukherjee AK, Bordoloi NK. Bioremediation and reclamation of soil contaminated with petroleum oil hydrocarbons by exogenously seeded bacterial consortium:a pilot-scale study. Environm-ental Science and Pollution Research International , 2011, 18 (3) : 471–478. DOI:10.1007/s11356-010-0391-2 |
| [6] | Al-Saleh E, Drobiova H, Obuekwe C. Predominant culturable crude oil-degrading bacteria in the coast of Kuwait. International Biodeterioration & Biodegradation , 2009, 63 (4) : 400–406. |
| [7] | Hassanshahian M, Emtiazi G, Cappello S. Isolation and characteriza-tion of crude-oil-degrading bacteria from the Persian Gulf and the Caspian Sea. Marine Pollution Bulletin , 2012, 64 (1) : 7–12. DOI:10.1016/j.marpolbul.2011.11.006 |
| [8] | 郭平, 曹滨霞, 张君, 等. 海洋石油降解菌的筛选与降解性能研究. 科学技术与工程 , 2015, 15 (11) : 152–154. |
| [9] | 姜肸, 高伟, 李倩, 等. 南海高效石油降解菌的筛选及降解特性研究. 环境科学学报 , 2012, 32 (7) : 1572–1578. |
| [10] | 左丽敏, 马晓阳, 李智民, 等. 土壤中石油烃与降解菌群的相互作用研究. 安全与环境工程 , 2015, 22 (4) : 63–68. |
| [11] | 何丽媛, 党志, 唐霞, 等. 混合菌对原油的降解及其降解性能的研究. 环境科学学报 , 2010, 30 (6) : 1220–1227. |
| [12] | Owsianiak M, Chrzanowski ?, Szulc A, et al. Biodegradation of diesel/biodiesel blends by a consortium of hydrocarbon degraders:effect of the type of blend and the addition of biosurfactants. Bioresour Technol , 2009, 100 (3) : 1497–1500. DOI:10.1016/j.biortech.2008.08.028 |
| [13] | 张海玲, 杨琴, 赵敏. 石油降解菌群构建的研究. 油气田环境保护 , 2013, 23 (3) : 19–21. |
| [14] | Van Hamme JD, Ward OP. Physical and metabolic interactions of Pseudomonas sp. strain JA5-B45 and Rhodococcus sp. strain F9-D79 during growth on crude oil and effect of a chemical surfactant on them. Applied & Environmental Microbiology , 2001, 67 (10) : 4874–4879. |
| [15] | Li Z, Gu G, Zhao C, et al. Degradation characteristics and community structure of a hydrocarbon degrading bacterial consortium. China Petroleum Processing & Petrochemical Technology , 2015, 17 (3) : 15–24. |
| [16] | 刘陈立, 邵宗泽. 海洋石油降解微生物的分离鉴定. 海洋学报 , 2005, 27 (4) : 114–120. |
| [17] | Najafi AR, Rahimpour MR, Jahanmiri AH, et al. Enhancing biosurfactant production from an indigenous strain of Bacillus mycoides by optimizing the growth conditions using a response surface methodology. Chemical Engineering Journal , 2010, 163 (3) : 188–194. DOI:10.1016/j.cej.2010.06.044 |
| [18] | 蒋瑞萍, 孙丽丽, 解开治, 等. 采用紫外分光光度法评价石油烃降解菌的降解能力. 石化技术与应用 , 2015, 33 (1) : 70–74. |
| [19] | 吴秉奇, 刘淑杰, 张淼, 等. 接种耐镉细菌对青葙吸收积累土壤中镉的影响. 生态学杂志 , 2014, 12 (12) : 3409–3415. |
| [20] | Petrikov K, Delegan Y, Surin A, et al. Glycolipids of Pseudomonas and Rhodococcus oil-degrading bacteria used in bioremediation preparations:Formation and structure. Process Biochemistry , 2013, 48 (5-6) : 931–935. DOI:10.1016/j.procbio.2013.04.008 |
| [21] | Ibrahim ML, Ijah UJJ, Manga SB, et al. Production and partial characterization of biosurfactant produced by crude oil degrading bacteria. International Biodeterioration & Biodegradation , 2013, 81 (1) : 28–34. |
| [22] | Zhang X, Xu D, Zhu C, et al. Isolation and identification of biosurfactant producing and crude oil degrading Pseudomonas aeruginosa strains. Chemical Engineering Journal , 2012, 209 (41) : 138–146. |
| [23] | Kumari B, Singh SN, Singh DP. Characterization of two biosurfac-tant producing strains in crude oil degradation. Process Biochemistry , 2012, 47 (12) : 2463–2471. DOI:10.1016/j.procbio.2012.10.010 |
| [24] | Chandankere R, Yao J, Cai M, et al. Properties and characterization of biosurfactant in crude oil biodegradation by bacterium Bacillus methylotrophicus USTBa. Fuel , 2014, 122 (8) : 140–148. |
| [25] | Haassanshahian M, Zeynalipour MS, Musa FH. Isolation and characterization of crude oil degrading bacteria from the Persian Gulf(Khorramshahr provenance). Marine Pollution Bulletin , 2014, 82 (1-2) : 39–44. DOI:10.1016/j.marpolbul.2014.03.027 |
| [26] | Souza EC, Vessoni-Penna TC, de Souza Oliveira RP. Biosurfactant-enhanced hydrocarbon bioremediation:An overview. International Biodeterioration and Biodegradation , 2014, 89 (2) : 88–94. |
| [27] | Bao MT, Wang LN, Sun PY, et al. Biodegradation of crude oil using an efficient microbial consortium in a simulated marine environment. Marine Pollution Bulletin , 2012, 64 (6) : 1177–1185. DOI:10.1016/j.marpolbul.2012.03.020 |
| [28] | Sathishkumar M, Binupriya AR, Baik SH, et al. Biodegradation of crude oil by individual bacterial strains and a mixed bacterial consortium isolated from hydrocarbon contaminated areas. Clean-Soil Air Water , 2008, 36 (1) : 92–96. DOI:10.1002/(ISSN)1863-0650 |
| [29] | Mukred AM, Hamid AA, Hamzah A, et al. Development of three bacteria consortium for the bioremediation of crude petroleum-oil in contaminated water. Online Journal of Biological Sciences , 2008, 8 (4) : 73–79. DOI:10.3844/ojbsci.2008.73.79 |
| [30] | Nikolopoulou M, Pasadakis N, Kalogerakis N. Enhanced bioremediation of crude oil utilizing lipophilic fertilizers. Desalination , 2007, 211 (11) : 286–295. |
| [31] | 刘晔, 周卫民, 牟伯中, 等. 长链烷烃降解菌的降解特性. 微生物学杂志 , 2005, 25 (6) : 14–18. |
| [32] | Bouchez M, Blanchet D, Vandecasteele JP. Degradation of polycyclic aromatic hydrocarbons by pure strains and by defined strain associations:inhibition phenomena and cometabolism. Applied Microbiology and Biotechnology , 1995, 43 (1) : 156–164. DOI:10.1007/BF00170638 |
| [33] | Rahman KSM, Thahira-Rahman J, Lakshmanaperumalsamy P, et al. Towards efficient crude oil degradation by a mixed bacterial consortium. Bioresource Technology , 2002, 85 (3) : 257–261. DOI:10.1016/S0960-8524(02)00119-0 |
| [34] | Papazi A, Kotzabasis K. Bioenergetic strategy of microalgae for the biodegradation of phenolic compounds—Exogenously supplied energy and carbon sources adjust the level of biodegradation. Journal of Biotechnology , 2007, 129 (4) : 706–716. DOI:10.1016/j.jbiotec.2007.02.021 |
| [35] | Gao XX, Gao W, Cui ZS, et al. Biodiversity and degradation potential of oil-degrading bacteria isolated from deep-sea sediments of South Mid-Atlantic Ridge. Marine Pollution Bulletin , 2015, 97 (1-2) : 373–380. DOI:10.1016/j.marpolbul.2015.05.065 |
| [36] | 郭彦岑, 尹群健, 卓书辉, 等. 琼胶酶高产细菌的分离及鉴定. 西北师范大学学报:自然科学版 , 2012, 48 (6) : 76–81. |
| [37] | Ghani NA, Norizan SN, Chan XY, et al. Labrenzia sp. BM1:a quorum quenching bacterium that degrades N-acyl homoserine lactones via lactonase activity. Sensors , 2014, 14 (7) : 11760–11769. DOI:10.3390/s140711760 |