2. 南京农业大学资源与环境科学学院,南京 210095;
3. 山东省土壤肥料总站,济南 250100
2. College of Resources and Environment Science,Nanjing Agricultural University,Nanjing 210095;
3. Soil and Fertilizer Station of Shandong Province,Ji’nan 250100
玉米生产在我国农业生产和发展中处于至关重要的地位[1],随着物质水平和科学技术的提高,玉米不再仅仅发挥作为食物原料的作用,在淀粉、制糖、榨油、酿酒,医药等领域的用途日益广泛[2]。而我国人均土地比较匮乏,玉米种植面积已很难扩大,当前的玉米生产已远远不能满足人们的需求,因此,在我国,提高玉米的单位产量是当务之急[1]。施用化肥、提高土壤养分含量是解决这一问题的主要途径,而长期、大量工业化肥的施用不仅会增加农业投入成本,还会使土壤肥力下降、有害物质累积、破坏土壤微生态环境,甚至会造成水体富营养化,危害生态安全[3, 4]。
微生物菌剂通过活性微生物的生命活动,能够溶解土壤固定的无机磷、钾,促进吲哚乙酸(IAA)的合成,提高氮的固定量,促进作物的生长,提高产品的质量,是一种新型的生态制剂[5-7]。而植物根际中含有大量的微生物,其中大部分为植物根际促生菌(plant growth promoting rhizobacteria,PGPR),能够用于微生物菌剂制作[7, 8],自1978年被Kloepper和Schroth首次提出至今,PGPR已被广泛应用于农业生产中[9]。目前,微生物菌剂的发展研究主要是针对蔬菜、水果、茶和药用植物等经济作物,对粮食作物上的研究比较少[10],基于此,作者拟从玉米根际土壤中筛选出多功能植物促生菌,对菌株进行筛选鉴定以及对应用效果进行研究,为PGPR在玉米生产上的应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 供试土壤采自郑州市农业部华北小麦玉米轮作营养与施肥科学观测试验站 0-20 cm表层土壤,理化性质见表 1。
LB培养基:蛋白胨10 g,酵母提取物5 g,氯化钠 10.0 g,蒸馏水1 L,pH7.0-7.2。无机盐培养基:硫酸铵2.0 g,磷酸二氢钠0.5 g,磷酸氢二钾0.5 g,七水硫酸镁0.2 g,二氯化钙0.1 g,蒸馏水1 L,pH7.0。Ashby无氮培养基:甘露醇10.0 g,磷酸氢二钾0.2 g,七水硫酸镁0.2 g,氯化钾0.2 g,二水硫酸铵0.2 g,碳酸钙5.0 g,pH7.2。无机磷培养基:磷酸三钙5.0 g,葡萄糖10.0 g,硫酸铵0.5 g,氯化钠0.3 g,七水合硫酸镁0.3 g,氯化钾0.3 g,蒸馏水1 L,pH7.0-7.2。液态解钾细菌培养基:蔗糖10.0 g,酵母膏0.5 g,硫酸铵1.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.5 g,碳酸钙1.0 g,钾长石粉1.0 g,蒸馏水1 L。121℃灭菌20 min。
1.2 方法 1.2.1 供试土壤基本理化性状的测定方法供试土壤理化性质和盆栽植株各指标的测定方法参考《土壤农化分析》(第3版)[11],重铬酸钾容量法——外加热法测定土壤有机质;半微量开氏法测定土壤全氮;还原蒸馏法测定土壤矿质氮;HClO4-H2SO4消 煮-钼锑抗比色法测定土壤全磷;0.5 mol/L NaHCO3法测定土壤速效磷;NaOH熔融-火焰光度法测定土壤全钾;NaHCO3浸提-火焰光度法测定速效钾;钼 黄比色法测定植株全磷;火焰光度法测定植株全钾。
1.2.2 菌株的筛选 1.2.2.1 菌株的分离纯化从郑州市农业部华北小麦玉米轮作营养与施肥科学观测试验站玉米试验大田中选出一株长势较好的玉米,去其地上部分,用手轻轻抖落根系上的土壤,装入无菌袋中,带回实验室。在实验室内,将根系悬浮于无菌水中,形成根际土壤悬浮液,按照微生物10倍梯度稀释法操作,将悬浮液稀释至10-6,将不同浓度的悬浮液涂布在LB平板上,30℃倒置培养1 d,分离纯化出根际不同菌株,置4℃条件下保存备用[12]。
1.2.2.2 溶磷能力测定在无菌操作台中,将分离的菌株分别接种于盛有30 mL无机磷培养基的150 mL三角瓶,放置于摇床中,设置摇床温度为30℃,转速180 r/min。培养3 d,4℃下用10 mL的离心管将培养液10 000 r/min离心,10 min后,取出离心管,转移出上清液,用钼蓝比色法测定有效磷含量。
1.2.2.3 溶钾能力测定在无菌操作台中,将分离的菌株分别接种于盛有30 mL液态解钾细菌培养基的150 mL三角瓶,放置于摇床中,设置摇床温度为30℃,转速180 r/min。培养3 d,用10 mL的离心管将培养液10 000 r/min离心,10 min后,取出离心管,转移出上清液,用火焰分光光度计测定钾的含量。
1.2.2.4 固氮能力测定将已纯化的固氮菌分别接入无氮液体培养基中,培养24 h后用离心法收集菌细胞,在收集到的菌细胞中加入45 mL无菌水和5 mL无氮液体培养基,形成50 mL固氮菌悬浮液(每毫升约107个菌细胞)作为待接种菌液。
1.2.2.5 固氮酶活性采用乙炔还原法测定将上述菌株接种在装有2 mL无氮液体培养基的青霉素小瓶中,30℃下培养18-24 h;将棉塞换为反口胶塞密封,用密封性好的注射器先从培养有菌的青霉素小瓶抽取0.5 mL空气,再注入0.5 mL C2H2,用胶布密封针眼;继续培养24 h后,取100 μL气样在气相色谱仪上测定C2H4峰值,标准气C2H4浓度为130 mg/L。
采用美国HP公司生产的HP6890型气相色谱仪,其工作条件设置为:氢火焰离子化检测器,温度250℃,H2流量30 mL/min,压力20 kPa;色谱柱为毛细管,柱长15.0 m,内径320 μm,炉温30℃;载气N2,流量30 mL/min,压力20 kPa;空气流量250 mL/min;前进样口温度250℃,压力20 kPa。乙炔还原活性[ARA(nmol C2H4/h·mL)],计算方法为:

(1) 定性测定:将分离纯化后的细菌接种于含有 L-色氨酸(80 mg/L)的LB液体培养基,每一菌株3个重复,摇床培养(30℃,180 r/min)1 d后,取50 μL菌悬液滴于白色陶瓷板上,同时加入等体积的Salkowski比色液(50 mL 35% HClO4 + 1 mL 0.5 mol/L FeCl3)[13],并以加入50 μL未接菌的 LB 液体培养基与等体积比色液的混合溶液为对照。将白色陶瓷板于室温避光放置 30 min 后观察,颜色变粉红者为阳性,表示能够分泌IAA,颜色越深表示分泌的强度越大,不变色为阴性,表示不能分泌IAA。
(2) 定量测定:对初筛获得的能分泌IAA的细菌进行定量测定,培养条件同上。首先用分光光度法测定菌悬液的OD600值,然后将菌悬液以10 000 r/min 离心10 min取上清液加入等体积Salkowski比色液,避光静置 30 min,测定其 OD530值[14]。对照标准曲线计算单位体积发酵液中 IAA 的含量。标准曲线的绘制采用分析纯的 IAA 梯度稀释制备。
(3) IAA标准曲线配置:精确称取32.8 mg的IAA于100 mL容量瓶中,用甲醇定容(该溶液含IAA 328 µg/mL)。再用甲醇依次稀释1倍,连续进行4次,配成5份浓度依次相差1倍的标准溶液,比色时也是等量的标准溶液加等量的比色液。
1.2.3 菌株形态、生理生化指标的测定及分子鉴定 1.2.3.1 菌落形态观察将筛选的菌株接种到LB平板上,30℃培养24 h,观察菌落的大小、形状、颜色、光泽度、黏稠度、隆起形状、透明度、边缘特征及有无芽孢等[15]。
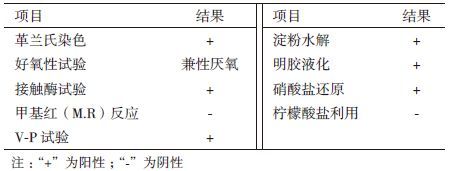
1.2.3.2 生理生化指标的测定依据《细菌系统鉴定手册》[16]、《伯杰细菌鉴定手册》(第8版)[17],对该菌株进行好氧性、过氧化氢酶 、甲基红、乙酞甲基甲醇、淀粉水解、硝酸盐还原、柠檬酸盐利用试验。
1.2.3.3 分子鉴定将菌株用 LB 液体培养基培养至对数生长期,离心收集菌体,采用 SDS-CTAB法提取总基因组 DNA[18],采用16S rDNA通用引物 27f (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-G- GTTACCTTGTTACGACTT-3′)进行16S rDNA的PCR扩增。PCR 反应条件:94℃预变性30 s;94℃变性30 s,52℃退火30 s,72℃延伸60 s,35个循环。将PCR 产物进行1.5%的琼脂糖凝胶电泳[19]。PCR产物经琼脂糖凝胶电泳后回收纯化测序(北京美亿美生物技术有限公司),根据获得的16S rDNA序列在GenBank中Blast 搜索同源序列,通过 MEGA5.0 软件,建立系统发育。
1.2.4 盆栽试验种子催芽:品种选用郑单958,经20%双氧水表面消毒20 min,无菌水冲洗多次,置于无菌培养皿中,25℃,催芽2 d,选取发芽较好,长势一致的玉米种芽备用。
移栽处理:每盆装土700 g,将备用的玉米种芽移栽入盆钵中,每盆移栽一株玉米种芽,加入适量、等量的无菌水,使盆栽含水量达到最大田间持水量的60%,设置接菌处理与对照处理,每个处理6个重复。接菌处理接种YM4菌剂,接种量为108 CFU/g,对照盆栽中加入等量的无菌水,所有处理均不施用肥料,每天定量喷施无菌水,保持土壤含水量。
温室保持20℃,培养一个月,测定玉米的SPAD值、株高、鲜重、全氮、磷、钾含量及土壤中IAA、矿质态氮及速效磷、钾含量,并用根系扫描仪(LA1600+scanner,Canada)扫描获得根系图像,用根系分析软件(Winrhizo2003b,Canada)扫描根系图像,获取根系部分指标的二维形态参数。
2 结果 2.1 菌株的筛选结果及其固氮酶活性、磷钾溶解及IAA合成能力从玉米根际土壤中共筛选出5株植物促生菌,分别编号为YM1、YM2、YM3、YM4和YM5。经液态摇瓶试验,结果(图 1)表明,菌株YM4的固氮能力最强,接种菌株YM4的培养基中固氮酶活性达到15.53 nmol C2H4/(h·mL),固氮能力显著高于其他4株菌株;各菌株溶解无机磷、钾的能力差异达到显著水平,其中YM2、YM4对无机磷的转化量分别达到119.48 mg/L和126.9 mg/L,转化量显著高于其他3株菌株,菌株YM1和YM4的解钾效果最显著,对难溶性钾的转化量分别高达16.65 mg/L和17.4 mg/L;对于IAA的合成能力,菌株YM2、YM4、YM5的合成量均高于28 mg/L,显著高于YM1和YM3的合成量。综合以上结果,筛选出菌株YM4为高效的固氮、解磷、解钾及合成IAA的多功能促生菌。
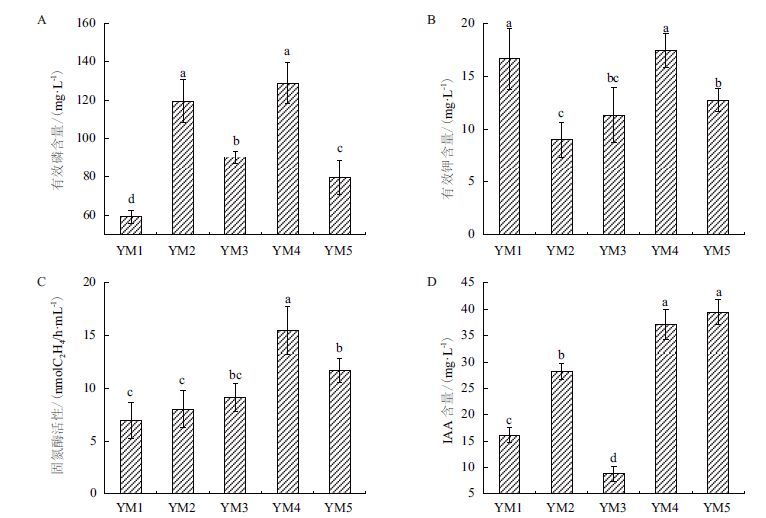
|
| 图 1 接种菌株YM4对有效磷(A)、有效钾(B)、固氮酶活性(C)及IAA(D)合成的影响 |
经平板划线、革兰氏染色,观察菌株培养特征及形态特征,可见YM4菌落小,乳白色,不透明,表面粗糙,边缘粗糙,不规则杆状排列,产芽孢(图 2)。生理生化指标见表 2。
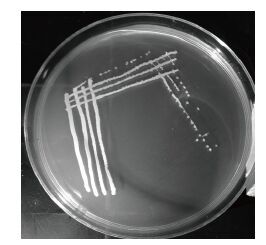
|
| 图 2 菌株YM4的菌落图 |
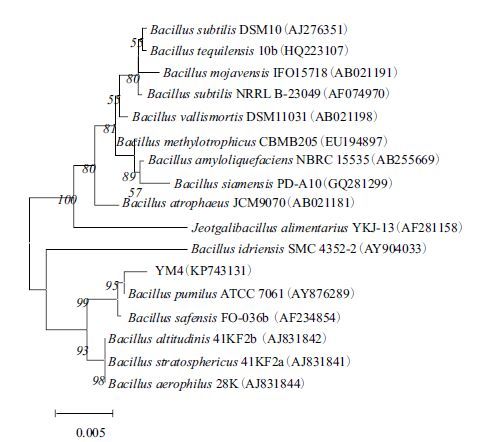
利用BLAST对该菌株进行16S rDNA的测序与16个核苷酸序列进行同源性比较,发现菌株YM4与Bacillus pumilus(AY876289)同源性为95%,运用MEGA 5.0软件构建菌株YM4的16S rDNA系统发育树,如图 3所示。并参考该菌株生理生化特征,将菌株YM4分类命名为短小芽孢杆菌(Bacillus pumilus),将其序列上传至NCBI,获得登录号为KP743131。
|
| 图 3 YM4菌株16S rRNA基因序列系统发育树 标尺代表每1 000个核苷中有5个核苷替代 |
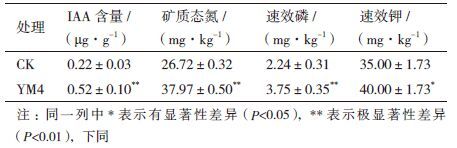
在植物根际促生菌促生效应的研究中,促生菌株的实际应用效果尤为重要。因此,本研究通过玉米盆栽试验对其促生效果进行验证。如表 3所示,与对照相比,接种菌株YM4处理土壤中的IAA、矿质态氮、速效磷含量分别提高了136.36%、42.1%和67.41%,且差异达到极显著水平,速效钾含量也增加了14.29%,差异显著。由此可见,接种菌株YM4对土壤的养分条件进行了优化,可为玉米的良好生长提供帮助。
对盆栽玉米植株根系扫描分析结果(表 4)表 明,与对照相比,接种过YM4菌液的玉米根系的总长、总面积、总体积以及根尖总数均发生了极显著变化,其中根长增加了172.2%,根表面积增加了141.7%,根总体积增加了121.1%,根尖也增加了104.5%。土壤中养分的良好供应加上发达的根系,使地上部植株长势更好。如表 5所示,与对照组相比,玉米植株的鲜重、株高、干重分别提高了130.07%、50.65%、120.08%,SPAD(Soil and Plant Analyzer Development)值和植株氮、磷、钾含量也分别提高了51.56%、20.99%、66.33%和38.21%,差异均达到极显著水平。这说明接种促生菌YM4可以促进玉米根系生长发育,且能够促进植株地上部的生长,接菌植株的生长状况均优于对照。
芽孢杆菌是土壤微生态的优势种群之一,能形成具有较强抗逆能力的芽孢,有益于其在生物有机肥的生产利用及土壤微生态环境中的生存与定殖[20],在土壤中接种一些PGPR能够促进土壤中闭蓄态P的溶解释放,增加土壤中矿质态N、有效P、K的含量,提高养分利用率,有利于植物体对N、P、K的吸收利用[21],促进植物体地上、地下部的生长发育,如Nosheen等[22]研究发现根际促生菌Azospirillum brasilense和 Azotobacter vinelandii与化学肥料混合施用,能够促进根系的生长,显著增加叶面积指数,提高叶绿素含量,替代当前化肥施用量的50%,而不影响当季植物的生长;Habibi等[23]的研究发现从玉米根际土壤中分离出的短小芽孢杆菌能够显著地促进水稻的生长。除了能够促进植株的生长,土壤中PGPR还能够促进根系的生长,并通过产生植物促生激素如IAA等改变根系的结构,增加根系的根长、根表面积、根总体积、根尖数,如Shrestha等[24]发现实验室菌株KLF01、KLC02及KPD03温室实验中,能够产生吲哚乙酸、铁载体和增溶磷酸盐,对辣椒的定殖根具有积极的作用,并能够抑制辣椒的植物细菌性斑点的发生;Yadav等[25]发现也有类似的效果,在鹰嘴豆的温室试验中接种根际N-2固氮菌能够显著地增加结荚的数目,干物质重及对N、P的吸收,还能够通过产生植物激素(IAA)刺激根际固氮菌在寄主植株内的生长,从而促进鹰嘴豆的生长,增加鹰嘴豆的产量,赵青云等[26]筛选出的B. subtilis Y-IVI能够产生铁载体,吲哚乙酸等促生类物质促进甜瓜和香草兰的生长。
盆栽试验结果表明,玉米根际多功能促生菌YM4的促生效应与以上PGPR试验具有类似的效果。接种菌株YM4能够提高矿质态N和速效P、K的有效性,增加玉米植株的株高、鲜重、干重和植物体氮磷钾含量。一般来说,株高是形态指标,它的提高能够很好地反映出玉米植株具有较好的长势[27];植株鲜重、干重等地上生物量的高低反映玉米光合产物积累的大小,是植物生产力的度量[28];植株氮磷钾含量则反映出玉米植株的营养状况[29]。除此之外,实验中,土壤中IAA含量的极显著增加对玉米植株根系生长具有重要意义,IAA是植物生长激素的一种,能促进植物生长,特别是促进根系的生长[30]。正如实验中,接菌植株较对照具有更发达的根系,结合根系形态与养分吸收的关系(肥长苗,瘦长根),从而打破这种关系,既使根得以良好生长,防止植物倒伏,又能将养分运输到地上部,使地上部长势良好。氮元素对与植物的叶片颜色影响较大,叶绿素计测量的SPAD值与植物的叶绿素成正比关系,通常使用SPAD值来进行判断氮肥的施用量[31],玉米SPAD值与干物质重量具有显著线性相关关系,在一定程度上能够预测干物质重量和玉米的产量[32]。接种菌株YM4能够极显著地提高SPAD值,说明菌株YM4能够促进玉米对氮素的吸收利用,与干物质重量的提高保持一致,对后期产量的提高可能具有一定的积极影响。
4 结论本研究从玉米根际土壤中筛选分离出根际促生菌YM4,结合该菌株的菌落形态及部分生理生化指标,运用基因序列比对方法确定该菌株为短小芽孢杆菌(Bacillus pumilus),GenBank登录号为KP743131,摇瓶试验结果表明该菌株具有较强的固氮解磷解钾及合成IAA的能力,是一株高效的多功能植物促生菌。盆栽试验结果表明,该菌株能够增加土壤中有效态氮磷钾的含量,提高土壤中IAA含量,从而促进玉米幼苗根系的生长,提高玉米幼苗植株中磷、钾的含量及叶片SPAD值,该菌株具有玉米专用微生物菌剂的应用潜力。
| [1] | 孙本喆, 郭新平, 曾苏明, 等. 我国玉米生产现状及发展对策. 玉米学 , 2003, S2 : 32–33. |
| [2] | 石德权, 郭庆法, 汪黎明, 等. 我国玉米品质现状、问题及发展优质食用玉米对策. 玉米科学 , 2001, 9 (2) : 3–7. |
| [3] | 荣良燕, 姚拓, 黄高宝, 等. 植物根际优良促生菌(PGPR)筛选及其接种剂部分替代化肥对玉米生长影响研究. 干旱地区农业研究 , 2013, 31 (2) : 59–65. |
| [4] | Prasad R, Kumar M, Varma A. Role of PGPR in Soil Fertility and Plant Health[M]// Plant-Growth-Promoting Rhizobacteria(PGPR)and Medicinal Plants. Springer International Publishing, 2015:247-260. |
| [5] | Zhou T, Yang Y, Jin Y. Study on preparation of chelated micro-fertilizer by oxidation of enzymatic hydrolysis residues of corn stalk. Journal of Cellulose Science and Technology , 2012, 20 (1) : 16–25. |
| [6] | 张瑞福, 颜春荣, 张楠, 等. 微生物肥料研究及其在耕地质量提升中的应用前景. 中国农业科技导报 , 2013, 5 : 8–16. |
| [7] | Adesemoye AO, Torbert HA, Kloepper JW. Plant growth-promoting rhizobacteria allow reduced application rates of chemical fertilizers. Microbial Ecology , 2009, 58 (4) : 921–929. DOI:10.1007/s00248-009-9531-y |
| [8] | Adesemoye AO, Torbert HA, Kloepper JW. Increased plant uptake of nitrogen from 15 N-depleted fertilizer using plant growth-promoting rhizobacteria. Applied Soil Ecology , 2010, 46 (1) : 54–58. DOI:10.1016/j.apsoil.2010.06.010 |
| [9] | Kloepper JW, Schroth MN. Plant growth-promoting rhizobacteria on radishes[C]. Proceedings of the 4th international conference on plant pathogenic bacteria, 1978, 2:879-882. |
| [10] | 王素英, 陶光灿, 谢光辉, 等. 我国微生物肥料的应用研究进展. 中国农业大学学报 , 2003, 8 (1) : 14–18. |
| [11] | 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. |
| [12] | 廖婷婷, 翟磊, 高成华, 等. 一株产甘露聚糖酶菌株的分离鉴定及酶的纯化与性质. 微生物学报 , 2011, 51 (11) : 1520–1526. |
| [13] | Libbert E, Risch H. Interactions between plants and epiphytic bacteria regarding their auxin metabolism. Physiol Plantarum , 1969, 22 : 51–58. DOI:10.1111/ppl.1969.22.issue-1 |
| [14] | Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Applied & Environmental Microbiology , 1995, 61 (2) : 793–796. |
| [15] | 王补全. 玉米根际促生菌的开发研究[D]. 太原:山西大学, 2010. http://www.cnki.com.cn/article/cjfdtotal-ahny201303054.htm |
| [16] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [17] | R·E·布坎南, N·E·吉本斯. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984. |
| [18] | 夏北成. 分子生物学方法在微生物生态学中的应用. 中山大学学报:自然科学版 , 1998, 2 : 98–102. |
| [19] | Abed ZA, Abed RT. Determining genetic distance by RAPD-PCR of maize inbred lines produced by reciprocal recurrent selection. Journal of Agricultural Technology , 2013, 9 (7) : 1799–1807. |
| [20] | 陈中义, 张杰, 黄大昉, 等. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究. 植物病理学报 , 2003, 33 (2) : 97–103. |
| [21] | Adesemoye A, Torbert H, Kloepper J. Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrient management system. Canadian Journal of Microbiology , 2008, 54 (10) : 876–886. DOI:10.1139/W08-081 |
| [22] | Nosheen A, Bano A. Potential of plant growth promoting rhizobacteria and chemical fertilizers on soil enzymes and plant growth. Pakistan Journal of Botany , 2014, 46 (46) : 1521–1530. |
| [23] | Habibi S, Djedidi S, Prongjunthuek K, et al. Physiological and genetic characterization of rice nitrogen fixer PGPR isolated from rhizosphere soils of different crops. Plant & Soil , 2014, 379 : 1–16. |
| [24] | Shrestha A, Kim BS, Park DH. Biological control of bacterial spot disease and plant growth-promoting effects of lactic acid bacteria on pepper. Biocontrol Science & Technology , 2014, 24 (7) : 763–779. |
| [25] | Yadav J, Verma JP. Effect of seed inoculation with indigenous Rhizobium and plant growth promoting rhizobacteria on nutrients uptake and yields of chickpea(Cicer arietinum L. European Journal of Soil Biology , 2014, 63 (4) : 70–77. |
| [26] | 赵青云, 赵秋芳, 王辉, 等. 根际促生菌Bacillus subtilisY-IVI在香草兰上的应用效果研究. 植物营养与肥料学报 , 2015, 21 (2) : 535–540. |
| [27] | Yin X, McClure MA, Jaja N, et al. In-season prediction of corn yield using plant height under major production systems. Agronomy Journal , 2011, 103 (3) : 923–929. DOI:10.2134/agronj2010.0450 |
| [28] | Eleanor E, Campbell, Jane MF, et al. Assessing the soil carbon, biomass production, and nitrous oxide emission impact of corn stover management for bioenergy feedstock production using DAYCENT. Bioenergy Research , 2014, 7 (2) : 491–502. DOI:10.1007/s12155-014-9414-z |
| [29] | Umesh MR, Manjunatha N, Shankar MA, et al. Influence of nutrient supply levels on yield, nutrient uptake, grain quality and economics of corn(Zea mays L. Indian Journal of Dryland Agricultural Research and Development , 2014, 29 (1) : 73–78. DOI:10.5958/2231-6701.2014.01198.1 |
| [30] | Radhakrishnan R, Shim KB, Lee BW, et al. IAA-producing Penicillium sp. NICS01 triggers plant growth and suppresses Fusarium sp. -induced oxidative stress in sesame(Sesamum indicum L. ). J Microbiol Biotechnol , 2013, 23 : 856–863. DOI:10.4014/jmb |
| [31] | Li G, Yang FT, Jiang XL, et al. Effects of plow pan on SPAD value and chloroplast ultrastructure in leaves of spring maize. Phyton(Buenos Aires) , 2013, 82 : 243–247. |
| [32] | 童淑媛, 宋凤斌, 徐洪文. 玉米不同叶位叶片SPAD值的变化及其与生物量的相关性. 核农学报 , 2008, 6 : 869–874. |