芽孢杆菌(Bacillus)是一类能产生内生孢子的杆状细菌,拥有多个种属,在自然界中分布非常广 泛,在各种土壤、水体、动物肠道和植物体内都存在[1]。与其它种属的细菌相比,芽孢杆菌能生存在各种不利因素的环境中,甚至在很多极端环境中也能很好的存活[2]。芽孢杆菌的这种能力是由其内生孢子所赋予的,它们对很多理化因素如:高温、紫外线、酸、碱和化学消毒剂等有较强的抵抗力[3]。芽孢衣壳中除含有少量脂类和多糖等化合物外,主要成分是蛋白质,这些独特外壳蛋白引起了研究者的兴趣[4]。
近年来发现芽孢外衣壳蛋白(CotA)具有多铜离子氧化酶的活性[4, 5],能氧化多数真菌漆酶的底物,被认为是细菌漆酶,有可能取代真菌漆酶而应用于各种领域[6, 7],并且还发现有些CotA可以氧化胆红素,显示出胆红素氧化酶活性,能用于测定血液中的胆红素,这预示着其在医疗诊断中也有潜在的应用价值[7]。这些发现为利用芽孢外衣壳蛋白提供了科学依据,但大规模应用CotA还存在一些需要解决的问题:其一,寻找高性能的CotA蛋白;其二,如何大量获得这些CotA蛋白。许多微生物研究资料显示,极端微生物是产生高性能和高利用价值蛋白的重要来源[8]。目前成熟的基因克隆表达技术则是获得大量目的蛋白的有效途径,甚至一些难从生物体直接获取模板的基因,可根据其已知的基因序列,通过人工合成基因来进行表达重组蛋白,这种途径也大大提高了获得目的蛋白的便利性和可行性。
为了寻求高性能的CotA蛋白,本研究拟从极端嗜碱芽孢杆菌(B. clausii KSM-K16)中克隆表达CotA蛋白(简称BC-CotA)基因,并对其生化特性进行研究。由于这种极端嗜碱芽孢杆菌不易培养,难以从其菌体中获得所需要的基因模板,但其基因组测序已经完成,可从GenBank查到cotA序列,通过优化其密码子,采用基因合成的方式获得该基因全长,使重组质粒在大肠杆菌中表达出有活性的BC-CotA,以期为利用极端嗜碱芽孢杆菌的BC-CotA提供科学依据。
1 材料与方法 1.1 材料cotA基因和相关引物由上海捷瑞生物工程有限公司合成;用于表达的质粒pET28a、XL10-gold感受态细胞及表达菌株E.coli BL21(DE3)为本实验室保存;各种限制性内切酶购自New England公司;质粒抽提试剂盒购自北京全式金公司;蛋白质Ni-IDA 高亲和力纯化柱试剂盒购自德国QIAGEN公司;2,2′-连氮-双-(3-乙基苯并噻吡咯啉-6-磺酸)(ABTS),丁香醛连氮(SGZ)和胆红素购自美国Sigma公司;其他试剂均为国产分析纯。
1.2 方法 1.2.1 基因设计、合成及鉴定根据GenBank中BC-CotA序列和大肠杆菌密码子的偏爱性,优化了基因全长序列,末端包含有Nde Ⅰ和 Xho Ⅰ两个酶切位点,合成的全长基因序列长度为1 539 bp,基因合成及重组质粒构建路线如图 1所示。用Nde Ⅰ和 Xho Ⅰ酶切合成的基因片段,然后与同样酶切的pET28a+的载体连接,转化大肠杆菌(XL10-gold),筛选重组克隆子,提取质粒,经过PCR和酶切鉴定的重组质粒送上海生工公司测序验证。
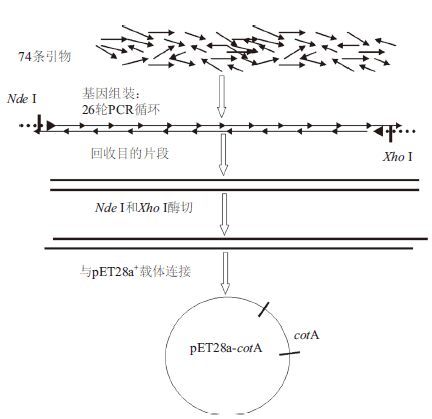
|
| 图 1 基因合成路线 |
鉴定正确的重组质粒转化于表达菌株E.coli BL21(DE3)中,挑取单菌落接种到含30 g/L卡那霉素的LB液体培养基中,于37℃、180 r/min培养至OD600≈0.6时,加入1 mmol/L的IPTG和0.3 mmol/L的硫酸铜,于28℃诱导12 h,采用SDS-PAGE分析诱导表达的蛋白。蛋白纯化使用Ni-IDA高亲和力纯化柱,按试剂盒说明书操作,纯化后蛋白经SDS-PAGE分析,并保存于-80℃备用。
1.2.3 电泳SDS-PAGE的浓缩胶5%、分离胶浓度为12%,用考马斯亮蓝R250染色2 h,脱色4 h;活性PAGE检测时,样品不需要加热和用变性剂处理,用底物ABTS、SGZ和愈创木酚分别浸泡胶条20 min至显色[9, 10]。
1.2.4 生物信息学分析为了分析不同来源CotA之间以及与真菌多铜离子氧化酶的相关性,选取了3种芽孢杆菌CotA、2种真菌漆酶和1种真菌胆红素氧化酶进行比较。生物信息学分析采用在线软件:Cobalt Constraint-based Multiple Protein Alignment Tool、ClustalW2和SWISS-MODEL。
1.2.5 酶学性质 1.2.5.1 活性测定以SGZ(50 mmol/L)作为底物,反应温度为25℃,反应体系共3 mL,分别为2.4 mL 缓冲液(50 mmol/L Na2HPO4-NaH2PO4,pH7.5)、0.1 mL酶液、0.5 mL SGZ,记录反应3 min前后在波长525 nm的吸光值变化。酶活定义:在上述条件下,每分钟催化1 μmol SGZ氧化所需的酶量称为一个酶活力单位(U)。
1.2.5.2 最适反应温度先将加有底物的反应缓冲液在不同温度(50-100℃,以5℃为间隔)下保温5 min,然后在测试之前加入酶液测其活力。
1.2.5.3 最适反应pH在酶活性测定时,将反应体系缓冲液换为Britton-Robinson缓冲液(pH6-9)测其活力。
1.2.5.4 温度稳定性将含有酶液的缓冲液置于80℃烘箱孵育,每隔10 min,取出部分酶液测定酶活性,共2 h。
1.2.5.5 酸碱稳定性将酶液加入不同pH Britton-Robinson缓冲液(pH4-11)中并置于37℃培养箱中孵育,1 h后,测定酶活性。
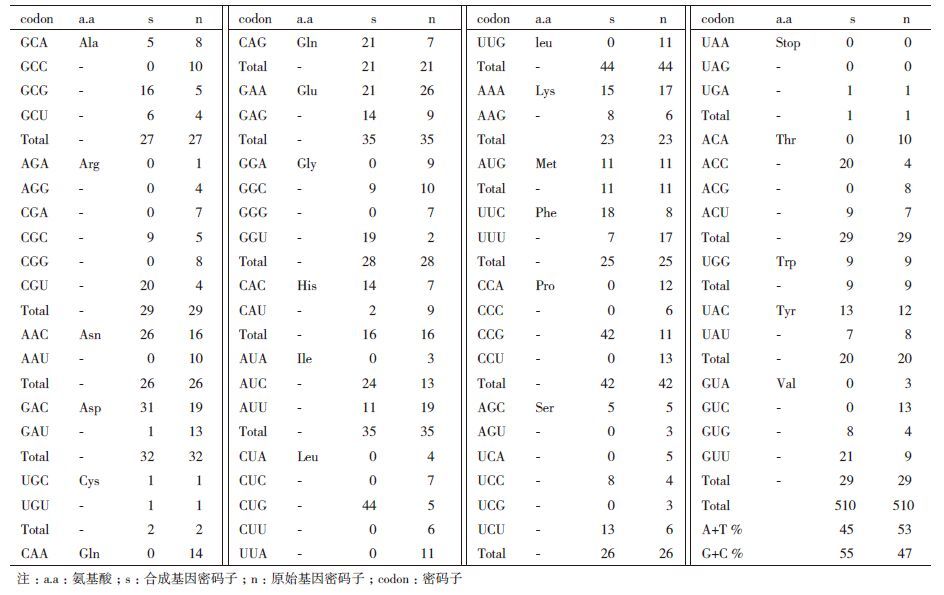
2 结果 2.1 cotA 基因合成及重组质粒鉴定cotA 基因(GI:56961782)1 530 bp,编码509个氨基酸,根据大肠杆菌表达偏爱性对编码CotA的密码子进行了优化,同时去除了一些潜在的发卡结构。从优化的密码子(表 1)中看出,调整了原cotA基因密码子比例和分布,将其编码氨基酸的密码子集中于适合在大肠杆菌中表达的密码子上。例如,编码Arg有6种密码子,在原基因中都有存在,而经过优化后,在合成基因中编码Arg的密码子主要集中在CGC和CGU。重组质粒命名为pET28a-cotA,经过PCR和酶切检测(图 2),正确的克隆子送公司测序,测序的结果与设计的基因序列一致,表明已获得正确的cotA基因全长序列,该合成的全长序列在GenBank中已注册(GI:607344463)。
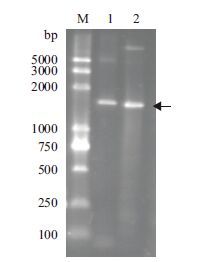
|
| 图 2 重组质粒PCR和双酶切鉴定 M:DNA Marker;1:PCR扩增;2:Nde Ⅰ 和 Xho Ⅰ酶切 |
将诱导表达后的菌体进行超声破碎,SDS-PAGE分析沉淀和上清液蛋白条带,与未经诱导的对照相比,发现沉淀和上清都有一条接近66 kD的显著蛋白条带,其中在沉淀中约占目的条带总量的73%,上清中约为27%,表明目标蛋白大部分以包涵体的形式存在于沉淀中(图 3)。收集的上清液经过Ni-IDA树脂纯化,得到纯化后的重组蛋白BC-CotA。理论上BC-CotA包含有509个氨基酸,大小约59 kD,连接载体上融合有20个氨基酸,约为2.3 kD,预测的重组蛋白大小约为62 kD,与蛋白质Marker中66 kD相比,基本与表达出的目的蛋白分子量大小一致。将纯化的重组蛋白进行活性电泳检测,发现能够氧化漆酶的典型底物SGZ、ABTS和愈创木酚,表明纯化的重组CotA具有漆酶活性。

|
| 图 3 SDS-PAGE(A)和活性电泳检测(B) 1:纯化的重组蛋白;2:沉淀;3:上清;4:愈创木酚;5:SGZ;6:ABTS; M:蛋白Marker |
BC-CotA中结合铜离子的区域在氨基酸序列101-105、148-152、408-416、482-492等4个位置, 与部分已知的芽孢杆菌CotA有约60%的同源性(表 2),除第3个铜离子结合区域有一个氨基酸差异外,与不同CotA其他3个铜离子结合区域完全一样,这表明本研究表达出的CotA蛋白与已知的CotA功能上具有相似性,但蛋白质序列有明显的差异。与两种真菌漆酶相比较,同源性在20%以下,4个铜离子结合区域也有较大的差异。与已知的漆斑菌胆红素氧化酶(Bilimbin oxidase,BOD)相比,有40%的序列同源性,4个铜离子结合区域一致,这表明CotA在功能上可能更接近于BOD。表 2显示,不论是细菌还是真菌,这些多铜离子氧化酶的结合区域中组氨酸(H)有高度的保守性。以细菌多铜离子氧化酶(PDB ID:3OD3)为模型,通过SWISS-MODEL软件建模获得其BC-CotA 3D结构 (图 4)。从其结构分析可知,整个蛋白分子由2个杯状(Cupredoxin-like)结构域组成,有3个α螺旋,5个β转角,10个β片层。其中由4个氨基酸残基(通常有1个Met)围绕着1个铜离子形成了第1个活性中心,接近于蛋白分子的外部,主要功能是结合酶底物;另外3个铜离子与一些保守残基形成了第2个活性中心,深埋于蛋白分子的内部,主要功能是将电子传递给氧分子。

|
| 图 4 BC-CotA的三维结构示意图 |
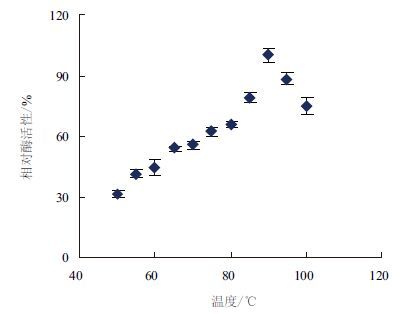
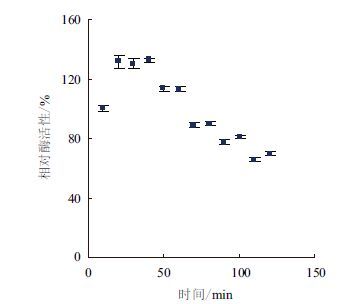
纯化后的重组蛋白CotA表现出蓝绿色,在波长609 nm处有一个明显的吸收峰(图 5),这是二型铜离子的特征峰,表明BC-CotA是一种典型的多铜离子氧化酶。BC-CotA能将无色的SGZ溶液氧化成粉红色、无色的ABTS溶液氧化成绿色、深红色的胆红素氧化成绿色(图 6),表现出多铜离子氧化酶活性。以SGZ为底物,随着温度升高,其CotA活性逐渐增加,最适温度为90℃左右,并且在100℃还能检测到较高的活性(图 7)。温度稳定性结果(图 8)显示,BC-CotA在80℃孵育时,活性先增加后下 降,有明显的热激效应,1 h内活性保持不变,2 h后还能保持原活性的70%,表明BC-CotA有很强的热稳定性。图 9显示,随着pH升高,酶活性逐渐增 加,其最适pH为7.5,并且在pH7-9保持30%以上的活性。pH稳定性结果(图 10)显示,在pH4-11,BC-CotA能保持在80%以上活性,其中在pH7和8活性基本不变,表明BC-CotA在宽泛的酸碱范围中都能保持稳定。
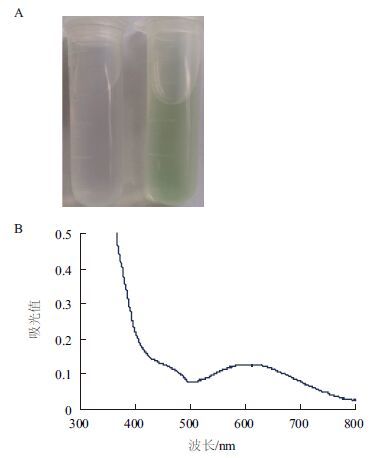
|
| 图 5 纯化的重组蛋白显色(A)及扫描光谱(B) |

|
| 图 6 BC-CotA催化不同底物颜色反应 1:对照;2:ABTS被酶催化;3:SGZ被酶催化;4:胆红素;5:胆红素被酶催化 |
|
| 图 7 温度对酶活性的影响 |
|
| 图 8 80℃时的酶活稳定性 |

|
| 图 9 pH对酶活性的影响 |

|
| 图 10 pH对酶活稳定性的影响 |
真菌漆酶底物范围广泛,在催化过程中不需要辅酶,副产物是水分子,因此有很好的应用价值,但多数真菌漆酶的最适pH值在酸性范围且不耐高温,这些是困扰真菌漆酶应用的难题,而挖掘新的漆酶来源是解决这些难题的有效途径[11-15]。CotA具有多铜离子氧化酶的活性,能催化多种漆酶底物,被认为是真菌漆酶的最适替代者[5]。日本学者Horikoshi[11]于1971年分离鉴定了极端嗜碱芽孢杆菌(B. clausii KSM-K16),目前已从该细菌中分离出一种嗜碱蛋白酶并进行了工业化生产,这预示着该细菌能产生性能特异的蛋白。由于B. clausii KSM-K16具有重要的商业价值,国内的菌种保藏中心没有获得该菌种,无法从该微生物中直接获得模板DNA。当前人工基因合成技术已经非常成熟,是基因获取的手段之一,不受基因来源限制,只需根据基因序列就能快速得到该基因[16]。另一方面,基因合成有很好的灵活性,能够修改基因的序列和内部酶切位点,从而方便下游的克隆和实验。还可以通过基因合成进行密码子优化,使合成基因在合适的宿主中得到高效表达[17, 18]。因此,本研究通过人工基因合成的方法获得cotA基因,然后成功地表达出有活性的芽孢外衣壳蛋白BC-CotA。
BC-CotA大小在59 kD,与已报道的多数CotA蛋白大小一致[19]。尽管本研究对BC-CotA已经实现了可溶性表达,但大部分蛋白以包涵体的形式存在,一方面需要对表达条件进行优化,另一方面可寻求其它合适的表达系统,Liu等[20, 21]已成功地使不同芽孢杆菌的cotA基因在酵母表达系统中得到高效表达,这也为下一步研究提供了思路。在多铜离子氧化酶中,漆酶和胆红素氧化酶的主要区别在于,漆酶不能氧化胆红素[10]。从同源性比较来看,BC-CotA与真菌的BOD有一定的同源性,其可能具有胆红素氧化酶活性,活性检测结果也证明了其确实具有BOD活性,Sakasegawa等[22]也有类似的发现,这表明BC-CotA有可能应用于临床诊断中血液的胆红素含量测定。BC-CotA能氧化典型的漆酶和胆红素氧化酶底物,与真菌漆酶相比,其底物范围更广泛,有报道显示CotA还具有锰酶活性、亚铁氧化酶和酪氨酸酶等活性[23],这表明芽孢外衣蛋白是一种复杂且功能多样的铜离子氧化酶,将其简单的定义成漆酶并不能反映其确切功能,对其酶结构的深入研究有利于了解其催化机制。在比较的几种细菌和真菌铜离子氧化酶的铜离子结合区域中,其中的组氨基酸(His)保持高度保守性,这是因为His是结合铜离子和酶内部传递电子中的必需氨基酸[24]。BC-CotA与其它CotA同源性只有60%,这可能与BC-CotA来源于极端细菌有关。
以SGZ为底物时,真菌来源的漆酶最适pH在3.5-5之间[25],而BC-CotA最适pH在7.5,在碱性pH9也有活性,同时在pH4-11范围都保持较高的稳定性,Lu等[20]报道了多数细菌漆酶最适pH为碱性条件,这表明细菌漆酶能用于真菌漆酶不适用的碱性环境。在温度稳定性结果中,BC-CotA表现出热激活效应,这一现象在其它纯化的CotA也存在[26]。多数真菌漆酶最适温度在70℃以下[25],而BC-CotA最适温度在90℃,并且其在80℃高温能保持2 h的酶活性,证明BC-CotA是一种热稳定酶。芽孢外衣蛋白CotA,表现出的酸碱稳定性和热稳定性与其结构有关,Brander等[26]指出在铜离子结合位点T2向位点T3传递电子过程中的两个氨基酸非常关键,但要阐明其机理还需要对其空间结构和电子传递路线进行详细研究。
4 结论本研究根据极端嗜碱芽孢杆菌的芽孢外衣蛋白序列及大肠杆菌密码子的偏爱性,优化并设计出其基因序列,通过合成基因的方法获得了基因全长,并成功地使其在大肠杆菌中得到高效表达。BC-CotA表现出典型的多铜离子氧化酶活性,能氧化ABTS、SGZ、胆红素等底物。其序列存在4个铜离子结合位点,与胆红素氧化酶的同源性高于真菌漆酶。以SGZ为底物,BC-CotA最适pH为7.5,最适温度为90℃,表现出很强的酸碱稳定性和热稳定性,具有潜在的应用价值。
| [1] | 赵艳, 张晓波, 郭伟. 不同土壤胶质芽孢杆菌生理生化特征及其解钾活性. 生态环境学报 , 2015 (6) : 281–284. |
| [2] | 刘文侠, 李金山, 高成华, 等. 嗜碱芽孢杆菌 Bacillus sp. N16-5表达载体的构建. 微生物学报 , 2014, 54 (1) : 89–96. |
| [3] | 鲍振国, 张文举, 胡猛, 等. 芽孢杆菌的研究进展及其在动物生产中的应用. 饲料博览 , 2012 (1) : 17–20. |
| [4] | Guan ZB, Cai YJ, Zhang YZ, et al. Complete genome sequence of Bacillus pumilus W3:A strain exhibiting high laccase activity. Journal of Biotechnology , 2015, 207 : 8–9. DOI:10.1016/j.jbiotec.2015.04.019 |
| [5] | Damas JM, Baptista AM, Soares CM. The pathway for O2 diffusion inside CotA laccase and possible implications on the multicopper oxidases family. Journal of Chemical Theory and Computation , 2014, 10 (8) : 3525–3531. DOI:10.1021/ct500196e |
| [6] | Zeng Z, Tian L, Li Z, et al. Whole-cell method for phenol detection based on the color reaction of phenol with 4-aminoantipyrine catalyzed by CotA laccase on endospore surfaces. Biosensors and Bioelectronics , 2015, 69 : 162–166. DOI:10.1016/j.bios.2015.02.032 |
| [7] | Wang TN, Lu L, Wang JY, et al. Enhanced expression of an industry applicable CotA laccase from Bacillus subtilis in Pichia pastoris by non-repressing carbon sources together with pH adjustment:Recombinant enzyme characterization and dye decolorization. Process Biochemistry , 2015, 50 (1) : 97–103. DOI:10.1016/j.procbio.2014.10.009 |
| [8] | 李江, 李光友. 极端微生物-生物活性物质的新源泉. 自然杂志 , 2011, 33 (5) : 275–278. |
| [9] | 吴林, 阳经慧, 陈明杰, 等. 草菇漆酶基因 vv-lac1 和 vv-lac6 的克隆及异源表达. 微生物学报 , 2014, 7 : 17. |
| [10] | 刘友勋, 颜克亮, 熊征, 等. 露湿漆斑菌胆红素氧化酶的分离纯化及部分性质研究. 食品与生物技术学报 , 2008, 3 : 104–108. |
| [11] | Kumar CG, Joo HS, Koo YM, et al. Thermostable alkaline protease from a novel marine haloalkalophilic Bacillus clausii isolate. World Journal of Microbiology and Biotechnology , 2004, 20 (4) : 351–357. DOI:10.1023/B:WIBI.0000033057.28828.a7 |
| [12] | Kageyama Y, Takaki Y, Shimamura S, et al. Intragenomic diversity of the V1 regions of 16S rRNA genes in high-alkaline protease-producing Bacillus clausii spp. Extremophiles , 2007, 11 (4) : 597–603. DOI:10.1007/s00792-007-0074-1 |
| [13] | Fernández-Fernández M, Sanromán Má, Moldes D. Recent developments and applications of immobilized laccase. Biotechnology Advances , 2013, 31 (8) : 1808–1825. DOI:10.1016/j.biotechadv.2012.02.013 |
| [14] | Zheng M, Chi Y, Yi H, et al. Decolorization of Alizarin Red and other synthetic dyes by a recombinant laccase from Pichia pastoris. Biotechnology Letters , 2014, 36 (1) : 39–45. DOI:10.1007/s10529-013-1323-2 |
| [15] | Wu X, Huang C, Chen Q, et al. A novel laccase with inhibitory activity towards HIV-I reverse transcriptase and antiproliferative effects on tumor cells from the fermentation broth of mushroom Pleurotus cornucopiae. Biomedical Chromatography , 2014, 28 (4) : 548–553. DOI:10.1002/bmc.v28.4 |
| [16] | 张巍, 王亚伟, 陈丰, 等. 一株全基因合成耐热甘露聚糖酶的表达及酶学性质分析. 中国生物工程杂志 , 2014, 8 : 8–11. |
| [17] | 王霞, 赵鹃, 李炳志, 等. DNA 合成技术及应用. 生命科学 , 2013, 25 (10) : 993–999. |
| [18] | 谢月辉, 余睿, 班韶, 等. 利用生物信息学数据及工具合成表达链霉亲和素基因. 暨南大学学报:自然科学与医学版 , 2011, 32 (2) : 171–175. |
| [19] | Gunne M, Al-Sultani D, Urlacher VB. Enhancement of copper content and specific activity of CotA laccase from Bacillus licheniformis by coexpression with CopZ copper chaperone in E. coli. Journal of Biotechnology , 2013, 168 (3) : 252–255. DOI:10.1016/j.jbiotec.2013.06.011 |
| [20] | Liu HP, Cheng Y, Du B, et al. Overexpression of a novel thermostable and chloride-tolerant laccase from Thermus thermophilus SG0. PLoS One , 2015, 10 (3) : e0119833. DOI:10.1371/journal.pone.0119833 |
| [21] | Lu L, Wang TN, Xu TF, et al. Cloning and expression of thermo-alkali-stable laccase of Bacillus licheniformis in Pichia pastoris and its characterization. Bioresource Technology , 2013, 134 : 81–86. DOI:10.1016/j.biortech.2013.02.015 |
| [22] | Sakasegawa S, Ishikawa H, Imamura S, et al. Bilirubin oxidase activity of Bacillus subtilis CotA. Applied and Environmental Microbiology , 2006, 72 (1) : 972–975. DOI:10.1128/AEM.72.1.972-975.2006 |
| [23] | Su J, Bao P, Bai T, et al. CotA, a multicopper oxidase from Bacillus pumilus WH4, exhibits manganese-oxidase activity. PloS One , 2013, 8 (4) : e60573–1-13. DOI:10.1371/journal.pone.0060573 |
| [24] | Silva CS, Damas JM, Chen Z, et al. The role of Asp116 in the reductive cleavage of dioxygen to water in CotA laccase:assistance during the proton-transfer mechanism. Acta Crystallographica Section D:Biological Crystallography , 2012, 68 (2) : 186–193. DOI:10.1107/S0907444911054503 |
| [25] | 李琦, 赵东霞, 刘世萍, 等. 不同来源重组漆酶的酶学特性. 南京林业大学学报:自然科学版 , 2014, 38 (3) : 93–97. |
| [26] | Brander S, Mikkelsen JD, Kepp KP. Characterization of an alkali-and halide-resistant laccase expressed in E. coli:CotA from Bacillus clausii. PLoS One , 2014, e99402 : 1–11. |