2. 江南大学 工业生物技术教育部重点实验室,无锡 214122;
3. 江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122
2. Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122;
3. National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122
角蛋白是自然界中广泛存在的一种硬性蛋白,是动物的毛发、羽毛、表皮和蹄角的组成成分[1]。角蛋白结构中β折叠结构较多,富含半胱氨酸和二硫键,不溶于水、抗分解,通常较难被一般的蛋白酶降解[2];化学方法降解角蛋白,不仅效率低,且产生较多下游废弃物,造成极大的资源浪费和环境污染[3]。角蛋白酶能专一性降解角蛋白,细菌[4]、真菌[5]、放线菌[6]等微生物均可分泌,能有效地将羽毛、羊毛等角蛋白降解成动物和人可以利用的氨基酸等产物[7],在制革、饲料、环境保护等工业中有广泛的应用前景。目前,产角蛋白酶的原始菌株由于角蛋白酶表达量不高[8]或菌株本身具有致病性[9]等因素,较少用于角蛋白酶的商业化生产。在已开展的角蛋白酶基因的克隆和异源表达研究中,以大肠杆菌为角蛋白酶的表达宿主时,通常产生包涵体,导致产酶效率不高[10];利用枯草芽孢杆菌生产角蛋白酶时,角蛋白酶产量不高,且产物对细胞的毒害作用导致细胞裂解,难以进行扩大培养[11]。巴斯德毕赤酵母是一种强效真核表达系统,由于外源基因遗传稳定、亚细胞结构的天然修饰、过氧化物酶体对细胞的保护、可进行高密度培养等优势,目前已有多种外源蛋白在该表达系统中得到了成功表达[12-14]。在前期研究中,本团队筛选到一株嗜麦芽寡养单胞菌BBE11-1,表达的角蛋白酶能有效降解羽毛和羊毛,但基于菌株的培养成本及角蛋白酶分泌量等因素,本研究拟将该角蛋白酶基因进行密码子优化,克隆到毕赤酵母表达系统,以期获得高效表达的、对羊毛和羽毛具有特异性降解作用的角蛋白酶重组菌株,旨为角蛋白酶的工业化生产提供参考。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株嗜麦芽寡养单胞菌(Stenotroph-omonas maltophilia BBE11-1)来源的角蛋白酶基因序列由本实验室克隆得到,将该基因序列根据毕赤酵母密码子偏好性进行优化,再全基因合成,得到基因序列kerD,由南京金斯瑞公司完成。大肠杆菌(JM109)菌株由本实验室保藏。巴氏毕赤酵母菌株Pichia pastoris SMD1168和分泌型表达载体pPIC9k由Invitrogen公司提供。
1.1.2 酶和试剂EcoR I、Not I和Sac I等限制性内切酶、DNA聚合酶(PrimeSTAR HS premix)、DNA连接酶、Ex Taq DNA聚合酶等均购自TaKaRa公司,G418、质粒提取试剂盒、感受态制备试剂盒、福林酚试剂均购自上海Sangon公司,DNA纯化试剂盒和胶回收试剂盒购自Thermo公司。SDS-PAGE所用的试剂购自Life公司,可溶性角蛋白购自东京化成工业株式会社,其他常规试剂采用国产分析纯或进口分装。
1.1.3 引物的设计与合成根据kerD基因序列设计引物EcoR I-F:5′-CCGGAATTCGCAGGACTTCCAAC-CAGAGAAC-3′和Not I-R:5′-AAGGAAAAAAGCGG-CCGCCTGAGTTGCCAAAATGGAAACAC-3′,根据质粒pPIC9k设计引物5′AOX1:5′-GACTGGTCCAATT-GACAAGC-3′和3′AOX1:5′-GCAAATGGCATTCTG-ACATCC-3′。引物的合成由上海Sangon公司完成。
1.2 方法 1.2.1 培养基和培养条件大肠杆菌培养使用LB培养基,配方及培养条件见pET系统手册;酵母培养使用YPD、MD、MM、BMGY、BMMY培养基,配方及培养条件见 Invitrogen公司的毕赤酵母操作手册[15]。
1.2.2 重组载体的构建利用引物EcoR Ⅰ-F、Not Ⅰ-R,通过PCR分别在基因两端添加EcoR Ⅰ和Not Ⅰ酶切位点。将PCR产物和载体pPIC9k分别用EcoR Ⅰ和Not Ⅰ双酶切,酶切产物利用DNA纯化试剂盒纯化,连接。连接产物转化大肠杆菌GM109感受态细胞,利用含有卡那霉素的LB平板筛选阳性克隆,经菌落PCR验证和酶切验证,片段大小正确后再进行测序鉴定,最终获得含有正确序列的重组质粒pPIC9k-kerD。
1.2.3 重组毕赤酵母的构建及平板筛选将重组质粒pPIC9k-kerD用Sac I线性化,电转化毕赤酵母SMD1168感受态细胞,电转化条件为:15 μL质粒(500 ng/mL)加入到85 μL的SMD1168感受态细胞中,混合后移入预冷的2 mm的电转杯中,冰上放置10 min。电压1 500 v,电容25 μF,电阻200 Ω。电击后加1 mL预冷的1 mol/L的山梨醇溶液至电转杯,混匀后将溶液转移至1.5 mL EP管中,3 000 r/min离心2 min,去上清。加100 μL预冷的1 mol/L的山梨醇溶液,涂布MD平板。利用MD平板筛选His+型(组氨酸缺陷回复突变型)重组菌株,再将得到的阳性克隆转接到MM平板上筛选Mut+型(甲醇利用快速型)的重组菌株。将筛选到的Mut+型的重组菌株分别转接到含有1、2、3、4和5 mg/mL的G418 YPD平板上,筛选到含有不同拷贝数目的基因的重组菌株,最后进行特异性菌落PCR(引物EcoR Ⅰ-F和3′ AOX)验证,筛选得到P. pastoris SMD1168-pPIC9k-kerD。
1.2.4 重组毕赤酵母的摇瓶筛选挑取上述筛选到的重组菌,接种到25 mL的BMGY培养基中,30℃,220 r/min培养24 h,5 000 r/min离心5 min,去上清,用50 mL的BMMY培养基重悬后置于500 mL锥形瓶中30℃,220 r/min诱导表达。每24 h向培养基中添加无水甲醇,使其终浓度维持0.5%,每24 h取样离心测定上清液中角蛋白酶的活性,从中筛选到表达角蛋白酶活性最高的一株重组菌株。
1.2.5 角蛋白酶活力的测定取两只1.5 mL EP管,分为样品组和对照组,分别加入150 μL pH9.0的50 mmol/L甘氨酸-NaOH缓冲液、50 μL的发酵上清液,对照组再加入200 μL的4%的三氯乙酸溶液混匀,都分别再加入100 μL的2.5%的角蛋白溶液,置于50℃金属浴中,准确反应20 min,向样品组中加入200 μL的4%的三氯乙酸溶液混匀。10 000 r/min下离心5 min。分别取200 μL上清液于新的1.5 mL EP管,分别加入1 mL的0.4 mol/L的NaCO3溶液、200 μL的福林酚溶液,50℃金属浴中准确反应10 min,冷却至室温,利用分光光度计测定660 nm处吸光值,以三氯乙酸使酶失活的样品作对照,根据酪氨酸标准曲线换算酶活[16]。酶活的定义:50℃,pH9.0条件下,角蛋白酶催化角蛋白反应过程中,1 min生成1 μg的酪氨酸所需的酶量为一个角蛋白酶酶活力单位,以U/mL表示。
1.2.6 重组角蛋白酶的纯化与SDS-PAGE发酵液8 000 r/min离心2 min,取上清,在搅拌过程中缓慢加入30%(质量与体积比)的(NH4)2SO4,离心2 min,抽滤上清。使用AKTA PURE纯化重组角蛋白酶,纯化柱使用Hi Trap Phenyl FF(high sub),1 mL,A流动相为1 mol/L(NH4)2SO4溶液,B流动相为20 mmol/L pH7.0的Tris-HCl缓冲液,上样量10 mL,流速1.0 mL /min,12%-100% B梯度洗脱8 CV,100% B洗脱5 CV。
使用12%聚丙烯酰胺凝胶预置胶对发酵样品和纯化样品进行SDS-PAGE分析。
1.2.7 醇氧化酶AOX活力的测定1 mL发酵液,8 000 r/min下离心2 min,去上清,细胞沉淀用去离子水重悬洗涤两次,离心,用50 mmol/L pH7.5的PBS溶液重悬,测定OD600 nm。取300 μL的重悬液于0℃机械破碎,加入700 µL PBS溶液,混匀,4℃,8 000 r/min 离心10 min,取上清,置于0℃。反应体系共3 mL:100 mmol pH6.0的磷酸钾缓冲液,4.3 μmol的苯酚,200 μmol的甲醇,1 μmol的APP,15 U的辣根过氧化物酶以及适量待测酶液。在37℃、500 nm,用UV2450分光光度计动态测定无细胞酶液吸光度的改变,计算出醌的增加量,测定AOX醇氧化酶的活力[17]。酶活力单位定义为:1 mL细胞重悬液,在OD600=1时,37℃,pH6.0的条件下每分钟产生1 μmol的过氧化氢(H2O2)所需的酶量,以U/mL表示。
1.2.8 双碳源混合流加发酵过程优化将通过摇瓶筛选到的重组菌株转接到YPD平板,挑取单菌落接种到含有100 mL的YPD培养基的1 L摇瓶中,置于摇床中30℃,220 r/min培养24 h作为种子液。将其接种到含有800 mL的BSM培养基的3 L全自动发酵罐(LiFlus GM BioTRON,Korea)中。以50%氨水和磷酸溶液控制pH5.5,30℃,调节搅拌转速500 r/min,通气量2 vvm;当甘油耗尽(DO迅速上升,且DO大于60%时),开始以指数流加方式流加350 mL的50%(W/V)甘油(含12 mL/L PTM1),维持比生长速率约0.18/h,并逐渐将搅拌转速调节到1 000 r/min,通气量调节到4 vvm。待甘油再次耗尽,继续保持体系中基质匮乏状态约1 h且DO大于60%后,开始流加甲醇与山梨醇(甘露醇)(分别以W/W 20∶0.5、20∶1、20∶1.5、20∶2的混合方式),以反馈流加的方式维持培养基中的甲醇浓度在1.8%(V/V)。从发酵开始每隔12 h取一次样,7 000 r/min离心1.5 min,分别取上清和菌体,测定菌体干重和上清酶活。
1.2.9 重组角蛋白酶对羊毛的处理取两个50 mL锥形瓶,分别加入缓冲液3 mL,羊毛0.3 g,样品组加1 mL纯化的酶液,对照组加1 mL灭活(沸水浴20 min)的酶液,用塑料膜封口,50℃震荡24 h。将羊毛取出晾干,拍照并做电子显微镜扫描。
2 结果 2.1 重组载体构建将kerD基因插入毕赤酵母分泌表达载体pPIC9k中,获得重组载体pPIC9k-kerD。用EcoR I和Not I双酶切,得到两个片段分别为9.3 kb和1.7 kb(图 1),测序结果进一步证明重组载体构建成功。

|
| 图 1 重组载体pPIC9k-kerD酶切验证 M:DNA Marker;P:重组载体pPIC9k-kerD EcoR I和Not I双酶切 |
先后利用MD、MM和YPD-G418平板,共筛选到14株含有不同拷贝数目的基因的Mut+型转化子。用引物EcoR I-F和3′AOX1对这些转化子进行菌落PCR,扩增出的条带与目的基因大小相符(图 2)。对这些转化子进行甲醇诱导表达,结果表明,诱导144 h时,从3 mg/mL G418的YPD平板上筛选的一株转化子酶活最高(248 U/mL)。在3 L发酵罐上,对该转化子进行诱导表达,诱导156 h时,菌体干重达到133.8 g/L,酶活1 094 U/mL。

|
| 图 2 重组子的菌落PCR M:DNA Marker;1-14:菌落PCR的阳性重组子 |
发酵罐72 h,发酵液上清经SDS-PAGE分析,在38-49 kD之间有两条特异性的条带(图 3),且随着发酵时间的增长,分子量较小的条带越来越清晰。将两个条带切下来,经过MALDI-TOFMS/MS和N端测序分析,分子量较小的为成熟酶,而分子量较大的蛋白的前导肽没有被剪切掉。

|
| 图 3 重组酵母表达角蛋白酶的SDS-PAGE M:DNA Marker;P:纯化后的样品;0:空质粒对照;1-9:72、84、96、108、120、132、144、156和168 h的发酵液上清 |
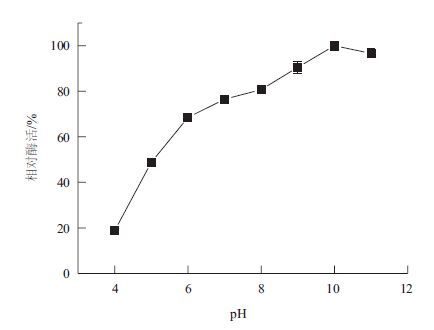
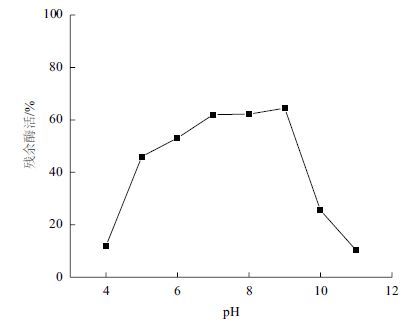
分别配制50 mmol/L pH4、pH5的乙酸-乙酸钠缓冲液,pH6、pH7磷酸缓冲液,pH8 Tris-HCl缓冲液,pH9、pH10、pH11甘氨酸-NaOH缓冲液,在50℃下测定重组角蛋白酶的最适pH为10(图 4)。将酶分别置于上述不同pH条件下,50℃保存60 min后测定酶活,以样品在最适条件下的最高酶活作对照,分析重组角蛋白酶的pH稳定性。结果(图 5)表明,重组角蛋白酶在pH5-9,经过60 min仍保留40%的比酶活,在pH9条件下保存60 min,仍然有最大酶活的64.5%,pH 大于10后,酶活迅速降低,pH10下保存60 min,酶活只剩余初始酶活的25.5%。
|
| 图 4 角蛋白酶的最适pH |
|
| 图 5 角蛋白酶的pH稳定性 |
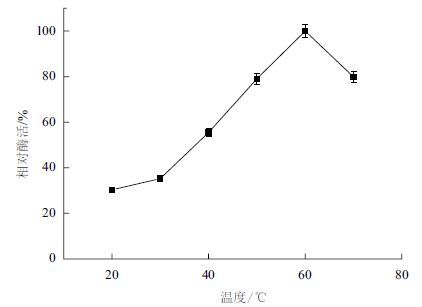
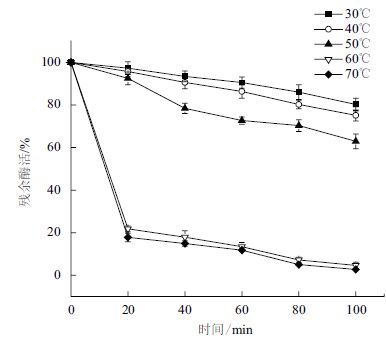
分别在30、40、50、60和70℃下测定重组角蛋白酶的活性,测定重组角蛋白酶的最适反应温度为60℃(图 6)。在pH9的缓冲体系下,将酶分别置于上述不同温度下,每20 min测定一次酶活,以不同温度下最初的酶活作对照,分析重组角蛋白酶的热稳定性,结果(图 7)表明重组角蛋白酶在50℃以下经过100 min仍保留60%的比酶活,但当温度超过60℃时,比酶活会在20 min内迅速下降到20%。
|
| 图 6 角蛋白酶活性的最适温度 |
|
| 图 7 角蛋白酶的热稳定性 |
本研究利用AOX酶(醇氧化酶)基因启动子调控角蛋白酶基因的表达,在非甲醇碳源条件(如甘油和葡萄糖)下,AOX启动子处于抑制状态,角蛋白酶基因不表达[18],而在甲醇做碳源时,角蛋白酶基因被诱导表达,AOX酶的变化直接反映了角蛋白酶基因的表达状况(图 8)。在重组毕赤酵母表达角蛋白酶的发酵过程中,醇氧化酶的活性在60 h内逐渐增加。60 h后,不同碳源混合发酵过程分别在不同的时间达到最大值,之后又逐渐下降,分别维持在不同的活性值。为了降低甲醇对细胞的毒害作用,同时又不抑制AOX启动子,采用AOX启动子的非抑制性碳源-山梨醇和甘露醇与甲醇混合流加发酵。甲醇与山梨醇以20∶1混合流加时,AOX活性最高(62.9 U/mL),比单流加甲醇提高32.2%;60 h后AOX活性最低(33.3 U/mL),比单流加甲醇提高162.2%。甲醇与甘露醇以20∶0.5混合流加时,AOX活性最高(69.4 U/mL),比单流加甲醇提高46.1%,60 h后AOX活性最低(46.5 U/mL),比单流加甲醇提高266.1%

|
| 图 8 甲醇与山梨醇(A)及甘露醇(B)混合流加中AOX酶活性变化 a-e:分别表示甲醇与山梨醇(A)及甘露醇(B)的混合比例为20∶0、20∶0.5、20∶1、20∶1.5、20∶2 |
为了提高重组毕赤酵母发酵生产角蛋白酶的产量,在3 L发酵罐中研究了双碳源[甲醇与山梨醇(图 9-A和图 9-B)和甲醇与甘露醇(图 10-A和图 10-B)]混合流加对发酵过程中生物量和角蛋白酶产量的变化。当甲醇与山梨醇以20∶0.5和20∶1(W/W)混合流加时,生物量和角蛋白酶产量都比单一流加甲醇有所提高,而甲醇与山梨醇以20∶1.5和20∶2(W/W)混合流加时结果却相反。其中甲醇与山梨醇以20∶1混合流加,发酵168 h,菌体干重达到166.2 g/L,角蛋白酶产量达到1 463 U/mL,比单一流加甲醇分别提高了22.9%和33.7%。

|
| 图 9 甲醇与山梨醇混合流加中菌体干重变化(A)及角蛋白酶产量变化(B a-e:分别表示甲醇与山梨醇的混合比例为20∶0、20∶0.5、20∶1、20∶1.5、20∶2 |

|
| 图 10 甲醇与甘露醇混合流加中菌体干重变化(A)及角 蛋白酶产量变化(B) a-e:分别表示甲醇与甘露醇的混合比例为20∶0、20∶0.5、20∶1、20∶1.5、20∶2 |
甲醇与甘露醇混合流加时,20∶0.5、20∶1、20∶1.5的混合比例都促进发酵过程中生物量和角蛋白酶产量的增加。甲醇与甘露醇以20∶0.5比例混合流加,发酵168 h,菌体干重达到134.4 g/L,角蛋白酶的产量达到2 048 U/mL,角蛋白酶产量比单流加甲醇提高了87.2%,菌体干重却仅增加了0.4%。在一定程度上增加甘露醇的流加比例,角蛋白酶的产量比单一流加甲醇时有所提高,甲醇与甘露醇的混合比例为20∶2时,生物量和角蛋白酶的产量都有下降。
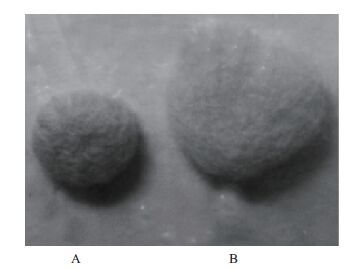
2.7 重组角蛋白酶对羊毛的处理效果分析将羊毛分别用灭活后的角蛋白酶以及有活性的角蛋白酶进行处理,如图 11所示,前者呈球状,纤维集合体较为紧密,而后者呈饼状,纤维集合体较疏松,表明经重组角蛋白酶处理后的羊毛具备了一定的抗毡化作用。
|
| 图 11 重组角蛋白酶对羊毛的处理效果分析 A:灭活的酶处理过羊毛;B:有活性的酶处理过的羊毛 |
分别对上述两种羊毛进行电子显微镜扫描,对比检测结果(图 12)发现,角蛋白酶处理过的羊毛纤维表面的鳞片层被破坏,表层边缘断裂,表面附着较多碎屑,说明角蛋白酶能够有效降解羊毛表面的鳞片层。

|
| 图 12 羊毛纤维的电子显微镜扫描图片 A:灭活角蛋白酶处理过的羊毛;B:活性角蛋白酶处理过的羊毛 |
pPIC9k携带的卡那霉素抗性赋予重组子G418抗性,而随着目的基因在毕赤酵母基因组上的拷贝数目的增加,重组子对G418的抗性也逐渐增加,因此可以利用重组子对G418的抗性筛选到目的基因的拷贝数目不同的重组子。理论上讲,目的基因的拷贝数目越高,目的产物的表达量越高,但是李兵等[19]的研究表明基因拷贝数对基因产物表达量的影响是无法预测的,高表达菌株的筛选应以表达的蛋白量或酶活为标准。本研究最终筛选到抗3 mg/mL G418的重组子的产酶能力最好,根据Invitrogen公司的多拷贝毕赤酵母表达系统说明书的经验数据,推测目的基因的拷贝数在5个拷贝左右。
毕赤酵母通常被用来高密度发酵来提高外源蛋白的表达量,因此对筛选到的重组子进行了3 L发酵罐诱导发酵,并利用疏水层析对目的蛋白进行了纯化。SDS等实验结果表明部分目的蛋白的前导肽没有被剪切掉,而条带的变化表明未正确折叠的目的蛋白在体外可以自身折叠形成成熟酶。就重组角蛋白酶的酶学性质来看,该重组酶反应的pH的范围较大,在其最适pH(pH10.0)上下变动一个单位,酶活下降很小,可见该酶对pH值不是很敏感,反应过程中pH在一定程度上变化不会对该酶的酶活造成大的影响。从pH稳定性上来看,该酶在适当的碱性环境下放置1 h仍然可以保留多半的酶活。另外从温度对重组酶的影响上来看,该酶降解角蛋白适宜在高温条件下(50℃)进行,而且酶活在一定温度范围内长时间放置损失很少。羊毛、羽毛等角蛋白的降解通常在碱性高温的环境进行,因此重组角蛋白酶十分适合用于工业中角蛋白的降解。
诱导阶段,重组P. pastoris以甲醇为唯一碳源和能源表达外源目的蛋白时,细胞生长和外源蛋白表达是一对十分尖锐的矛盾,共同争夺碳源和能源,导致外源基因表达效率低下[20]。山梨醇和甘露醇作为已知的对AOX1启动子没有抑制作用的碳源[21, 22],通常被用作额外的碳源在诱导阶段和甲醇一起流加,不仅可以弱化甲醛异化供能途径,抑制毒副产物甲醛的生成积累,同时降低体系中甲醇对细胞的压力,提高AOX1胞内启动子的表达效率,进一步提高了目的产物的产量[23, 24]。本实验中,采用甲醇与山梨醇和甘露醇混合流加的策略,从两种碳源的流加效果上来看,适量的山梨醇和甘露醇与甲醇混合流加都能在一定程度上促进胶蛋白酶产量的提高。其中甲醇与甘露醇以适当的比例混合流加时对角蛋白酶的产量的提高影响最大。从结果上来看,虽然山梨醇与甘露醇为同分异构体,但是在重组P. pastoris发酵产角蛋白酶的过程中的影响却不同,从发酵过程中醇氧化酶的活性变化来看,两种流加方式中醇氧化酶活性的变化趋势是相似的,但区别在于诱导表达后期,流加甘露醇时,醇氧化酶的活性一直维持在较高的水平,菌体对甲醇的利用效率更高,更有利于角蛋白酶的表达,因此甘露醇更适合与甲醇混合流加,来降低甲醇对菌体的毒害作用,提高角蛋白酶的产量。
在实际应用中,受羊毛纤维表面鳞片层的结构影响[25],羊毛经机械力反复作用,会出现纤维集合体逐渐收缩成球的毡化现象,导致羊毛织物在使用过程中发生变形。在本研究中,纯化的角蛋白酶作用于羊毛使其鳞片层被破坏,导致羊毛的毡化率下降,进一步证实了本研究获得的重组角蛋白酶在纺织等行业的应用价值。
4 结论本研究成功实现了嗜麦芽寡养单胞菌角蛋白酶基因在毕赤酵母SMD1168中的表达,纯化的角蛋白酶对羊毛鳞片层有显著的降解作用,可以用来改性羊毛,降低毡化率。角蛋白酶酶学性质的初步研究表明,该酶为高温碱性蛋白酶。利用甲醇和甘露醇双碳源混合流加策略发酵,角蛋白酶的产量达到2 048 U/mL,比单一流加甲醇提高了87.2%,为目前应用酵母生产角蛋白酶报道中的最高水平。
| [1] | O’Connell TC, Hedges REM, Healey MA, et al. Isotopic comparison of hair, nail and bone:modern analyses. Journal of Archaeological Science , 2001, 28 (11) : 1247–1255. DOI:10.1006/jasc.2001.0698 |
| [2] | 贾如琰, 何玉凤, 王荣民, 等. 角蛋白的分子构成、提取及应用. 化学通报:印刷版 , 2008, 71 (4) : 265–271. |
| [3] | Mazotto AM, Melo ACND, Macrae A, et al. Biodegradation of feather waste by extracellular keratinases and gelatinases from Bacillus spp. World Journal of Microbiology & Biotechnology , 2011, 27 (6) : 1355–1365. |
| [4] | Zhang J, Li B, Liao X, et al. Expression and characterization of extreme alkaline, oxidation-resistant keratinase from Bacillus licheniformis in recombinant Bacillus subtilis WB600 expression system and its application in wool fiber processing. World Journal of Microbiology and Biotechnology , 2013, 29 (5) : 825–832. DOI:10.1007/s11274-012-1237-5 |
| [5] | Liang JD, Han YF, Zhang JW, et al. Optimal culture conditions for keratinase production by a novel thermophilic Myceliophthora thermophila strain GZUIFR-H49-1. Journal of Applied Microbiology , 2011, 110 (4) : 871–880. DOI:10.1111/jam.2011.110.issue-4 |
| [6] | Jayalakshmi T, Krishnamoorthy P, Kumar GR, et al. Biochemical characterization of microbial keratinases from Actinomycetes for chick feather wastes degradation. Journal of Pharmacy Research , 2011 (9) : 3150–3152. |
| [7] | 谭盈盈, 郑平. 角蛋白的微生物降解与利用. 中国沼气 , 2001, 19 (2) : 30–34. |
| [8] | 胡洪. 角蛋白酶基因工程菌的构建和表达及重组酶酶学性质与功效研究[D]. 雅安:四川农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10626-1014103203.htm |
| [9] | Gradisar H, Friedrich JI, Jerala R. Similarities and specificities of fungal keratinolytic proteases:Comparison of keratinases of Paecilomyces marquandii and Doratomyces microsporus to some known proteases. Applied & Environmental Microbiology , 2005, 71 (7) : 3420–3426. |
| [10] | 刘柏宏, 张娟, 方真, 等. 来源于地衣芽胞杆菌的角蛋白酶在大肠杆菌中的表达、理化性质及其发酵优化. 应用与环境生物学报 , 2013 (6) : 997–1002. |
| [11] | 李明珠, 王雁萍, 秦广雍. 角蛋白酶的研究现状及发展前景. 安徽农业科学 , 2010, 38 (4) : 1689–1692. |
| [12] | Li YY, Zhong KX, Hu AH, et al. High-level expression and characterization of a thermostable xylanase mutant from Trichoderma reesei in Pichia pastoris. Protein Expression & Purification , 2014, 108 : 90–96. |
| [13] | 王瑾, 邬敏辰, 周晨妍. 内切葡聚糖酶基因在大肠杆菌与毕赤酵母中的表达. 生物技术通报 , 2008 (3) : 110–114. |
| [14] | 张银波, 姜琼, 江木兰, 等. 金针菇漆酶基因的克隆及其在毕赤酵母中的表达研究. 微生物学报 , 2004 (6) : 775–779. |
| [15] | Invitrogen. Pichia expression kit:for expression of recombinant proteins in Pichia pastoris[EB].http://tools.thermofisher. com/content/sfs/manuals/pich_man. pdf. 2014. |
| [16] | Fang Z, Zhang J, Liu B, et al. Biochemical characterization of three keratinolytic enzymes from Stenotrophomonas maltophilia BBE11-1 for biodegrading keratin wastes. International Biodeterioration & Biodegradation , 2013, 82 (8) : 166–172. |
| [17] | Suye SI, Ogawa A, Yokoyama S, et al. Screening and identification of Candida methanosorbosa as alcohol oxidase-producing methanol using yeast(microbiology & fermentation industry). Agricultural & Biological Chemistry , 1990, 54 (5) : 1297–1298. |
| [18] | 顾小勇, 李强, 曹竹安. 毕赤酵母基因工程菌胞内AOX酶的检测方法. 生物工程学报 , 2004, 17 (4) : 474–477. |
| [19] | 李兵, 庄国强, 林建强, 等. 纤维素酶基因在毕赤酵母中的拷贝数对其表达的影响. 生物加工过程 , 2006 (4) : 12–16. |
| [20] | 郭美锦, 储炬, 庄英萍, 等. 基于氧碳平衡的重组巴氏毕赤酵母碳源代谢分析. 化工学报 , 2003, 54 (12) : 1724–1728. |
| [21] | Files D, Ogawa M, Scaman CH, et al. A Pichia pastoris fermentation process for producing high-levels of recombinant human cystatin-C. Enzyme & Microbial Technology , 2001, 29 (1) : 335–340. |
| [22] | Ramon R, Valero F. Sorbitol co-feeding reduces metabolic burden caused by the overexpression of a Rhizopus oryzae lipase in Pichia pastoris. Journal of Biotechnology , 2007, 130 (1) : 39–46. DOI:10.1016/j.jbiotec.2007.02.025 |
| [23] | Gao M, Shi Z. Process control and optimization for heterologous protein production by methylotrophic Pichia pastoris. Chinese Journal of Chemical Engineering , 2013, 21 (2) : 216–226. DOI:10.1016/S1004-9541(13)60461-9 |
| [24] | Gao MJ, Li Z, Yu RS, et al. Methanol/sorbitol co-feeding induction enhanced porcine interferon-α production by P. pastoris associated with energy metabolism shift. Bioprocess & Biosystems Engineering , 2012, 35 (7) : 1125–1136. |
| [25] | 于竹青, 王树根, 王强, 等. 角质酶在全生态羊毛防缩中的作用. 纺织学报 , 2012, 33 (2) : 85–88. |




