2. 中国农业科学院北京畜牧兽医研究所,北京 100193
2. Institute of Animal Sciences,Chinese Academy of Agricultural Sciences,Beijing 100193
干细胞分为胚胎干细胞[1]、成体干细胞和诱导多能干细胞,均具有自我更新能力和多潜能性。干细胞广泛应用于临床治疗,为器官衰竭、组织创伤、先天性结构异常等疾病的治疗提供了新方法。然而这些治疗具有潜在的局限性,包括伦理学问题[2]、器官短缺、供体损伤、过敏反应和排斥反应等。成体干细胞在具有同样性质的前提下,不涉及伦理道德问题,免疫原性低且易于获取,因此具有更为广泛的应用前景[3]。
间充质干细胞(MSCs)为来源于中胚层的非造血干细胞,免疫原性低,不涉及伦理道德问题,是目前为止最具成体干细胞多潜能特征的一类细胞,存在于多种结缔组织和器官中。间充质干细胞是一类具有骨形成能力和造血功能的细胞群,来源广泛。从皮肤[4]、骨骼肌[5]、脐带[6]、骨膜[7]、外周血[8]、滑膜[9]、周细胞[10]、乳牙[11]等组织中分离出的干细胞具有与骨髓间充质干细胞相似的生物学特性。但由于组织有限、不易获取或获取的细胞数量低、体外大量增殖困难等条件的限制,使其治疗应用受到限制。
2011年Zuk等[12]首次从脂肪组织中分离出一种具有多分化潜能的干细胞,将其命名为脂肪来源的间充质干细胞(adipose-derived stem cells,ADSCs)。尽管ADSCs来自于中胚层,但是具有多胚层分化和多系分化的潜能,在一定条件下能够分化成各胚层特定的体细胞。ADSCs能够分化成脂肪细胞、软骨细胞、骨细胞、肌细胞、牙周细胞[13]、心肌细胞、血管内皮细胞和肌腱细胞[14]等中胚层细胞。
相比较而言,ADSCs来源广泛、取材方便、对供区创伤小、易于获得大量细胞、免疫原性低、具有自我更新和多分化潜能,是目前干细胞应用的理想种子细胞。目前,针对ADSCs的研究,大部分集中于鼠、兔、人或其他哺乳动物[15],对禽类物种的研究很少见。本研究对18日胚龄鸭的ADSCs进行分离培养,对自我更新能力和多分化潜能进行研究,针对表面标记物的表达进行鉴定,旨在为ADSCs的体外培养及生物学特性研究提供新思路。
1 材料与方法 1.1 材料18日龄北京鸭鸭胚由中国农业科学院北京畜牧兽医研究所家禽实验基地提供。
DMEM/F12、胎牛血清、B27、胰蛋白酶为美国Gibco公司产品,Ⅰ型胶原酶、DMSO、TritonX-100、L-谷氨酰胺、地塞米松、3-异丁基-1-甲基黄嘌呤、吲哚美辛、胰岛素、油红O、β甘油磷酸钠、维生素C、茜素红、5-氮杂胞苷、台盼蓝为美国Sigma公司产品,bFGF为英国Peprotech公司产品,BSA、山羊血清、山羊抗兔FITC标记二抗为中国北京中杉金桥生物技术有限公司产品,CD29、CD44、CD105、Mhc、cTnT、GATA为美国Abcame公司产品,多聚甲醛为北京化工厂产品,Trizol为美国Invitrogen公司产品,反转录试剂盒TaKaRa RNA PCR Kit(AMV)Ver. 3.0为中国大连宝生物工程有限公司产品。其他试剂均为国产分析纯试剂。
1.2 方法 1.2.1 ADSCs的分离培养无菌取18日龄鸭胚腹股沟处及腹部皮下脂肪组织,于含1%青链霉素的预冷PBS中漂洗5-8遍后剪碎成糊状,0.1%胶原酶Ι 37℃消化1 h,消化液的量以浸没组织为宜。为了使组织与消化液反应充分,消化过程中可适当晃动平皿[16]。用200目细胞筛过滤,收集滤液于15 mL离心管中,室温下1 200 r/min离心10 min。弃去液体层,用完全培养基[10%FBS,1%B27(Gbico),10 ng/mL bFGF(Peprotech),2 mmol/L L-谷氨酰胺的DMEM/F-12]重悬细胞沉淀后,以3×104/cm2浓度接种于直径60 mm的细胞培养皿中,37℃、5%CO2培养。隔日换液。
当细胞生长至80%-90%融合时,弃去培养基,PBS漂洗2次,0.25%胰蛋白酶37℃消化,大量细胞回缩变圆时,以完全培养基反复吹打细胞,视细胞密度进行1∶2或1∶3比例进行传代。传代过程中,观察细胞形态并拍照,每3 d更换一次培养基。通常3-4代后,细胞被纯化。
1.2.2 生长曲线常规法消化收集生长状态良好的P2、P5、P8代细胞,以1.0×104细胞/mL的密度接种于24孔板。每天随机选取3个孔进行消化计数,每孔计数3次,台盼蓝染色测定细胞活率。以细胞数为纵坐标,培养时间为横坐标,绘制生长曲线[17]。根据生长曲线计算细胞群体增倍时间(Population doubling time,PDT)。计算公式为:
PDT=(t-t0)lg2/(lgNt-lgN0)
其中,t:培养终止时间;t0:培养起始时间;Nt:培养终止细胞数;N0:培养起始细胞数。
1.2.3 ADSCs的RT-PCR检测应用RT-PCR技术检测ADSCs的CD29、CD44和CD105基因的表达,引物由生工生物工程股份有限公司设计合成(表 1)。Trizol法提取第3代ADSCs总RNA,反转录成cDNA后进行PCR扩增。PCR反应体系40 μL:ddH2O 14 μL,2×dNTP Mixture 20 μL,上下游引物各2 μL,cDNA 2 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,退火30 s,72℃延伸30 s,35个循环;72℃延伸5 min,产物4℃保存。产物进行质量浓度为20 g/L的琼脂糖凝胶电泳,紫外透射仪检测目的基因的表达情况。
取第3代ADSCs,当细胞融合至50%-60%时,用PBS漂洗3遍,每次5 min,4%多聚甲醛室温条件下固定15 min,预冷PBS漂洗3次。0.25%Triton X-100通透20 min后,10%山羊血清室温(中杉金桥)封闭30 min,然后加入抗体CD29(1∶100稀释),CD44(1∶100),CD105(1∶100)4℃孵育过夜。弃一抗,PBS漂洗3次然后加入FITC标记的山羊抗兔二抗(1∶100 中杉金桥),室温避光孵育1 h。避光PBS漂洗3次。最后,用1 µg/mL DAPI孵育30 min后PBS漂洗3次[18]。于激光共聚焦显微镜下观察并拍照。
1.2.5 ADSCs表面标记的阳性率鉴定当细胞融合至80%-90%时,常规法消化收集细胞,1 500 r/min离心10 min。弃上清,PBS洗涤沉淀后用预冷的70%乙醇重悬细胞,4℃过夜。1 200 r/min离心10 min后,弃去上清并用PBS洗涤沉淀。0.25% Triton X-100通透15 min后,PBS漂洗,10%山羊血清(中杉金桥)封闭1 h后,1 200 r/min离心10 min,弃上清。加入抗体CD29(1∶100稀释),CD44(1∶100),CD105(1∶100)4℃孵育过夜,对照组加入PBS。弃去一抗和对照组的PBS,PBS漂洗后加入FITC标记的山羊抗兔二抗(1∶100,中杉金桥),室温避光孵育1 h。弃掉二抗,PBS漂洗后稀释,经80 µm细胞筛处理后上机检测。选择参数后,即可画图选择分析区域,排除气泡上样分析后,可收集数据[19]。
1.2.6 ADSCs的诱导分化及鉴定 1.2.6.1 ADSCs的成脂诱导分化及鉴定细胞生长达到50%-60%融合时,应用成脂诱导液(DMEM/DF12+10% FBS+1 µmol/L地塞米松+0.5 mmol/L 3-异丁基-1-甲基黄嘌呤+200 µmol/L吲哚美辛+10 mg/L胰岛素)诱导ADSCs分化,对照组用全培养基继续培养。
3周后应用油红O染色法[20]。观察脂滴,拍照。利用RT-PCR方法检测脂肪细胞特异性基因脂蛋白脂酶(lipoprotein lipase,LPL)和过氧化物酶体增殖因子活化受体-γ(peroxisome proliferato-activated receptor γ,PPAR-γ)的表达情况。
1.2.6.2 ADSCs的成骨诱导分化及鉴定细胞生长达到50%-60%融合时,应用成骨诱导液(DMEM/DF12+10%FBS+10-7 M地塞米松 + 10-2 M β-甘油磷酸 + 50 mg/L Vc)诱导ADSCs分化。对照组用完全培养基培养。
3周后应用茜素红染色法[20]。镜检,拍照。利用RT-PCR方法检测成骨细胞特异性基因骨桥蛋白(Osteopontin)和Ⅰ型胶原(Collagen type Ⅰ)的表达情况。
2 结果 2.1 ADSCs的分离培养与形态学观察接种24 h后,大部分细胞贴于培养皿底部并向周围延伸,可见部分多角形、三角形、扁平状细胞,其中混有大量卵圆形的血细胞(图 1-A)。多次换液后血细胞被祛除,剩余细胞呈现典型的成纤维状。传代后,细胞生长迅速,随着传代次数增加,细胞逐渐被纯化,细胞形成致密单层,呈旋涡状走势。连续代次之间细胞保持稳定的形态,没有明显差别(图 1-B-D)。10代后,细胞增殖速度减慢,开始出现衰老现象(图 1-E)。传至13代时,细胞衰老明显,空泡化加剧、核固缩(图 1-F)。随着培养时间的延长,部分细胞会从培养皿上脱落。

|
| 图 1 ADSCs 形态特征(40×) A:接种24 h后的原代细胞;B:P3;C:P6;D:P9;E:P12;F:P13 |
分别计数P2、P5、P8代ADSCs的增殖情况并绘制生长曲线(图 2)。ADSCs的增殖过程经历了潜伏期、对数期、平台期,生长曲线成典型的“S”形。ADSCs潜伏期约为24 h,培养36 h后,细胞进入对数生长期,群体增倍时间(PDT)约为36 h,接种第7天细胞生长速度减慢,进入平台期。表明体外培养ADSCs具有良好的自我更新和增殖能力,易于体外扩增培养。

|
| 图 2 ADSCs 生长曲线 |
由于体内环境和体外培养条件下,ADSCs均表达CD29、CD44和CD105这3种标记基因[21],因此本实验针对这3种基因进行检测。RT-PCR结果(图 3-A)显示分离培养的ADSCs阳性表达3种标记基因。对P4代ADSCs进行免疫荧光检测(图 3-B)和阳性率分析(图 3-C),结果表明ADSCs阳性表达CD29、CD44和CD105,其阳性率分别为95.39%、94.53%和98.19%。
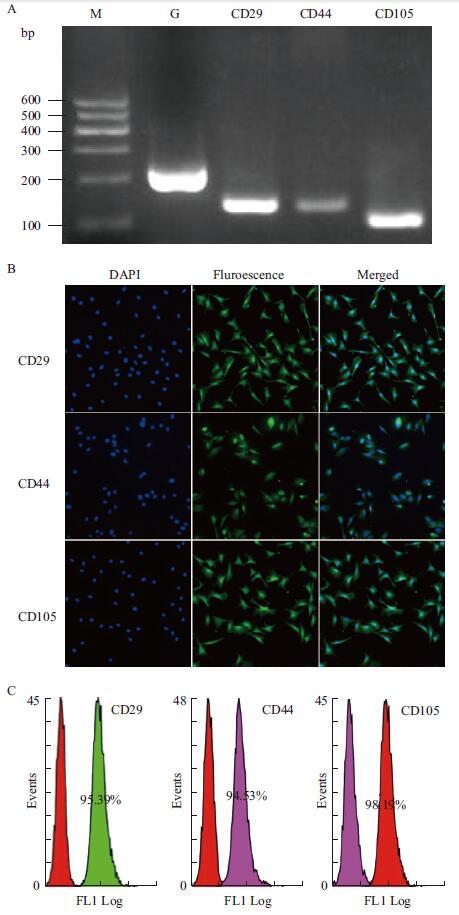
|
| 图 3 A:ADSCs的RT-PCR检测,ADSCs阳性表达CD29,CD44和CD105。M:MARKER;G:GAPDH;CD29:145 bp;CD44:141 bp;CD105:120 bp。B:ADSCs的免疫荧光检测,ADSCs阳性表达CD29,CD44和CD105(scale bar=50 µm)。C:ADSCs流式细胞阳性率检测,ADSCs阳性表达CD29,CD44和CD105,其阳性率分别为95.39%,94.53%,98.19% |
成脂诱导过程中,对照组ADSCs未见形态的改变,无脂滴形成(图 4-A)。诱导组成脂分化7 d部分细胞由长梭型变为扁圆形,出现少量脂滴。随着诱导时间的延长,脂滴排列紧密且相互融合,体积增大,折光性增强。14 d后,可见大量脂滴环状排列,一些大脂滴几乎占据整个细胞(图 4-B)。诱导21 d时进行油红O染色,可见对照组不着色,诱导组细胞内脂滴被染成红色(图 4-C)。RT-PCR检测仅诱导组细胞表达LPL和PPAR-γ(图 4-D)。
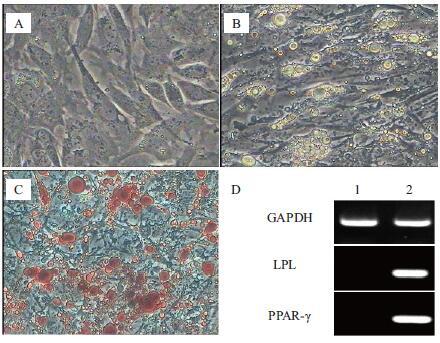
|
| 图 4 ADSCs成脂诱导分化及鉴定 A:对照组ADSCs无脂滴形成;B:诱导组ADSCs形成大量脂滴;C:油红O染色,诱导组ADSCs被染成红色;D:诱导后的ADSCs表达LPL和PPAR-γ,对照组不表达,GAPDH为内参(A-C:200×) |
成骨诱导过程中,对照组细胞形态未见改变,未形成钙结节(图 5-A)。诱导组培养10 d后(图 5-B),部分细胞变成卵圆形,细胞聚集形成结节,折光性增强。14 d时,结节状细胞增多,钙盐沉积增加。培养21 d时,茜素红染色发现,对照组无着色情况,诱导组结节呈现明亮的红色(图 5-C)。RT-PCR结果(图 5-D)显示仅诱导组细胞能够表达成骨细胞特异性基因Osteopontin和Collagen type Ⅰ。
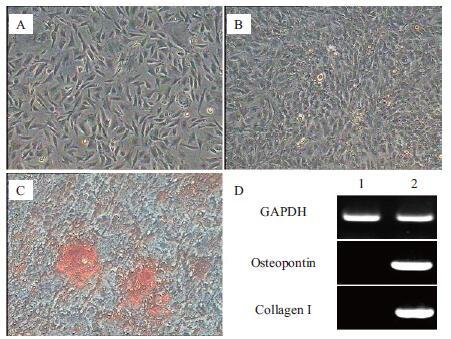
|
| 图 5 ADSCs成骨诱导分化及鉴定 A:对照组ADSCs(40×);B:ADSCs诱导10 d,(40×);C:ADSCs诱导21 d时(100×);D:诱导后的ADSCs |
脂肪间充质干细胞来源广泛,取材方便,易于获得大量细胞,免疫原性低,具有自我更新和多分化潜能,是目前干细胞应用的理想种子细胞。依据脂肪的分布部位和功能特点,可将其分为两类:一类为白色脂肪组织,分布于皮下及脏器周围,主要参与脂肪代谢和能量代谢等生理活动;另一类为棕色脂肪组织,主要分布于新生动物的肩胛部,当生物体受寒冷刺激时,可氧化分解进而散发热能。但是目前针对于ADSCs的研究,主要集中于哺乳动物,关于禽类脂肪干细胞的研究较少。本实验成功分离了18日龄鸭胚的脂肪间充质干细胞,并验证了其自我更新能力和多分化潜能。用0.1%的Ⅰ型胶原酶37℃消化60 min,细胞增殖分化能力良好。ADSCs的增殖扩散能力受供体年龄,脂肪组织类型(白色/棕色脂肪组织)和位置(皮下/内脏)有关。通常供体年龄越小,ADSCs增殖能力和黏附性就越好,随着细胞代次的增高,增殖能力也逐渐降低[21]。通过对人ADSCs长期体外培养发现,人ADSCs的衰老水平很低,传至P10代时只有不到5%的细胞表现出衰老现象[12]。初代ADSCs中混杂着许多血细胞,通过多次换液和传代可去除,体外培养至13代。本实验ADSCs的生长曲线呈“S”型,从培养36 h开始进入指数生长期,第8天达到高峰,随后逐渐降低。
目前脂肪干细胞主要从形态学、细胞表面标记、功能等方面进行鉴定。形态学研究表明传至第3代的ADSCs多呈成长梭形,且按一定方向排列[22, 23]。关于脂肪间充质干细胞特异性表面标记,目前说法尚不统一,因此,本实验选择了体内环境和体外培养条件下ADSCs均会表达的几种间充质干细胞标记物。本实验选择了CD29、CD44、CD105这3种细胞表面标记进行了检测。CD29在胚胎形成、止血、组织修复、恶性肿瘤细胞转移和免疫反应过程中具有细胞黏附与识别的作用[24]。CD44是一种细胞表面的糖蛋白,在肿瘤细胞侵袭转移中起促进作用,主要参与异质性黏附,即肿瘤细胞与宿主细胞和宿主基质的黏附[25]。CD105是转化生长因子β(TGF-β)的受体蛋白,可调节细胞增殖[26]。本实验用RT-PCR、流式阳性率和免疫荧光检测第3代ADSCs CD29、CD44和CD105的表达,结果证实实验提取的细胞为ADSCs。虽然ADSCs来源于中胚层,但是具有多胚层分化和多系分化的潜能,在一定条件下能够分化成各胚层特定的体细胞。本实验选择脂肪分化前期的标记基因LPL和脂肪分化中期的标记基因PPAR-γ[27]为标记,采用条件培养基成功地将ADSCs诱导为脂肪细胞和成骨细胞,从而证实了ADSCs的多分化潜能。
然而,尽管ADSCs在体外具有多分化潜能,利用干细胞移植进行细胞治疗仍然存在许多安全问题和技术问题。因此还需要进一步深入研究,使ADSCs有望成为细胞治疗和组织工程应用的优秀种子细胞。
4 结论本实验成功分离了18日龄鸭胚的脂肪间充质干细胞,通过体外培养及诱导分化鉴定证明了体外培养的ADSCs具有自我更新能力和多分化潜能。
| [1] | Mizuno H, Tobita M, Uysal AC. Concise review:Adipose-derived stem cells as a novel tool for future regenerative medicine. Stem Cells , 2012, 30 (5) : 804–810. DOI:10.1002/stem.1076 |
| [2] | Forcales SV. Potential of adipose-derived stem cells in muscular regenerative therapies. Front Aging Neurosci , 2015, 7 : 123. |
| [3] | Bieau B, Hochmuth CE, Jasper H. Maintaining tissue homeostasis:dynamic control of somatic stem cell activity. Cell Stem Cell , 2011, 9 (5) : 402–411. DOI:10.1016/j.stem.2011.10.004 |
| [4] | Alvarez D, Levine M, Rojas M. Regenerative medicine in the treatment of idiopathic pulmonary fibrosis:curent position. Stem Cells Cloning , 2015, 8 : 61–65. |
| [5] | Costamagna D, Berardi E, Ceccarelli G, et al. Adult stem cells and skeletal muscle regeneration. Curr Gene Ther , 2015, 15 (4) : 348–363. DOI:10.2174/1566523215666150630121024 |
| [6] | Maslova O, Novak M, Kruzliak P. Umbilical cord tissue-derived cells as therapeutic agents. Stem Cells Int , 2015 : 150609. |
| [7] | Dao LT, Park EY, Lim SM, et al. Transplantation of insulin-producing cells differentiated from human periosteum-derived progenitor cells ameliorate hyperglycemia in diabetic mice. Transplantation , 2014, 98 (10) : 1040–1047. DOI:10.1097/TP.0000000000000388 |
| [8] | Hopper N, Wardale J, Brooks R, et al. Peripheral blood mononuclear cells enhance cartilage repair in in vivo osteochondral defect model. PLoS One , 2015, 10 (8) : e0133937. DOI:10.1371/journal.pone.0133937 |
| [9] | Nakagawa Y, Muneta T, Kondo S, et al. Synovial mesenchymal stem cells promote healing after meniscal repair in microminipigs. Osteoarthritis Cartilage , 2015, 23 (6) : 1007–1017. DOI:10.1016/j.joca.2015.02.008 |
| [10] | Pierantozzi E, Badin M, Vezzani B, et al. Human pericytes isolated from adipose tissue have better differentiation abilities than their mesenchymal stem cell counterparts. Cell Tissue Res , 2015, 361 (3) : 769–778. DOI:10.1007/s00441-015-2166-z |
| [11] | Isobe Y, Koyama N, Nakao K, et al. Comparison of human mesenchymal stem cells derived from bone marrow, synovial fluid, adult dental pulp, and exfoliated deciduous tooth pulp. Int J Oral Maxillofac Surg , 2016, 45 (11) : 124–131. |
| [12] | Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue:implications for cell-based therapies. Tissue Eng , 2001, 7 (2) : 211–28. DOI:10.1089/107632701300062859 |
| [13] | Tobita M, Mizuno H. Periodontal disease and periodontal tissue regeneration. Curr Stem Cell Res Ther , 2010, 5 : 168–174. DOI:10.2174/157488810791268672 |
| [14] | 侯凯, 李梅, 李金茹, 等. 体外诱导大鼠脂肪源间充质干细胞成肌腱潜能的研究. 中国现代医学杂志 , 2011, 21 (8) : 929–933. |
| [15] | Gong X, Hou L, Bai C, et al. Isolation and biological characteristics of chicken adipose-derived progenitor cells. DNA Cell Biol , 2011, 30 (7) : 453–460. DOI:10.1089/dna.2010.1154 |
| [16] | Bai C, Wang D, Li C, et al. Establishment and biological character-istics of a Jingning chicken embryonic fibroblast bank. Eur J Histochem , 2011, 55 (1) : e4. DOI:10.4081/ejh.2011.e4 |
| [17] | Bai CY, Li XC, Hou LL, et al. Biological characterization of chicken mesenchymal stem/progenitor cells from umbilical cord Wharton’s Jelly. Mol Cell Biochem , 2013, 376 : 95–102. DOI:10.1007/s11010-012-1553-y |
| [18] | Li X, Gao Y, Hua J, et al. Research potential of multi-lineage chicken amniotic mesenchymal stem cells. Biotechnic & Histochemistry , 2014, 89 (3) : 172–180. |
| [19] | 美国贝克曼库尔特公司. CytomicsTM FC 500型流式细胞仪培训教程[M]. 美国贝克曼库尔特公司(BeckmanCoulter Ltd.)流式产品部. |
| [20] | Bai CY, Hou LL, Li FH, et al. Isolation and biological characteristics of beijing fatty chicken skeletal muscle satellite cells. Cell Communication & Adhesion , 2012, 19 (5-6) : 69–77. |
| [21] | Mizuno H, Tobita H, Uysal AC. Adipose-derived stem cells as a nobel tool for future regenerative medicine. Stem Cells , 2012, 30 (5) : 804–810. DOI:10.1002/stem.1076 |
| [22] | Malik HN, Dubey A, Singhal DK, et al. 204 isolation, characterization, and differentiation of adipose tissue derived mesenchymal stem cells:an autologous transplantation to patients. Reprod Fertil Dev , 2013, 26 : 216. |
| [23] | Dubey A, Malik HN, Singhal DK, et al. 198 isolation, characteriz-ation, and in vitro differentiation of goat adipose-tissue-derived mesenchymal stem cells into pancreatic islets-like cells. Reprod Fertil Dev , 2013, 26 : 213. |
| [24] | Yan L, Cao R, Pan B, et al. In vitro study of TGF-β1-induced epithelial-mesenchymal transition of keloid epithelial cells. Zhonghua Zheng Xing Wai Ke Za Zhi , 2015, 31 (2) : 128–133. |
| [25] | Sackstein R, Merzaban JS, Cain DW, et al. Ex vivo glycan engineering of CD44 programs human multipotent mesenchymal stromal cell trafficking to bone. Nat Med , 2008, 14 (2) : 181–187. DOI:10.1038/nm1703 |
| [26] | Sanz-Rodriguez F, Guerrero-Esteo M, Botella LM, et al. Endoglin regulates cytoskeletal organization through binding to ZRP-1, a member of the Lim family of proteins. J Biol Chem , 2004, 279 (31) : 32858–32868. DOI:10.1074/jbc.M400843200 |
| [27] | 陈佳, 王桂艳, 张宇. 北京鸭胚胎后肾间充质干细胞分离培养及鉴定. 生物技术通报 , 2015, 31 (6) : 177–182. |





