碘缺乏病(iodine deficiency disorders,IDD)的最大危害是导致不同程度的脑发育障碍,其具体的分子作用机制仍是当前的主要研究方向。同源盒基因Nkx6.1作为一种反式作用因子,与神经系统的分化与发育关系极为密切,对于甲状腺特异基因的表达有重要的作用[1]。Nkx6.1在胚胎期可影响神经元分化[2],并在随后的脑发育及成熟阶段对髓鞘形成、神经元轴突-胶质细胞连接和维持髓鞘稳定等产生影响[3]。研究表明,大鼠仔鼠Nkx6.1基因表达水平会因母体低碘膳食而发生显著改变[4]。脑发育时期甲状腺激素(thyroid hormone,TH)缺乏会导致中枢神经系统重要神经细胞异常,并伴随NKx6.1的低表达[5]。以上的研究事实可以初步表明甲状腺激素可能通过影响NKx6.1的表达来进一步影响脑部神经系统的发育与成熟,但甲状腺激素影响NKx6.1表达的具体机制并没有得到阐释。甲状腺激素的基因组功能是通过甲状腺激素受体(TRs)介导完成的,它们结合形成 TH-TR 复合物,再辅与激活因子、抑制因子,直接调节目标基因的转录[6]。本实验以研究T3核受体(T3R)对NKx6.1启动子活性的影响为切入点,来揭示甲状腺素对NKx6.1的调控机制,以期为进一步研究同源盒基因NKx6.1在甲状腺素缺乏导致脑发育迟滞过程中的分子作用机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种、载体和细胞大鼠星形胶质细胞、感受态大肠杆菌DH5α、pRL-SV40、pGL3-Basic质粒为天津市内分泌研究所保藏,pEASY-T3购自北京全式金公司。
1.1.2 试剂及耗材Tissue DNA Kit购自OMEGA,限制性内切酶Kpn I和Bgl II购自大连宝生物(TaKaRa),T4 DNA连接酶购自Thermo,TransTaq DNA Polymerase High Fidelity和TransStart FastPfu DNA Polymerase购自北京全式金公司,质粒提取试剂盒、凝胶回收试剂盒、DNA marker均购自天根公司,双荧光素酶报告基因检测试剂盒购自Promega,Lipofectine 2000购自Invitrogen。
1.1.3 基因与引物PCR引物根据UCSC和GenBank核酸数据库应用Primer Premier 5设计,由北京奥科鼎盛公司合成,目的基因测序由Invitrogen公司完成。引物序列见表 1。
提取大鼠脑组织基因组DNA,根据GenBank提供的大鼠NKx6.1基因(登录号:NM031737)第一个外显子的起始密码子的5'上游3 000 bp序列,设计带有酶切位点Kpn I和Bgl II的上下游引物,并扩增2 325 bp启动子片段。PCR反应条件为:预变性95℃ 5min;95℃ 30 s,56℃ 30 s,72℃ 2.5 min,共35个循环;72℃延伸 10 min。PCR产物电泳,回收目的片段,克隆至pEASY-T3载体进行酶切测序鉴定。测序正确的目的片段与pGL3-Basic荧光报告载体连接,命名为pGL3-2.3。利用JASPAR(http://jaspar.genereg.net/)和alggen(http://alggen.lsi.upc.es),对T3R潜在结合位点进行预测,根据预测的结合位点,设计带酶切位点的引物,扩增启动子截短片段,克隆到pGL3-Basic上,分别命名为pGL3-1.8、pGL3-1.5。
1.2.2 细胞培养与转染大鼠星形胶质细胞用含有10%胎牛血清的RPMI1640培养液(100 U/mL青霉素,100 U/mL链霉素),在37℃、含有5% CO2 的细胞培养箱内贴壁培养。转染前24 h,将大鼠星形胶质细胞接种于24孔板,细胞汇合度达到60%-70%时转染。按照Lipofectine 2000使用说明书,将构建的系列截短片段荧光素酶报告质粒和转录因子表达载体以及pRL-SV40共转大鼠星形胶质细胞,转染36 h后收集细胞并进行荧光素酶活性检测。每个启动子做3次独立实验,每次3个重复。
1.2.3 双荧光素酶活性分析转染36 h的细胞,除去细胞培养基,用1×PBS洗涤1次,24孔板每孔加入100 μL 1×PLB,用枪头刮下细胞,转至离心管中,8 000×g离心1 min。样品20 μL与Luciferase Assay Buffer II混合,立即用荧光发光计测量活性,然后再加入Stop & Glo测量活性,荧光素酶检测试剂LAR II和Stop & Glo的进样体积均为50 μL,延迟时间2 s,检测时间10 s;先后读数分别为萤火虫荧光素酶活性和海肾萤光素酶活性,计算相对荧光素酶活性。
1.3 统计学分析应用统计学软件SPSS17.0进行统计分析,所有数据均用x±s表示,并经方差分析检验差异是否具有统计学意义。
2 结果 2.1 大鼠NKx6.1启动子序列及生物信息学分析本实验以大鼠脑组织基因组DNA为模板,通过PCR特异性扩增了2 325 bp的NKx6.1基因5'端上游启动子片段。用生物信息学的方法分析预测序列上存在2个潜在的T3R转录因子结合位点(图 1)。
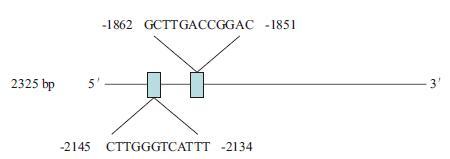
|
| 图 1 NKx6.1 启动子克隆及生物信息学分析 |
根据预测的T3R结合位点,以测序正确的TA克隆为模板用对应的引物对NKx6.1的5'端上游启动子序列进行截短,获得2 325 bp、1 887 bp和1 507 bp的片段,经琼脂糖凝胶电泳分析验证(图 2-A),PCR扩增产物与预期片段大小相符。
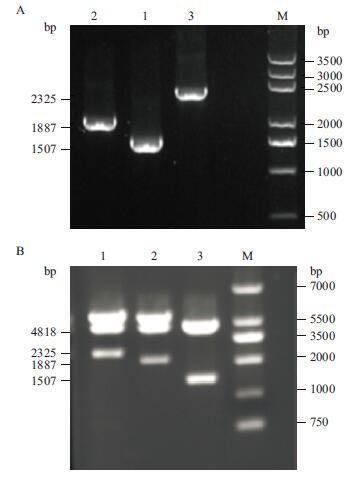
|
| 图 2 NKx6.1 启动子的系列截短片段(A)及相应的荧光素酶报告载体双酶切鉴定(B) |
以限制性核酸内切酶Kpn I和Bgl II对重组质粒酶切可见约4 800 bp的载体片段和2 325 bp、1 887 bp,1 507 bp目的片段,与预期片段大小吻合,表明载体构建正确(图 2-B)。
2.4 报告基因活性和大鼠NKx6.1启动子核心调控区筛选根据生物信息学软件预测得T3R结合位点,以系列截短得方式进行敲除,获得了pGL3-2.3,pGL3-1.8,pGL3-1.5三个报告载体(图 3),与T3R表达载体及其对照共转染大鼠星形胶质细胞,检测报告载体荧光素酶活性,以筛选T3R对NKx6.1启动子的核心调控区。结果发现T3R表达载体的对照pcDNA对荧光报告载体几乎没有激活作用,且pcDNA-T3R对空荧光报告载体pGL3-basic几乎没有激活作用。pcDNA-T3R对pGL3-basic-2.3与pGL3-basic-1.8的激活作用相当,而对pGL3-basic-1.5的激活作用显著下降(P<0.05)(图 3)。提示1.5 kb-1.8 kb可能存在启动子核心调控区。
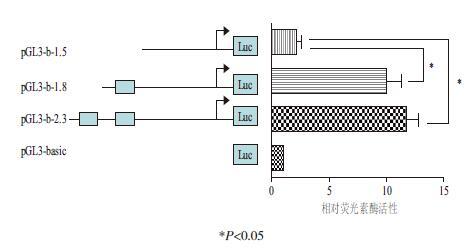
|
| 图 3 大鼠NKx6.1 启动子系列截短片段的双荧光素酶活性检测 |
甲状腺激素(thyroid hormone,TH)是哺乳动物生长发育过程中最重要的激素之一,大鼠妊娠两周,脑组织即在TH的调节下开始快速发育,一直延续到出生后一个月左右[7]。低碘造成的甲状腺激素缺乏会对脑组织的正常发育产生影响[8]。同源盒基因Nkx6.1作为一种反式作用因子与神经系统的分化与发育关系极为密切,对于甲状腺特异基因的表达有重要作用[1]。研究表明低碘膳食会造成特定时期大鼠脑组织中NKx6.1的表达水平下降,并且适时的补充适量的甲状腺激素可以改善甲状腺激素水平低下状态,有利于促进Nkx6.1在基因和蛋白水平接近于正常同期水平[9]。然而,甲状腺激素对NKx6.1的表达调控机制却没有得到进一步揭示。甲状腺激素参与调控基因转录主要是通过与甲状腺激素受体结合形成复合物进而调控下游基因的转录[10],甲状腺激素受体(TRs)是一种 DNA 结合转录因子,属于配体依赖型核激素受体超家族[11-13]。甲状腺激素在体内的活性形式是T3[14],相对应的T3R是一种重要的转录因子,可能在NKx6.1的表达调控中起重要作用。体外研究NKx6.1的表达调控模型,选择大鼠星形胶质细胞(Astrocytes),因其作为中枢神经系统中数量最多的细胞,承担着CNS发育和功能执行等作用[15-19]。Astrocytes能够控制突触的数量,可以直接或者间接的调控突触的活性,而且对突触具有维持作用,此外大量的证据显示阿尔兹海默症与Astrocytes相关[20]。
4 结论构建了大鼠NKx6.1的启动子的报告载体,应用生物信息学预测了NKx6.1启动子上潜在的T3R结合位点。双荧光素酶报告载体实验发现,这些潜在的结合位点在一定程度上能够激活NKx6.1启动子。
| [1] | Brickman YG, Ford MD, et al. Structural modification of fibroblast growth factor-binding heparan sulfate at a determinative stage of neu-ral development. J Biol Chem , 1998, 273 (8) : 4350–4359. DOI:10.1074/jbc.273.8.4350 |
| [2] | Quinn JC, Molinek M, Martynoga BS, et al. Pax6 controls cerebral cortical cell number by regulating exit from the cell cycle and specifiescortical cell identity by a cell autonomous mechanism. Dev Biol , 2007, 302 (1) : 50–65. DOI:10.1016/j.ydbio.2006.08.035 |
| [3] | Pauls S, Zecchin E, Tiso N, et al. Function and regulation of zebrafish nkx2. 2a during development of pancreatic islet and ducts. Dev Biol , 2007, 304 (2) : 875–890. DOI:10.1016/j.ydbio.2007.01.024 |
| [4] | 张瑞, 戈海泽, 赵秀娟, 等. 低碘膳食对大鼠脑组织同源盒基因Nkx-6. 1和Nkx-6. 2 mRNA表达的影响. 中国地方病学杂志 , 2009, 28 (5) : 488–492. |
| [5] | Porterfield SP, Hendrich CE. The role of thyroid hormones in prena-tal and neonatal neurological development current perspectives. Endocr Rev , 1993, 14 (1) : 94–106. |
| [6] | Harvey CB, Williams GR. Mechanism of thyroid hormone action. Thyroid , 2002, 12 (6) : 441–446. DOI:10.1089/105072502760143791 |
| [7] | Kuhn HG, Winkler J, et al. Epidermal growth factor and fibroblast growth factor-2 have different effects on neural progenitors in the adult rat brain. Neuroscience , 1997, 15 (17) : 5820–5829. |
| [8] | Espliguero G, Metsis M, Iglesias T, et al. Transcriptional repression of neurotrophin receptor trkB by thyroid hormone in the developing rat brain. J Biol Chem , 2000, 275 (48) : 37510–37517. DOI:10.1074/jbc.M006440200 |
| [9] | Arnett HA, Fancy SP, Alberta JA, et al. bHLH transcription factor Olig1 is required to repair demyelinated lesions in the CNS. Science , 2004, 306 (5704) : 2111–2115. DOI:10.1126/science.1103709 |
| [10] | Bassett JH, Harvey CB, Wiliams GR. Mechanisms of thyroid hormone receptor specific nuclear and extra nuclear actions. Mol Cell Endocrinol , 2003, 213 (1) : 1–11. DOI:10.1016/j.mce.2003.10.033 |
| [11] | Evans RM. The steroid and thyroid hormone receptor superfamily. Science , 1988, 240 (4854) : 889–895. DOI:10.1126/science.3283939 |
| [12] | Ribeiro RC, Kushner PJ, Baxter JD. The nuclear hormone receptor gene superfamily. Annu Rev Med , 1995, 46 : 443–453. DOI:10.1146/annurev.med.46.1.443 |
| [13] | Harvey CB, Williams GR. Mechanism of thyroid hormone action. THYROID , 2002, 6 (12) : 441–446. |
| [14] | Kuiper GG, Kester MH, et al. Biochemical mechanisms of thyroid hormone deiodination. Thyroid , 2005 (15) : 787–798. |
| [15] | Nedergaard M, Ransom B, Goldman SA. New roles for astrocytes:redefining the functional architecture of the brain. Trends Neurosci , 2003, 26 (10) : 523–530. DOI:10.1016/j.tins.2003.08.008 |
| [16] | Freeman MR. Specification and morphogenesis of astrocytes. Science , 2010, 330 (6005) : 774–778. DOI:10.1126/science.1190928 |
| [17] | Sofroniew MV, Vinters HV. Astrocytes:biology and pathology. Acta Neuropathol , 2010, 119 (1) : 7–35. DOI:10.1007/s00401-009-0619-8 |
| [18] | Hochstim C, Deneen B, et al. Identification of positionally distinct astrocyte subtypes whose identities are specified by a homeodomain code. Cell , 2008, 133 (3) : 510–522. DOI:10.1016/j.cell.2008.02.046 |
| [19] | Zhao XF, Chen YP, Zhu Q, Qiu M. Control of astrocyte progenitor specification, migrationand maturationby Nkx6. 1 homeodomain transcription factor. PLoS One , 2014, 9 (10) : e109171. DOI:10.1371/journal.pone.0109171 |
| [20] | Vincent AJ, Gasperini R, Foa L, et al. Astrocytes in Alzheimer's disease:emerging roles in calcium dysregulation and synaptic plasticity. Alzheimers Dis , 2010, 22 (3) : 699–714. |





