2. 浙江省海洋生物重点实验室,宁波 315211;
3. 温州市海虎海藻养殖有限公司,温州 325400
2. Key Laboratory of Marine Biotechnology of Zhejiang Province,Ningbo 315211;
3. Wenzhou Seatiger Seaweed Cultivation Co.,Ltd.,Wenzhou 325400
裂片石莼(Ulva fasciata Delile)属于绿藻门(Chlorophyta),石莼属(Ulva Linnaeus),为亚热带性海藻,生长在风浪较小的大干潮线附近的岩石或低潮带的石沼中,主要分布于福建、广东、广西、海南等亚热带地区[1]。对浙江藻类的研究中发现有裂片石莼的存在,并且近几年其分布位置出现了很明显的北移现象。2002年调查发现裂片石莼以台州湾为分布北界存在于温州等浙南海域[2],2006年裂片石莼存在于浙南海域的南麓海域[3];2008发现裂片石莼在浙北海域、浙中海域、浙南海域均有分布[4]。其它海藻例如马尾藻属(Sargassum C.Ag)海藻也出现北移的现象,并且这种现象与气候变暖有较大的关系[5]。气候变暖也是绿潮爆发的主要原因[6, 7],藻类的生长和生理代谢的不同是决定绿潮藻类型的关键因素,而石莼属海藻是形成绿潮的主要成分[8],因此研究温度对裂片石莼的生长及生理代谢的影响对于研究藻类分布以及预防绿潮爆发十分必要。
温度对藻类的生长及生理代谢具有重要影响,生长量的不同是藻类对不同温度最直观的反映。通过测定不同温度下长石莼(Ulva linza)、孔石莼(Ulva pertusa Kjellm)生长量的差异研究了绿潮形成机制[8, 9]。通过比较不同温度下巨藻属(Macrocystis Agardh)海藻生长量的变化确定了其在高温下不适宜生存[10],根据不同温度下硬毛藻(Chaetomorpha antennina(Bory)Kützing)的生长速率及生长状态的好坏确定其生存温度范围[11]。温度对植物生长的影响主要是通过调节植物体内生理生化反应来实现的。来自于光系统II的叶绿素荧光对环境压力非常敏感,能够反应光合系统损伤程度,对研究植物生理代谢反应特别是光合作用受环境胁迫具有指示作用[12]。目前研究环境因素对叶绿素荧光的影响主要集中在研究Fv/Fm(最大光化学量子产量)、Fv′/Fm′(有效光化学量子产量)、光能利用效率(α)、qP(光化学淬灭系数)、NPQ(非光化学淬灭系数)、rETR(电子传递速率)等叶绿素荧光参数的变化。根据不同温度下α、rETR叶绿素荧光参数的变化确定了麒麟菜(Eucheuma denticulatum(Burman)Collins et Hervey)的适温范围为23℃-32℃[13],通过研究不同温度下Fv/Fm的变化筛选出了耐高温的海带(Laminaria japonica Aresch)品种[14],造礁石珊瑚(Scleractinian coral)的Fv/Fm随着温度的升高逐渐降低表明其对温度较为敏感[15],杉叶藻(Hippuris vulgaris L.)在高低温胁迫下NPQ会升高,qP、Fv/Fm等则会降低[16]。
本研究通过研究不同温度下裂片石莼的生长及叶绿素荧光参数,确定裂片石莼的生存温度范围及对温度的响应机制,以期为藻类的迁徙消亡及绿潮的爆发提供一定的理论依据。
1 材料与方法 1.1 材料实验藻样于2015年7月采集自温州霞关。用灭菌海水多次冲洗藻体,并用软毛刷轻轻刷洗藻体表面,以去掉藻体表面泥沙及杂藻。将部分健康叶状体培养于光照培养箱中备用,温度为20℃,光强为40 μmol/(m2·s)左右,光暗比为12D∶12L。培养液每2 d更换一次。
1.2 方法 1.2.1 藻体生长及相对生长率的测定从上述预培养的材料中挑选生长状态相似且健康的藻体,称量0.2 g藻体记为M0,培养于含有PES培养液的400 mL海水中(海水∶PES=100∶2),处理温度为5℃、10℃、15℃、20℃、25℃、30℃、33℃、35℃,光照与预培养光照一致,光周期为12D∶12L,每个处理5个平行,周期为7 d,每2 d换一次海水,每2 d称量一次藻体鲜重记为Mt,t为培养的天数。相对生长率的计算[17]:
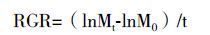
藻体培养同1.2.1,培养7 d后,称取0.1 g鲜重藻体,用95%的乙醇研磨,取上清,再用95%的乙醇定容至25 mL,用721分光光度计测定OD663、OD645。
按Arnon公式计算叶绿素a、叶绿素b及总叶绿素含量。
Ca=12.7OD663-2.69OD645(mg/L)Ma=Ca*25/0.1/1000(mg·g-1)
Cb=22.9OD645-4.68OD663(mg/L)Mb=Cb*25/0.1/1000(mg·g-1)
C=8.02OD665+20.21OD645(mg/L)M=C*25/0.1/1000(mg·g-1)
1.2.3 不同温度下叶绿素荧光测定藻体培养同1.2.1,经过5℃-35℃条件培养7 d后,将藻体组织进行20 min黑暗处理,用便携式调制脉冲荧光仪(WATER-EDF1.5B;WALZ,Gemany)测定叶绿素荧光参数:Fv/Fm(最大光化学量子产量)、Fv′/Fm′(有效光化学量子产量)、qP(光化学淬灭系数)、NPQ(非光化学淬灭系数)、光能利用效率(α),测定后将每个温度条件下培养后的藻体放到25℃条件下再培养,其他条件与之前相同,2 d后再次测Fv/Fm、Fv′/Fm′。
1.2.4 数据统计和分析采用 Origin8软件对数据进行处理和绘图,采用SPSS13.0中的one-way ANOVA对数据进行显著性分析,设显著性水平为P<0.05。
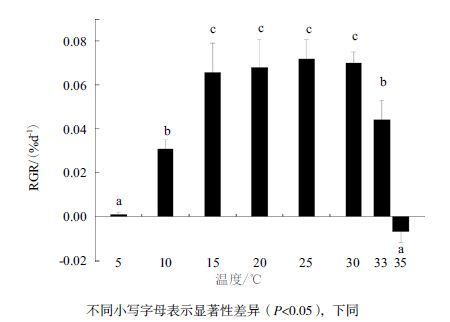
2 结果 2.1 不同温度下裂片石莼生长及相对生长率的变化不同温度培养裂片石莼的鲜重随时间的变化(图 1)显示,10℃-33℃的温度梯度培养下,随着培养天数的增加,裂片石莼的鲜重不断增加,25℃增加最多。5℃、35℃培养的裂片石莼随着培养时间的延长出现了下降趋势。经过7 d不同温度培养后裂片石莼的相对生长率(RGR)变化(图 2)表明,温度低于25℃,随着温度的升高相对生长率逐渐升高,25℃最大;超过25℃时随着温度的升高,5℃、35℃条件培养的相对生长率显著小于其它几组温度条件(P<0.05)。

|
| 图 1 温度对裂片石莼鲜重的影响 |
|
| 图 2 温度对裂片石莼相对日均生长率的影响 |
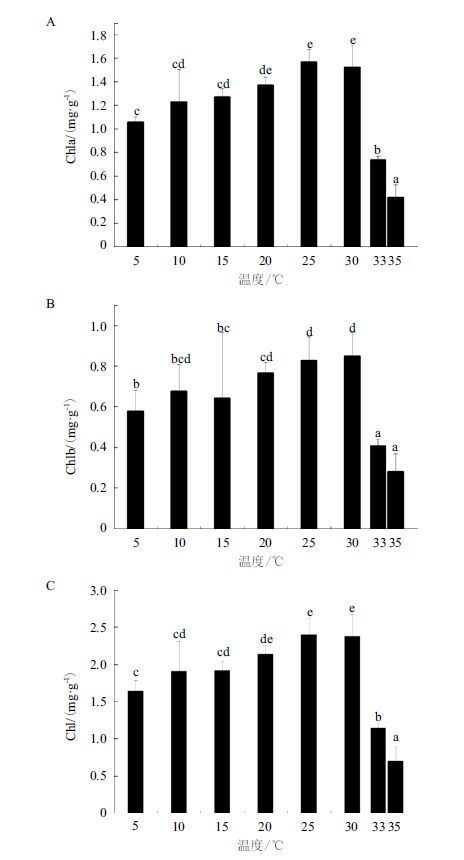
不同温度培养后的裂片石莼叶绿素含量(图 3)显示,25℃叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chl)含量最多,随着温度的升高或者降低,叶绿素含量逐渐减少,这与不同温度下裂片石莼生长情况一致。不同于5℃条件下裂片石莼的生长显著小于15℃、10℃条件下的值,5℃下的Chla、Chlb、Chl含量与15℃、10℃条件下无显著性差异(P>0.05)。 高温33℃、35℃条件下裂片石莼的Chla、Chlb、Chl含量显著下降(P<0.05),33℃下的Chla、Chlb、Chl含量却显著小于10℃、5℃条件下的值(P<0.05),35℃培养的Chla、Chlb、Chl含量显著小于5℃条件的值(P<0.05),这与两种温度下的裂片石莼的生长情况不同。可见裂片石莼对低温的耐受性优于高温。
|
| 图 3 温度对裂片石莼叶绿素a(A)、叶绿素b(B)、总叶 绿素(C)含量的影响 |
不同温度下的Fv/Fm(最大光化学量子产量,图 4-A)表明,25℃最大为(0.791),随着温度的增高或者降低,Fv/Fm 逐渐下降,5℃、10℃、33℃、35℃条件下的Fv/Fm 显著小于25℃的值(P<0.05),分别为25℃的21.2%、70.8%、85.9%和20.4%。而不同温度处理过的裂片石莼经过25℃驯化2 d后测得的Fv/Fm(图 4-B)表明,10℃培养过的裂片石莼再经过25℃培养后Fv/Fm显著性升高到25℃的97.3%(P>0.05),5℃条件下的Fv/Fm升高到25℃的32.3%,33℃、35℃培养的Fv/Fm变化不明显。
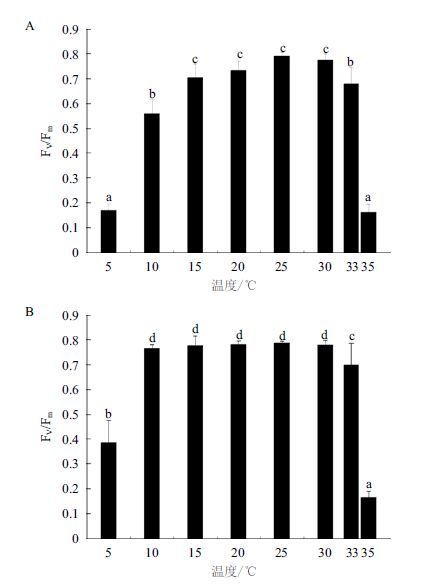
|
| 图 4 温度(A)及25℃处理对不同温度培养下(B)裂片 石莼最大光化学量子产量Fv/Fm 的影响 |
不同温度下的Fv′/Fm′(有效光化学量子产量,图 5-A)表明,趋势同Fv/Fm一样,温度低于25℃时随着温度的升高,Fv′/Fm′逐渐升高,温度高于25℃随着温度的升高逐渐降低,25℃条件下的Fv′/Fm′(0.469)最大;5℃、35℃条件下的Fv′/Fm′显著低于其他温度的值(P<0.05)。经过25℃驯化2 d后测得的Fv′/Fm′(图 5-B)表明,10℃、15℃、20℃、30℃的驯化值与25℃的值无显著性差异(P>0.05)。5℃提高为25℃的56.8%、33℃、35℃条件下的值没有显著性提高,可见裂片石莼对于低温的耐受性显著高于高温。

|
| 图 5 温度(A)及25℃处理对不同温度培养下(B)裂片 石莼有效光化学量子产量Fv′/Fm′ 的影响 |
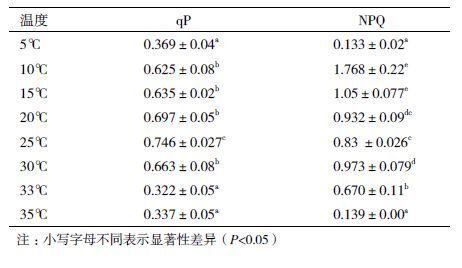
图 6显示,不同温度下的α(光能利用效率),25℃最大,随着温度的升高或者降低α逐渐减小,其变化趋势同不同温度下的Fv/Fm基本一致。不同温度下裂片石莼的光化学淬灭系数qP和非光化学淬灭系数NPQ(表 1)表明,10℃-25℃随着温度的降低qP逐渐下降,NPQ则逐渐升高,25℃-30℃随着温度的升高qP降低,NPQ显著增大,25℃具有最大的qP,10℃具有最大的NPQ,5℃、33℃、35℃的qP、NPQ都显著降低,5℃、35℃最低。从叶绿素荧光参数的变化规律可以看出,25℃时裂片石莼的光合系统最健康,光能利用效率最高,10℃、33℃条件下受到低温和高温的胁迫,并且光合系统对低温的耐受性高于高温。5℃、35℃显著抑制了藻类的光合系统。

|
| 图 6 温度对裂片石莼光能利用效率α 的影响 |
生物对非生物环境都有一个耐受范围,在耐受范围内能够生长,超过耐受范围不生长甚至死亡[19]。 藻体在适宜的温度范围能够快速增长,超过适宜范围藻类生长则会下降[20]。研究表明,裂片石莼在适宜的温度15℃-30℃条件下生长迅速,10℃-15℃及30℃-33℃条件下生长显著下降,5℃、35℃条件下生长明显受抑制。这也解释了裂片石莼一般在夏季温度较高时消失,早秋生长旺盛的季节性规律[21]。有研究表明绿潮藻的生长量在10℃时就可以达到很高的生长速率[7]。绿潮一般在夏季爆发,夏季温度一般在30℃以上,本研究中当温度超过33℃时,裂片石莼的生长便会受到限制,夏季爆发的绿潮藻中裂片石莼成分很少。
3.2 温度对裂片石莼叶绿素荧光特性的影响叶绿素含量影响藻类对光能的吸收和转换,高温和低温胁迫都能降低藻类的叶绿素含量,影响捕获光能并转化成化学能的效率,裂片石莼在高温和低温胁迫下叶绿素含量显著降低,这与相应的温度胁迫下的生长率变化一致[22]。低温胁迫下裂片石莼的叶绿素含量显著高于高温胁迫的含量,这与低温和高温之间的生长量的变化不同,因为低温胁迫对于植物的伤害主要是物理性的冻伤,而高温胁迫破坏了叶绿素结构造成不可逆的伤害。
藻类吸收的光能,一部分用于驱动光合作用,还有一部分以叶绿素荧光的形式在光系统II转动过程中释放,检测叶绿素荧光的变化可以反映PSII系统的光合情况。温度胁迫阻碍光合作用中电子传递,使光合作用器官受氧化的风险增强,这种氧化作用将导致PSII系统的慢性损伤,导致叶绿素荧光参数改变[23]。裂片石莼在低温和高温胁迫下Fv/Fm显著降低,5℃、35℃条件下的Fv/Fm<0.44,说明温度胁迫对PSII系统造成伤害,5℃、35℃使裂片石莼PSII系统完全失活[24]。环境胁迫能够严重影响光合反应效率[25],高温和低温条件下Fv′/Fm′(有效光化学量子产量)、α(光化学利用效率)、qP(光化学淬灭)显著性降低,表明温度胁迫阻碍了光能的传递,造成大量光能的积累,从而损伤了光合系统,降低光能的利用效率。但是低温和高温对植物胁迫机制不同,低温对植物主要造成物理性可逆的冻伤,削弱了光能利用效率,造成光能过剩,产生光抑制,适度的低温胁迫下NPQ增加说明光化学效率降低积累的过量光能通过非光化学过程耗散来保护PSII的结构[22]。高温胁迫直接导致捕光色素复合体的结构发生变化,对光合系统造成化学性不可逆的伤害。10℃条件下的裂片石莼表现出最大NPQ,经过25℃培养2 d后Fv/Fm、Fv′/Fm′显著提升,进一步说明低温胁迫下光抑制现象提高了裂片石莼对低温的耐受性[26]。高温33℃、35℃胁迫下的NPQ显著小于低温,经过25℃培养后Fv/Fm、Fv′/Fm′没有显著提升,说明高温对裂片石莼的光合系统造成了不可逆的伤害。5℃、35℃条件下的qP、NPQ同时急剧下降,说明 5℃、35℃条件严重损害了它的反应中心和天线系统,不能发展有效的NPQ途径进行保护[27],这可能已经达到了裂片石莼的极限低温和高温。本实验仅从裂片石莼的生长和叶绿素荧光特性方面分析了裂片石莼对温度的适应机制,在后续实验中应该进行不同温度下藻类各种生理生化指标的测量,以更深入地了解裂片石莼对温度的响应机制。
4 结论本研究表明,15℃-30℃范围内是裂片石莼的适宜温度范围,5℃-15℃以及30℃-35℃范围内,裂片石莼处于温度的耐受范围,当温度为5℃和35℃时已达到裂片石莼的极限低温和高温。
| [1] | 丁兰平, 黄冰心, 栾日孝. 中国海洋绿藻门新分类系统[J]. 广西科学, 2015(2) : 201–210. |
| [2] | 项斯端, 阮积惠. 浙江底栖海藻及其区系分析[J]. 浙江大学学报:理学版, 2002, 29(5) : 548–557. |
| [3] | 孙建璋, 余海, 陈万东, 等. 浙江底栖海藻记录[J]. 浙江海洋学院学报:自然科学版, 2006, 25(3) : 312–321. |
| [4] | 张义浩, 李文顺. 浙江沿海大型底栖海藻分布区域与资源特征研究[J]. 渔业经济研究, 2008(2) : 8–14. |
| [5] | Komatsu T, Fukuda M, Mikami A, et al. Possible change in distribution of seaweed,Sargassum horneri,in northeast Asia under A2 scenario of global warming and consequent effect on some fish[J]. Marine Pollution Bulletin, 2014, 85(2) : 317–324. |
| [6] | Yabe T, Ishii Y, Amano Y, et al. Green tide formed by free-floating Ulva spp. at Yatsu tidal flat,Japan[J]. Limnology, 2009, 10(3) : 239–245. |
| [7] | Taylor R, Fletcher RL, Raven JA. Preliminary studies on the growth of selected ‘Green Tide’ Algae in laboratory culture:effects of irradiance,temperature,salinity and nutrients on growth rate[J]. Botanica Marina, 2001, 44(4) : 327–336. |
| [8] | Luo MB, Liu F, Xu ZL. Growth and nutrient uptake capacity of two co-occurring species,Ulva prolifera and Ulva linza[J]. Aquatic Botany, 2012, 100(7) : 18–24. |
| [9] | Kim JH, Kang EJ, Park MG, et al. Effects of temperature and irradiance on photosynthesis and growth of a green-tide-forming species(Ulva linza)in the Yellow Sea[J]. Journal of Applied Phycology, 2011, 23(3) : 421–432. |
| [10] | Roth?usler E, Gómez I, Hinojosa IA, et al. Effect of tmperature and grazing on growth and reproduction of floating macrocystis spss. (phaeophyceae)along alatitudinal gradient[J]. Journal of Phycology, 2009, 45(3) : 547–559. |
| [11] | Tsutsui I, Miyoshi T, Aue-umneoy D, et al. High tolerance of Chaetomorpha sp. to salinity and water temperature enables survival and growth in stagnant waters of central Thailand[J]. International Aquatic Research, 2015, 7(1) : 47–62. |
| [12] | Frankart C, Eullaffroy P, Vernet G. Comparative effects of four herbicides on non-photochemical fluorescence quenching in Lemna minor[J]. Environmental and Experimental Botany, 2003, 49(2) : 159–168. |
| [13] | Nishihara GN, Noro T, Terada R. Effect of temperature and light on the photosynthesis as measured by chlorophyll fluorescence of cultured Eucheuma denticulatum and Kappaphycus sp. (Sumba strain)from Indonesia[J]. Journal of Applied Phycology, 2013, 25(2) : 399–406. |
| [14] | Pang SJ, Jin ZH, Sun JZ, et al. Temperature tolerance of young sporophytes from two populations of Laminaria japonica revealed by chlorophyll fluorescence measurements and short-term growth and survival performances in tank culture[J]. Aquaculture, 2007, 262(2) : 493–503. |
| [15] | Ferrier-Pagès C, Richard C, Forcioli D, et al. Effects of temperature and UV radiation increases on the photosynthetic efficiency in four scleractinian coral species[J]. The Biological Bulletin, 2007, 213(1) : 76–87. |
| [16] | Gao L, Tang Y, Bossard C, et al. Diurnal variation in relative photosynthetic performance of marestail(Hippuris vulgaris Linn.)Across a water temperature gradient using PAM fluorometry in Jiuzhaigou National Nature Reserve,Sichuan Province,China[J]. Journal of Mountain Science, 2011, 8(6) : 794–807. |
| [17] | Luo MB, Liu F. Salinity-induced oxidative stress and regulation of antioxidant defense system in the marine macroalga Ulva prolifera[J]. Journal of Experimental Marine Biology & Ecology, 2011, 409(40910) : 223–228. |
| [18] | 冯瑞云. 叶绿素的热醇快速提取法[J]. 江苏农学院学报, 1985, 6(3) : 53–54. |
| [19] | Kim JK, Kraemer GP, Neefus CD, et al. Effects of temperature and ammonium on growth,pigment production and nitrogen uptake by four species of Porphyra(Bangiales,Rhodophyta)native to the New England coast[J]. Journal of Applied Phycology, 2007, 19(5) : 431–440. |
| [20] | Fortes MD, Lüning K. Growth rates of North Sea macroalgae in relation to temperature,irradiance and photoperiod[J]. Helgol?nder Meeresuntersuchungen, 1980, 34(1) : 15–29. |
| [21] | Aguilar-Rosas R, Pedroche FF, Aguilar-Rosas R. Ulva fasciataDelile(Ulvaceae,Chlorophycota):a species newly introduced into Pacific Mexico[J]. Botanica Marina, 2005, 48(48) : 46–51. |
| [22] | Zhang T, Shen Z, Xu P, et al. Analysis of photosynthetic pigments and chlorophyll fluorescence characteristics of different strains of Porphyra yezoensis[J]. Journal of Applied Phycology, 2012, 24(4) : 881–886. |
| [23] | 丁柳丽, 邓亚运, 邹定辉. 大气CO2浓度和温度变化对石莼生长及其叶绿素荧光特性的影响[J]. 广西科学, 2014, 6(5) : 587–595. |
| [24] | Schansker G, Rensen JJSV. Performance of active Photosystem Ⅱ centers in photoinhibited pea leaves[J]. Photosynthesis Research, 1999, 62(2) : 175–184. |
| [25] | Demmig-Adams B, Adams Ⅲ WW. Photoprotection and other responses of plants to high light stress[J]. Annual Review of Plant Biology, 2003, 43(4) : 599–626. |
| [26] | Wilson KE, Marianna K, Huner NPA. Temperature-induced greening of Chlorella vulgaris. the role of the cellular energy balan-ce and zeaxanthin-dependent nonphotochemical quenching[J]. Planta, 2003, 217(4) : 616–627. |
| [27] | 张顺堂, 张桂莲, 陈立云, 等. 高温胁迫对水稻剑叶净光合速率和叶绿素荧光参数的影响[J]. 中国水稻科学, 2011, 25(3) : 335–338. |