2. 济南市食品药品检验检测中心,济南 250001;
3. 山东亚特生态技术有限公司,临沂 266071
2. Jinan Food and Drug Control/Testing Center,Ji’nan 250001;
3. Shandong Yate Eco-tech Co.,Ltd.,Linyi 266071
EST-SSR又称表达序列标签微卫星(EST-based microsatellite),是在SSR标记基础上发展出来的一种新的标记方法。EST-SSR标记是指在已知的EST序列中,筛选出含有SSR的序列,根据简单重复序列两端的保守序列设计引物进行PCR扩增,由于植物上不同物种间微卫星重复单元的碱基组成和拷贝数不同而显现出多态性[1]。由于EST-SSR侧翼序列在物种之间高度保守,EST-SSR标记可在不同物种之间通用[2]。EST-SSR 具有开发过程简单、成本低、能够反映出转录区的差异等优点,所以成为微卫星标记的引物重要的来源。因此,EST-SSR分子标记的方法可以作为一种既简便又高效的进行木瓜属植物亲缘关系远近的判断和进行品种鉴定的工具。木瓜属(Chaenomeles)为蔷薇科(Rosaceae)苹果亚科(Maloideae)植物,本属全世界有5个种,分别为木瓜(C. sinensis)、皱皮木瓜(C. speciosa)、毛叶木瓜(C. cathayensis)、西藏木瓜(C. thibetica)及日本木瓜(C. japonica)。木瓜是一种名贵的药食两用药材,具有舒筋活络和胃化湿之功效[3]。木瓜属植物亲缘关系复杂,同物异名和同名异物现象十分普遍。因此,开发出一种快速有效的方法对木瓜品种进行鉴定分类十分必要。
《中国药典》2010年版规定药用木瓜为蔷薇科植物贴梗海棠Chaenomeles speciosa(Sweet)Nakai的干燥近成熟果实,味酸、性温,归肝、脾经,具舒筋活络和胃化湿等功效。木瓜在部分省区以光皮木瓜或榠楂入药;毛叶木瓜分布较广,产量高,据报道为市场皱皮木瓜的主要来源;西藏木瓜多野生,仅在西藏、云南等部分地区有分布和使用;而日本木瓜曾在部分地区当作木瓜,现未见继续使用。木瓜种质变异与分化严重,形成了很多的农家品种,随之药材的产量和质量也发生明显的差异。目前需要对种质样品间的遗传多样性进行分析,探索木瓜不同种质样品间遗传多样性与形态学特征之间的对应关系。由于目前木瓜属基因水平研究还处于起步阶段,木瓜属的EST库尚未建立,从其近缘植物开发引物是进行研究的有效途径。本研究从苹果属中筛选出适合木瓜属遗传分析的ESR-SSR引物,进行基因组DNA扩增,从分子水平上分析其遗传关系,旨在探讨苹果属ESR-SSR引物用于木瓜属的可行性,以期简便高效的对木瓜属植物进行品种鉴定,判断亲缘关系远近。
1 材料与方法 1.1 材料2014年4月在山东亚特生物有限公司木瓜种植基地采集33份木瓜属种质资源,其中西藏木瓜样品编号XZ01-05、毛叶木瓜MY01-03、皱皮木瓜ZP01-19、日本木瓜RB01-03、光皮GP01-03,采摘各植株的幼嫩叶片,硅胶干燥保存。
1.2 方法 1.2.1 EST-SSR 引物查找苹果属EST序列来源于PlantGDB(http://www.plantgdb.org/)(http://www.plantgdb.org/)和NCBI(http://www.ncbi.nlm.nih.gov/dbEST)(http://www.ncbi.nlm.nih.gov/dbEST),检索到并且下载了339 058条,查询截止时间为 2014年11月2日。
采用EST-trimmer(http://pgrc.ipk-gatersleben.de/misa/download/est_trimmer.pl)(http://pgrc.ipk-gatersleben.de/misa/download/est_trimmer.pl)软件去除5′端或 3′端带有 polyA 或 polyT尾巴的序列,并截去过短的低质量序列片段。采用CAP3软件对 EST 序列进行聚类和拼接处理,以获得无冗余和尽可能长的重叠序列(contig)。通过Perl语言的 MISA程序筛选SSR位点,筛选标准[4]为:序列长度不小于 100 bp且不大于 700 bp,单核苷酸重复的次数≥10次,二核苷酸重复的次数≥6次,三到六核苷酸重复的次数≥5次。
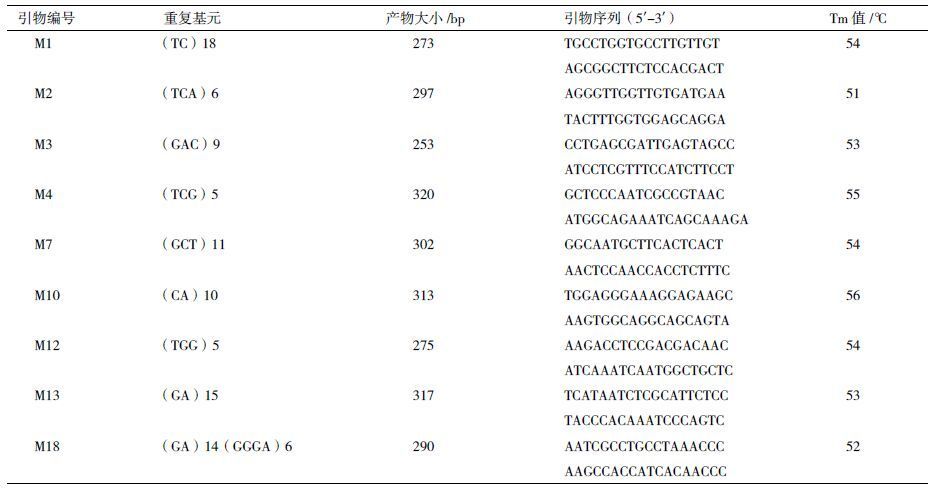
1.2.2 EST-SSR引物设计利用Primer 5.0 软件对符合条件的EST-SSR序列进行引物设计。参数设置为:产物长度设为 100-350 bp,引物长度为18-22 bp,最佳为20 bp,GC含量40%-60%,引物退火温度为50-60℃;尽量避免 Dimer 和二聚体出现,从软件给出96分以上的引物中选取25对合成引物,引物由上海生工合成。
1.2.3 DNA的提取和PCR扩增实验材料均为硅胶干燥叶片,取样约20 mg,液氮充分研磨,利用DNA 提取试剂盒提取DNA。PCR反应体积为 20 μL,体系内含:2×Taq master mix 12.5 μL、ddH2O 9.5 μL、引物各1 μL(2.5 μmol/L)、DNA 模板1 μL(约30 ng)。PCR扩增程序为 :94℃预变性5 min;94℃变性45 s,适宜退火温度45 s,72℃延伸1 min,35 次循环;72℃延伸 7 min,4℃保存。
PCR产物的检测 扩增产物在1% 琼脂糖凝胶电泳上检测,条带清晰并与预期片段大小相近的SSR产物表明扩增成功。具有清晰条带的扩增产物通过6%聚丙烯酰胺凝胶分离,在120 V恒压下电泳,电泳时间为 2 h,银染后观察并照相。
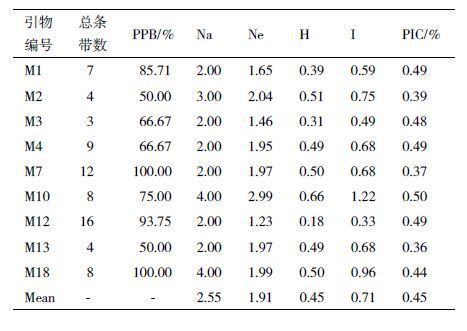
1.2.5 数据分析用数字1和0分别表示电泳条带的有或无,在 Excel 中建立1和0矩阵。利用 NTSYS-pcversion2.11软件进行数据处理,品种间的相似系数按 Jaccard 公式计算,以非加权类平均法(unweighted pair-group method with arithmetic averages,UPGMA)进行聚类分析和构建系统树。利用Popgene32软件进行数据分析,计算多态性条带所占的比率(PPB%),观测等位基因数(Number of putative alleles,na)、有效等位基因数(Number of effectivealleles,ne)、Nei’s遗传多样性指数(H)和Shannon.s指数(I),SSR 位点的多态性信息量(PIC)按Smith等[5]的公式计算,即PIC=1-∑fi2,其中 fi 为 i 位点的基因频率。以评价苹果属植物 EST-SSR引物在木瓜属 SSR标记的可行性。
2 结果 2.1 EST-SSR引物的信息分析对来自苹果属EST库的339 058条单一基因序列经拼接后,得到无冗余contigs 25 727条,采用 MISA 脚本共搜索到含SSR 位点的EST序列3 228条,共搜索到SSR位点3 885个。在所有可用的 EST-SSR 序列中,以二核苷酸为重复单元的序列最多,为2 534条,占 65.23%,二核苷酸重复类型中以AG/CT最为丰富,其次为AT/AT。
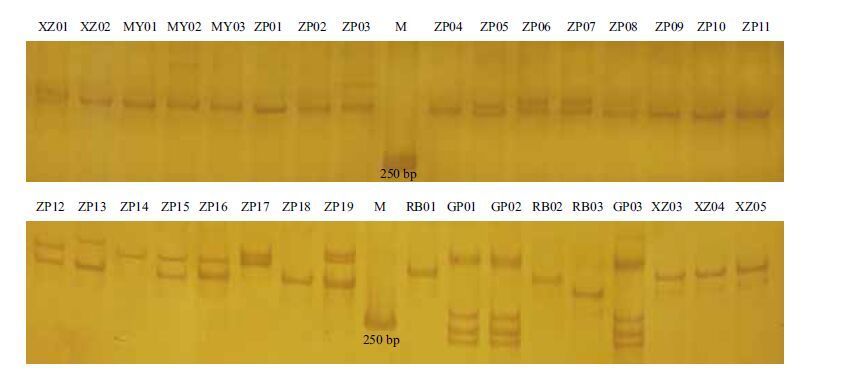
2.2 EST-SSR引物筛选结果利用Primer 5.0 软件设计EST-SSR引物,结合自动与人工筛选,共得到25对备选引物。利用不同引物对随机选取的部分品种基因组DNA 样品初步扩增筛选,筛选出条带清晰的9对引物(表 1),有效扩增率为30%。利用引物M7对不同品种扩增,结果(图 1)表明利用苹果属EST序列应用于木瓜属SSR标记是可行的,并能有效用于木瓜种质鉴定。
|
| 图 1 引物M7 在33 份样品中的扩增结果 |
用筛选的 9 对引物对33种木瓜属植物进行多态性分析,共得到71 条清晰可辨的条带,其中多态性条带59条,多态性条带比率83.10%(表 2)。观测平均等位基因数为2.55,有效等位基因数为1.91,Nei’s遗传多样性为0.45,Shannon信息指数为0.71。PIC值是衡量等位信息含量的理想指标,9对引物扩增后计算结果0.25<PIC<0.5,说明SSR位点均为中度多态性位点。
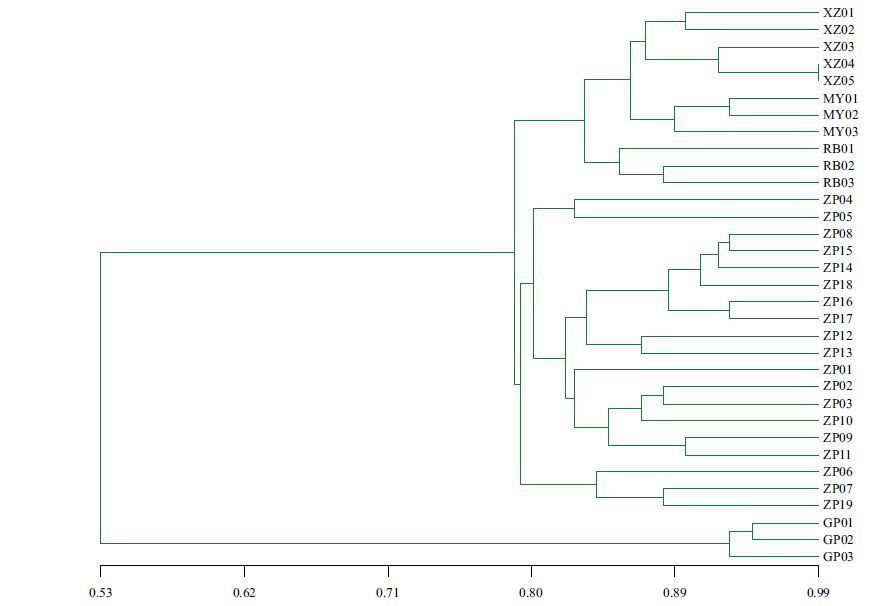
UPGMA聚类树状图(图 2)显示,SSR标记能将33份木瓜属不同种质完全区分开,其相似性系数的变化在0.53-0.99之间,种质间的遗传差异性较大。以0.795相似系数为阈值,能将33份种质资源聚为三大类,第一类包括光皮木瓜,第二类包括全部19份皱皮木瓜种质,第三类又分为3个亚类:第一亚类包括5份西藏木瓜种质,第二亚类包括3份毛叶木瓜,第三亚类包括3份日本木瓜。该聚类结果与传统形态分类学结果大致相同,说明分子标记的多态性与形态表现的多样性基本一致,而分子标记能反映遗传上的差异,对物种鉴定的准确度更高。
|
| 图 2 基于 EST-SSR 分析33 个种质的遗传相似性聚类图 |
由于EST-SSR多态位点多,信息含量高,可反映丰富的遗传变异信息,常被用于药材及品种的鉴定。大量研究表明,EST-SSR引物的跨种扩增可应用于多种植物的遗传多样性研究。杨维泽等[6]利用百合等3种植物的EST-SSR标记对云南重楼(多叶重楼的变种)进行扩增,成功扩增出预期条带,结果表明在滇重楼中具有较高的通用性。陈永霞等[7]选取小麦、玉米等禾谷作物的EST-SSR引物研究扁穗牛鞭草的遗传变异和亲缘关系,结果表现出丰富的遗传多样性。目前,在蔷薇科的属种间证实了ESR-SSR引物的通用性。例如,秦玥等[8]从蔷薇科EST库中开发了10对华仁杏SSR引物,为华仁杏资源的品种鉴定及分子标记辅助育种研究奠定基础。Vendramin等[9]从桃EST库中设计合成了21对EST-SSR引物,在李属的6个种植物中扩增,扩增成功率高达78.1%。而通过苹果属SSR引物探究EST-SSR标记在其他属种间的通用性研究更为广泛,主要用于山楂[10]、梨[11]等,已有14个SSR引物被定位到了梨的公共图谱[1]。
由于目前木瓜属基因组研究工作落后,难以在较短的时间开发大量的EST-SSR标记,而木瓜和苹果同属于蔷薇科苹果亚科,具有较高的同源性。本研究采用苹果属植物上开发的EST-SSR标记,在木瓜属植物上获得较高的可转移性,说明这些从苹果基因组开发的EST-SSR的序列在木瓜属上保守性较高,并且可以揭示一定的多态性水平。
由EST-SSR标记的引物筛选结果可以看出,25对EST-SSR备选引物中,9对扩增出清晰条带,有效扩增率为36.00%。33份木瓜的相似系数在0.53-0.99之间,种质资源间有较大的遗传变异,遗传多样性较高。由聚类结果可知,木瓜属亲缘关系较近的种聚在一起,其4个种的亲缘关系较近,仅有光皮木瓜表现出显著的单系性,并未与其余4种聚为一支,说明亲缘关系较远。这与其他分子标记,如AFLP标记[12]、SRAP标记[13]、RAPD标记[14]和ISSR标记[15],对木瓜属遗传亲缘关系的研究结果一致。聚类图(图 2)显示西藏木瓜与毛叶木瓜聚为一支,亲缘关系密切,本研究支持王明明等[15]对木瓜属品种亲缘关系的SRAP分析的研究结果。俞德俊等[16]也认为西藏木瓜与毛叶木瓜亲缘关系十分紧密。
结合形态学特征分析皱皮木瓜19个样品的聚类结果,发现单独聚为一类都具有比较典型的区别于其他单株的形态学特征,尤其是花色、花型。其中单独分支的ZP06、ZP07、ZP19在形态学特征也与其他差异明显,表现为叶长圆状披针形,下表面有褐柔毛,大果型,种子呈扁三角形。其他多为中小果型,种子多呈长三角形,聚类结果与形态方面也有对应一致的差异结果,如ZP04、ZP05花大红色,ZP09、ZP11花色为浅粉色,ZP12、ZP13为粉白色,ZP08、ZP14、ZP15、ZP16的气香浓郁。张亚利[17]的研究也证实分子标记聚类结果和形态学聚类结果有一定的一致性。
基于EST数据库开发的苹果EST-SSR引物是可行的,并能用于木瓜属种质的鉴定,同时在指纹图谱构建、种质资源分析、遗传作图等研究方面有广阔的应用前景。因此,从近缘物种 EST-SSR 上开发更多的木瓜属SSR引物是有效途径。
4 结论利用苹果 EST 数据库开发了 9对多态性丰富的 EST-SSR 引物,并用其对 33份木瓜属品种资源的亲缘关系进行研究,共扩增出结合位点 71个,总的多态性比率为 83.10%,供试材料相似系数的变化在0.53-0.99,在相似性系数 0.795 处可将33份材料分为 3 组。本研究结果表明筛选的9对苹果属EST-SSR可用于木瓜属种质的鉴定。
| [1] | Bouek A, Vision TJ. The molecular ecologist′s guide to expressed sequence tags[J]. Molecular Ecology, 2007(16) : 907–924. |
| [2] | 李明芳, 郑学勤. 开发 SSR 引物方法之研究动态[J]. 遗传, 2004, 26(5) : 769–776. |
| [3] | 国家药典委员会. 中华人民共和国药典(2010版)[S]. 北京:化学工业出版社,2010++2. |
| [4] | Scott KD, Eggler P, Seaton G, et al. Analysis of SSR derived from grape EST[J]. Theoretical and Applied Genetics, 2000(100) : 723–726. |
| [5] | 肖木辑, 李明顺, 李新海, 等. 东北地区主要玉米自交系的 SSR 遗传多样性分析[J]. 华北农学报, 2006, 21(增刊) : 23–27. |
| [6] | 杨维泽, 许宗亮, 杨绍兵, 等. 三种植物EST-SSR引物在滇重楼上的通用性分析[J]. 西南农业学报, 2014(4) : 1686–1690. |
| [7] | 陈永霞, 张新全, 谢文刚, 等. 利用EST-SSR标记分析西南扁穗牛鞭草种质的遗传多样性[J]. 草业学报, 2011(6) : 245–253. |
| [8] | 秦玥. 华仁杏品种资源SSR指纹图谱构建研究[D]. 北京:中国林业科学研究院,2013. |
| [9] | Vendramin E, Derrori MT, Giovinazzi J, et al. A set of EST-SSRs isolated from peach fruit transcriptome and their transportability across Prunus species[J]. Mol Eco Not, 2007(7) : 307–310. |
| [10] | 张叶, 代红艳, 张琪静, 等. 利用苹果SSR引物分析山楂属植物遗传关系[J]. 果树学报, 2008(4) : 521–525. |
| [11] | 路娟, 吴俊, 张绍铃, 等. 基于苹果EST-SSR的梨种质资源遗传多样性分析[J]. 西北植物学报, 2010(4) : 690–696. |
| [12] | 臧德奎, 陈红, 郑林, 等. 木瓜属优良品种亲缘关系的AFLP分析[J]. 林业科学, 2009(8) : 39–43. |
| [13] | 王明明, 陈化榜, 王建华, 等. 木瓜属品种亲缘关系的SRAP分析[J]. 中国农业科学, 2010(3) : 542–551. |
| [14] | 陈红. 木瓜属种质资源的RAPD、AFLP亲缘关系鉴定及遗传多样性分析[D]. 泰安:山东农业大学,2008. |
| [15] | 聂金娥. ISSR和SRAP对木瓜种质遗传多样性研究[D]. 济南:山东中医药大学,2013. |
| [16] | 俞德俊, 关克俭, 陆玲娣, 等. 中国植物志[M]. 北京: 科学出版社, 1974 : 348-354. |
| [17] | 张亚利. 形态学性状及AFLP标记在木瓜海棠新种质鉴别和分类中的应用[J]. 江苏农科学, 2010(4) : 145–147. |