2. 辽宁省农业科学院微生物工程中心,沈阳 110161
2. Center of Microbial Engineering,Liaoning Academy of Agricultural Sciences,Shenyang 110161
我国玉米约2/3是旱作种植,从播种到收获整个生育期都可遭遇干旱[1]。干旱使玉米减产25%-30%,甚至绝收,成为影响我国玉米产量的第一限制因素[2, 3]。近几年,植物内生菌次生代谢产物因具有促进作物生长、增强抗逆性、抗病虫害及对环境友好等优点,引起广泛重视,已成为国内外研究的热点。因此应用植物内生菌次生代谢产物提高玉米渗透胁迫抗性,将是改善以干旱为主的非生物胁迫的重要手段,同时阐明次生代谢产物提高玉米渗透胁迫抗性的机制是抗旱育种和栽培技术改良的理论基础。基因芯片是一种检测基因差异表达的高通量技术[4]。目前,此技术已成功应用于非生物胁迫下拟南芥、玉米、水稻的功能基因组研究[5]。本研究采用基因芯片技术研究渗透胁迫下植物内生菌次生代谢产物对玉米基因表达的影响。
1 材料与方法 1.1 材料植物内生菌次生代谢产物由本实验室提供;供试玉米杂交种为新奇518。
采用水培实验,将次生代谢产物包衣的种子置于10% PEG-6000 溶液中培养,昼夜温度控制在26/18℃,3次重复。2叶期时取玉米根系0.5 g,液氮中保存,用于提取总RNA。
1.2 方法 1.2.1 总RNA的提取取100 mg根系于液氮中迅速研磨,至预冷离心管中,加1 mL Trizol 试剂,振荡30 s,室温放置5 min,加200 µL 三氯甲烷,振荡15 s,室温放置3 min。4℃(下同),12 000 r/min离心10 min,取上清液加等体积异丙醇混匀,室温放置 10 min,12 000 r/min离心10 min,弃上清液。沉淀用1 mL 75%乙醇清洗,12 000 r/min离心5 min。弃上清,室温放置5 min。沉淀溶于 30 µL RNase-free 的水中,-80℃保存备用。用紫外分光光度计和甲醛变性凝胶电泳检测RNA 样品的质量。
1.2.2 探针的制备采用RNeasyMinElute Cleanup Kit纯化总RNA,采用One-cycle cDNA Synthesis Kit将RNA反转录为dscDNA,该cDNA纯化由GeneChip Sample Cleanup Module来完成。根据GeneChip IVTLabeling Kit将纯化的cDNA制备为生物素标记的cRNA。生物素标记的cRNA于94℃保温,35 min进行片段化处理,片段化的cRNA即为杂交探针备用。
1.2.3 杂交及洗涤取适量片段化的cRNA 与试验芯片(experi-mentalchip)进行杂交,16 h,60 r/min 旋转。洗脱和染色于Affymetrix公司的Genechipfluidics station 洗涤工作站中进行。
1.2.4 数据检测采用GeneChip Scanner3000高分辨率扫描仪扫描染色后的芯片,扫描所得数据利用 Affymetrix Gene Chip Operating Software Version1.4 软件进行处理。然后对芯片上的数据用 Robust Multichip Analysis(RMA)方法进行归一化,最后筛选出 Ratio≥2 或≤0.5 的基因作为差异表达基因。
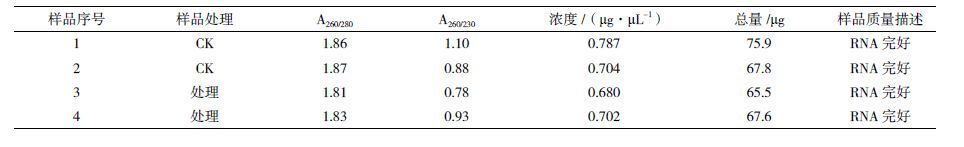
1.2.5 数据分析 2 结果 2.1 总RNA质量检测用Trizol 法提取玉米根尖总RNA。甲醛变性凝胶电泳检测,结果(图 1)显示,RNA条带清晰,完整性较好,28S∶18S rRNA条带亮度大于或接近2∶1,总量≥8 µg,A260/A280≥1.80(表 1),样品纯度、总量及完整性均符合表达谱芯片实验要求。

|
| 图 1 总RNA 电泳图 |
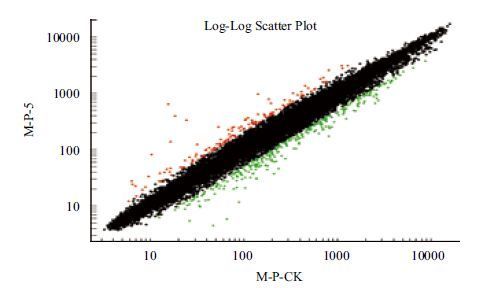
采用Affymetrix Gene Chip Operating Software Version1.4软件统计芯片杂交数据,通过分析Cy3、Cy5两种荧光信号强度,可获得杂交信号强度的散点图。芯片上每一个基因点的杂交信号就会通过一个数据点显示(图 2)。Ratio值为各点(Cy5,Cy3)的坐标比值。一般设定 Cy5/Cy3的正常比值(Ratio)在 0.5-2.0 之间,即图中黑点。Ratio≥2.0 为上调基因,图中红点;Ratio≤0.5 为下调基因,图中绿点。采用RMA归一化方法筛选差异表达基因,结果显示Ratio≥2和<0.5的差异基因共441个,其中上调147个,下调294个(图 2)。在上调基因中Ratio>3.0的22个,Ratio>4.0的6个,下调基因中Ratio < 0.4的基因104个,Ratio < 0.3的基因29个。表 2中列举了部分表达量变化较大的重要基因及其功能描述。
|
| 图 2 杂交信号散点图 |
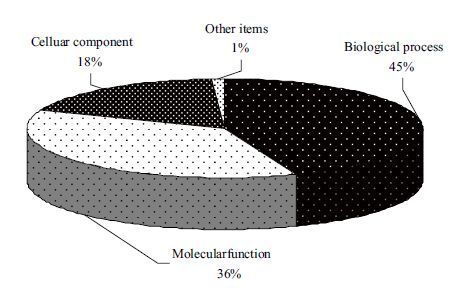
通过Gene Ontology(简称GO)体系对处理与对照间差异表达的441个基因进行功能分类与注释。如图 3所示,其中参与各种生物学过程(biological process)的基因占45%;与生成各种细胞组分(celluar component)有关的基因占18%;编码产物则与执行各种分子功能(molecularfunction)有关的基因占36%;与 GenBank中功能未知序列(other items)相对应的基因占1%,这些基因所起的作用还需进一步研究。按其生物学功能可分为21类(图 4),其中与分子功能相关基因包括转运体活性(占2.27%)、结合反应(占9.98%)、催化反应(占21.09%)等共3个类别;细胞组分主要表现为膜关闭内腔(占0.23%)、细胞器部分(占10.88%)、细胞器(占10.88%)、细胞组分(占16.10%)、细胞(占16.33%)、复杂大分子(占6.35%)等共6个类别;生物学过程主要表现在定位的建立(占5.22%)、发育过程(占3.85%)、定位(占5.44%)、多细胞的生物过程(占3.63%)、生殖过程(占0.45%)、繁殖(占0.68%)、应激反应(占3.63%)、生物过程调节(占4.99%)、生物调节(占5.22%)、新陈代谢(占21.77%)、生理过程(占34.47%)、细胞过程(占33.33%)等共12个类别,这说明渗透胁迫下植物内生菌次生代谢产物处理玉米后引起许多生理生化过程的变化。比较各功能类型中基因的数量发现,与催化反应、新陈代谢、生理过程、细胞过程相关基因占绝大多数。从表达基因的数量来看,与膜关闭内腔、生殖过程、繁殖相关的3类基因仅表现为上调表达,而与复杂大分子相关的基因仅表现为下调表达;而其余各功能类型基因,均为下调表达基因的数量多于上调。说明渗透胁迫下植物内生菌次生代谢产物处理玉米后,引起根系中基因表达量下调较多。
|
| 图 3 差异表达基因功能分类 |

|
| 图 4 上、下调差异表达基因的功能分类 |
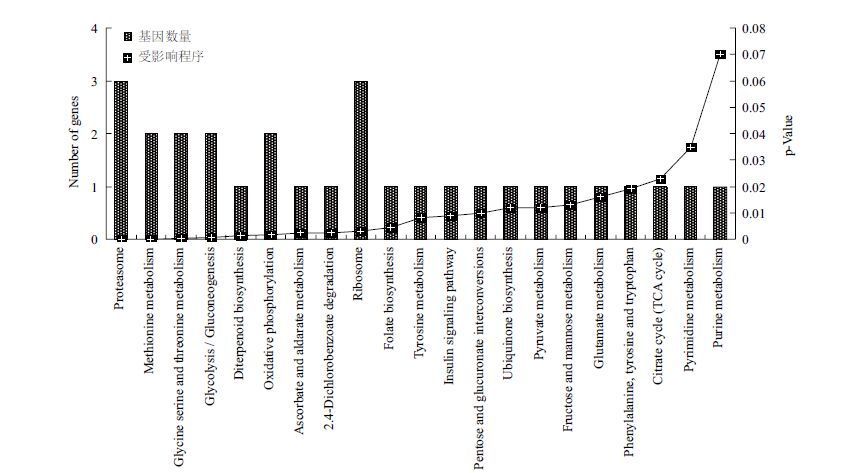
利用KEGG 数据库对筛选出的441个差异表达基因进行功能注释和分类,确定其参与的主要代谢途径(pathway)。结果(图 5)显示,差异表达基因分布在21个代谢途径中,全部为下调代谢途径。这些差异表达基因广泛涉及能量代谢、次生代谢及基础物质代谢等。与蛋白、糖类和核酸等3类生物大分子代谢相关的途径共占总量的66.7%,辅酶代谢相关的途径占14.3%,氧化磷酸化、次生代谢和信号转导相关途径所占比例相对较低。如图 5所示,渗透胁迫下植物内生菌次生代谢产物引起玉米根系各个代谢途径中基因数量变化较小而p-Value值差异非常显著。p-Value值越小说明这条代谢途径受影响越显著。其中蛋白酶体、蛋氨酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、糖酵解和糖异生受影响最为显著,柠檬酸循环(TCA循环)、嘧啶代谢、嘌呤代谢受影响最不显著。
|
| 图 5 下调代谢途径 |
在干旱、盐碱等渗透胁迫条件下,植物通过改变基因表达,调控代谢途径等作出响应。本研究通过对差异表达基因的分析,表明在渗透胁迫下次生代谢产物对玉米的影响是一个多基因参与、多个生物过程协同调控的过程,基因表达量的变化可能是调控的主要方式,同时基因表达量差异较大的基因也不能忽略。本研究采用基因芯片技术,在玉米根系中共检测到17 556个基因,其中差异表达的基因441个,包括147个上调基因,294个下调基因,说明渗透胁迫下次生代谢产物引起玉米根系基因的表达发生了变化。利用KEGG数据库进行查询,结果表明这些基因参与了21条生物学代谢通路,说明次生代谢产物通过多个生物过程协同作用来调控玉米适应渗透胁迫。
在渗透胁迫下,植物为了能继续生存,从3个层次上做出相应调整,最终适应环境:调控正常生长发育;控制造成的伤害和修复;重新均衡体内状况[6]。由于胁迫所产生的活性氧,它们损伤植物的蛋白质、膜脂及细胞组分等,是导致植物损伤的一个重要原因。参与抗氧化保护反应的酶类主要有谷胱甘肽转移酶(GST),谷胱甘肽氧化酶(GPOX),过氧化物酶(POD),超氧化物歧化酶(SOD),过氧化氢酶(CAT)等。其中GST是主要成员,可与内源或外源有害物质结合,使其分解,或形成易溶于水的物质,排出体外,从而达到解毒的目的[7, 8]。Shimabukuro等[9]于1970年最先报道因除草剂形成的氧胁迫能诱导玉米中GST大量表达,使除草剂阿特津脱毒,激发植物的防御反应。Gallé等[10]用PEG处理小麦,耐旱小麦中GST的活性高于不耐旱小麦,不同品种小麦GST基因均呈上调表达。戚元成等[11]报道,过量表达谷胱甘肽转移酶基因可提高转基因拟南芥抗旱能力。本研究处理组谷胱甘肽转移酶13 Glutathione transferase13(GST),上调表达且表达量是对照的7.926 2倍,表明渗透胁迫下次生代谢产物影响了玉米体内GST的表达。锌依赖水解酶类(Zn-dependent hydrolases,including glyoxylases)广泛存在于高等植物,参与植物发育调控、免疫应答及非生物逆境胁迫响应等多个方面[12]。本研究处理组锌依赖水解酶类上调表达且表达量是对照的3.256 6倍,表明渗透胁迫下次生代谢产物影响了玉米体内锌依赖水解酶类的表达。非特异性脂质转移蛋白(nonspecific lipid-transfer protein,nsLTPs)是一类广泛存在于植物中的碱性小蛋白,参与许多生物进程,如磷脂转移、生殖发育、病原菌防御和非生物胁迫反应[13]。本研究处理组nsLTPs上调表达且表达量是对照的3.218 7倍,表明渗透胁迫下次生代谢产物影响了玉米体内nsLTPs的表达。在渗透胁迫下,次生代谢产物还引起了大量假设蛋白表达量的变化。其中,hypothetical protein LOC100277838上调表达且表达量是对照的40.270 2倍,它是由Robert E. Sharp实验室在干旱胁迫下选取玉米根部构建标准化文库时获得,位于第8条染色体上[14]。hypothetical protein LOC100272329上调表达且表达量是对照的21.432 8倍,具有泛素硫酯酶活性,参与泛素依赖蛋白分解代谢生物过程,位于第4条染色体上[15]。hypothetical protein LOC100191831上调表达且表达量是对照的6.798 6倍,由Schnable等[15]于2009年进行玉米全基因组测序时获得,位于第9条染色体上。虽然干旱胁迫下次生代谢产物仅引起玉米根部2.51%基因的表达量发生变化,但这些差异表达基因表现出广泛的功能多样性。
4 结论本研究采用基因芯片技术,渗透胁迫下在次生代谢产物处理的玉米根系中共检测到差异表达的基因441个,包括147个上调基因,294个下调基因。通过GO体系对这些差异基因进行功能分类,其中45%基因参与各种生物学过程;36%基因编码产物则与执行各种分子功能有关;18%基因与生成各种细胞组分有关;1%与GenBank中功能未知序列相对应,这些基因所起的作用还需进一步研究。利用KEGG数据库进行查询,结果表明这些差异基因参与了21条生物学代谢通路,包括基础物质代谢、能量代谢、次生代谢及信号转导等。
| [1] | 葛淑娟, 孙爱清, 刘鹏, 等. 玉米响应渗透胁迫的数字基因表达谱分析[J]. 作物学报, 2014, 40(7) : 1164–1173. |
| [2] | Campos H, Cooper M, Habben JE, et al. Improving drought tolerance in maize:a view from industry[J]. Field Crops Res, 2004, 90 : 19–34. |
| [3] | 卜令铎, 张仁和, 常宇, 等. 苗期玉米叶片光合特性对水分胁迫的响应[J]. 生态学报, 2010, 30(5) : 1184–1191. |
| [4] | 霍金龙, 苗永旺, 曾养志. 基因芯片技术及其应用[J]. 生物技术通讯, 2007, 18(2) : 329–332. |
| [5] | 陈郁. 基因芯片数据分析及在植物基因组研究中的应用[J]. 氨基酸和生物资源, 2008, 30(1) : 33–36. |
| [6] | Zhu JK. Salt and drought stress signal transduction in plants[J]. Annu Rev Plant Biol, 2002, 53 : 247–273. |
| [7] | 王金. 玉米耐旱突变体18-599M谷胱甘肽硫转移酶的突变鉴定[D]. 雅安:四川农业大学,2009:29. |
| [8] | 王丽萍, 戚元成, 张世敏, 等. 盐地碱蓬GST基因的克隆、序列分析及其表达特征[J]. 植物生理与分子生物学报, 2002, 28(2) : 133–136. |
| [9] | Edwards R, Dixon DP. Herbicides and their mechanisms of action[M]. Sheffield: Sheffield Academic Press, 2000 : 33-71. |
| [10] | Gallé á, Csiszár J, Benyó D, et al. Changes of glutathione S-transferase activities and geneexpression in Triticum aestivum during polyethylene-glycolinduced osmotic stress[J]. Acta Biologica Szegediensis, 2005, 49(1-2) : 95–96. |
| [11] | 戚元成, 张小强, 刘卫群, 等. 过量表达谷胱甘肽转移酶基因对转基因拟南芥抗旱能力的影响[J]. 植物生理学通讯, 2008, 44(2) : 268–270. |
| [12] | 刘迪林.赵普艳. 植物基质金属蛋白酶的研究进展[J]. 西北植物学报, 2013, 33(3) : 636–642. |
| [13] | Wei KF, Zhong XJ. Non-specific lipid transfer proteins in maize[J]. BMC Plant Biol, 2014, 14 : 281. |
| [14] | Bohnert H, Sharp RE, Springer GK, et al. Functional genomics of root growth and root signaling under drought[J]. NSF Grant, 2002 : DBI-0211842. |
| [15] | Schnable PS, Ware D, Fulton RS. The B73 maize genome:complexity,diversity,and dynamics[J]. Science, 2009, 326(5956) : 1112–1115. |