2. 中国热带农业科学院热带生物技术研究所农业部热带作物生物学与遗传资源利用重点实验室,海口 571101;
3. 中国热带农业科学院南亚热带作物研究所,湛江 524091
2. Key Laboratory of Biology and Genetic Resources of Tropical Crops,Institute of Tropical Bioscience and Biotechnology(Ministry of Agriculture),Chinese Academy of Tropical Agricultural Sciences,Haikou 571101;
3. South Subtropical Crops Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091
植物的生长依赖植物的根系从土壤中吸取水分运输到其他器官中[1]。然而,干旱、高盐、寒冷等外界环境的胁迫会导致植物水分缺失而影响植物的生长和产量。水分的运输是维持植物使其具有忍耐干旱和高盐胁迫的一个重要过程[2-4]。水通道蛋白(AQP)能够运输水分以及其他小分子物质,如甘油、CO2和硼等[5-7]。AQP在植物中的生物活性是多样性的,包括种子萌发、气孔运动、细胞伸长及响应外界胁迫等[8, 9]。在许多植物中都已经鉴定出了AQP蛋白,包括拟南芥中的35个[10],水稻种的33个[11],玉米种的36个[12]。水通道蛋白根据序列同源性分成4类,包括液泡膜内在蛋白(tonoplast in-trinsic protein,TIPs)、质膜内在蛋白(plasma membrane intrinsic protein,PIPs)、NOD26-like内在蛋白(NOD26-like intrinsic proteins,NIPs)和小的内在蛋白(small and basic intrinsic proteins,SIP)[13]。这4类AQP具有高度保守结构,均有6个倾斜的右旋性跨膜结构(TM1-TM6),并被5个环(Loop)所连接[12]。AQP在植物中涉及许多发育过程,如种子萌发、果实成熟、细胞伸长等[9]。在Liu等[14]研究中,过表达OsPIP1;1能够增加转基因水稻种子产量,提高种子的发芽率。而GhPIP1;2 和 GhgammaTIP1能使水分快速进入液泡,从而促进棉花纤维细胞伸长[15]。此外,关于AQP对植物抵御外界非生物胁迫的研究近年来成为研究其功能的一个热点,许多实验结果显示,植物能够通过调节AQP的活性响应各种逆境的胁迫,如旱害、冷害、盐害、机械损伤、渗透胁迫及重金属胁迫等。本研究从香蕉中克隆出一个MaSIP2-1基因,并对其在非生物胁迫处理下的表达模式做了研究,旨在为进一步研究该基因的功能奠定基础。
1 材料与方法 1.1 材料2015年1月初采集巴西香蕉(Musa acuminata L.AAA group‘Brazilian’)的根、茎、叶、花及果实,用无菌水清洗后立即放置于液氮中速冻,于-70℃冰箱中保存备用。实验所用香蕉均采自中国热带农业科学院儋州组培中心。
1.2 方法 1.2.1 目的基因的获得从香蕉A基因组测序数据库中得到一个AQP家族基因MaSIP2-1,根据其序列设计一对引物S1,S2(表 1),扩增MaSIP2-1全长序列。PCR扩增程序为:95℃预变性5 s;94℃变性40 s,55℃退火40 s,72℃延伸1 min 30 s,共35个循环。按照分子克隆实验指南进行PCR扩增产物回收、连接、转化和鉴定。对已鉴定的阳性克隆进行测序分析。
将基因MaSIP2-1的cDNA 序列和开放阅读框(open reading frame,ORF)编码的氨基酸序列在NCBI 数据库中的BLASTx进行同源性搜索和比对,利用Clustal X1.81 和MEGA 3.1 软件分析MaSIP2-1蛋白与其他植物的SIP2-1蛋白的进化关系,构建分子进化树。
1.2.3 MaSIP2-1在香蕉不同器官中的表达分析以香蕉五叶一心期的根、茎、叶片及花和果实采后当天的cDNA为模板,采用RT-PCR 方法分析其组织特异性表达。以香蕉MaActin片段为内参,引物为NCBI 上已登录序列MaActin1和MaActin2,MaSIP2-1引物为P1和P2。PCR 反应体系为25 μL。反应程序:95℃预变性30 s;95℃ 7 s,56℃ 15 s,72℃ 20 s,40个循环后作熔解曲线(95-55℃,0.1℃ · s-1)。
1.2.4 基因的表达分析 1.2.4.1 干旱胁迫处理取20株五叶一心、心叶未展、生长健壮的香蕉幼苗,分为4组,每组5株。测定各组中土壤水分含量并调整为一致。实验设计如下:第1组:正常生长(作为对照),按规律浇水,土壤相对含水量保持在75%-80%;第2组:低度失水干旱胁迫,土壤相对含水量保持在55%-60%;第3组:中度失水干旱胁迫,土壤相对含水量保持在45%-50%;第4组:高度失水干旱胁迫,土壤相对含水量保持在30%-35%。将所有香蕉苗均放入恒温人工气候箱中培养。设定环境温度为25-30℃,光照强度为2 000 lx,空气相对湿度40%。利用烘干土法控制调节土壤相对含水量,每隔3 h进行测定,达到不同胁迫标准后取出植株叶片置于液氮中迅速冷冻,提取RNA。
1.2.4.2 高盐胁迫处理在培养液(1/2Hoagland营养液)中加入300 mmol/L NaCl进行盐胁迫处理。白天的平均温度为33-35℃,夜间的平均温度为26-28℃,光照充分,于0、2、4和6 h分别观察和取样。将材料的叶片置于液氮中冷冻,提取RNA。
1.2.4.3 低温胁迫处理选取生长一致,长势健壮的香蕉幼苗,分为5组,置于人工气候箱培养进行低温处理。处理方法如下:从25℃开始降温到15℃、10℃、7℃和5℃四个不同的温度。第1组:对照组,将香蕉苗在25℃下连续培养12 h;第2组将香蕉苗从25℃降至15℃环境中并培养12 h;第3组:使香蕉苗从25℃降至10℃,并在10℃培养箱中生长12 h;第4组:将培养箱温度降至7℃,将香蕉苗置于其中生长12 h;第5组:使香蕉苗从25℃降至在5℃,并在该低温下处理材料12 h。处理期间光照强度均为2 000 lx,相对湿度为85%。处理完毕后,取各组材料心叶下第一片完全展开叶立即置于液氮中冷冻,提取RNA。
1.2.4.4 -水涝胁迫处理选取长势一致的土栽苗,将根部全部浸入水中进行涝害实验,设置淹水0、12、24 和36 h 4个处理,每个处理重复3次。定期取样:直径为1 mm左右白色新嫩根,迅速吸干根表面水分,立即用液氮速冻,提取RNA。
2 结果 2.1 MaSIP2-1的克隆及序列分析以正常生长的巴西蕉幼苗叶片cDNA为模板,MaSIP2-1 S1和MaSIP2-1 S2为引物,从香蕉栽培品种巴西蕉中克隆到一个AQP家族基因,其ORF为717 bp,编码239个氨基酸。利用DNAman 将MaSIP2-1 cDNA 推导的氨基酸序列与NCBI中已登录的其它高等植物的SIP氨基酸序列进行同源关系比较,结果(图 1)显示,各种植物SIP编码的氨基酸序列存在较高的同源性,多数达63%以上。BLASTX分析表明,MaSIP2-1编码的氨基酸序列与马来西亚野生蕉MaSIP2-1-like(XP_009402451.1)、油棕EgSIP2-1(XP_010909819)、麻风树JcSIP2-1(XP_012079611)、野茶树CsSIP2-1(AHE93339.1)编码的氨基酸序列具有较高的一致性,分别为98%、74%、65%和63%。利用Clustal X1.81和MEGA 3.1软件,将MaSIP2-1 cDNA推导的氨基酸序列与NCBI中已登录的其它植物的SIP氨基酸序列进行系统进化树的比对分析。结果(图 2)表明,本研究得到的巴西蕉MaSIP2-1基因所编码的氨基酸序列与马来西亚野生蕉MaSIP2-1-like具有较近的亲缘关系。

|
| 图 1 MaSIP2-1编码的氨基酸序列与其他植物SIP2-1 蛋白氨基酸同源性分析 |

|
| 图 2 不同植物SIP2-1 氨基酸序列的系统树分析 |
MaSIP2-1在香蕉的根、茎、叶片、花和果实各器官中均有所表达,其中在茎中表达量较高,是叶中表达量的12.22倍。在叶中的表达量最低为1,而在根、花和果实中表达量分别为3.83和1.3(图 3)。

|
| 图 3 MaSIP2-1 在香蕉不同器官中的qPCR 表达分析 |
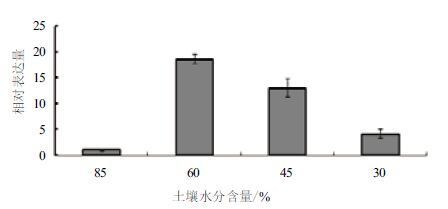
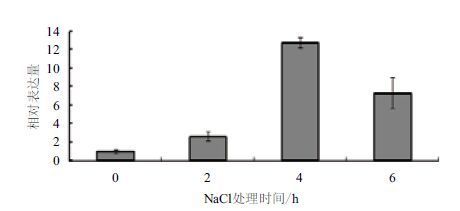
为了研究MaSIP2-1基因是否响应外界非生物胁迫,利用qPCR对MaSIP2-1在干旱、高盐、低温、水涝胁迫处理下叶片中的表达模式进行分析,如图 4所示,在干旱处理下,MaSIP2-1在土壤水分含量为60%是表达量最高,随着水分含量降低,其表达量逐渐受到抑制。用300 mmol/L高盐对香蕉幼苗进行胁迫处理,于0、2、4 和6 h分别取样,如图 5所示,MaSIP2-1在高盐胁迫处理4 h时被高度诱导表达,随后其表达量又下降,呈现先升后降的趋势,其在4 h的表达量分别为0、2和6 h的12.72、6.10和1.71倍。
|
| 图 4 MaSIP2-1 在干旱胁迫下的差异表达 |
|
| 图 5 MaSIP2-1 在高盐胁迫下的差异表达 |
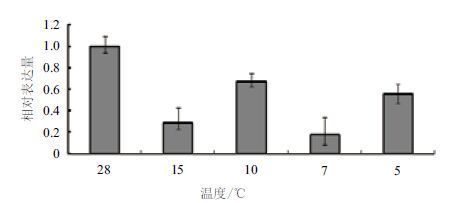
对其进行低温胁迫处理,如图 6所示,随着温度的降低,MaSIP2-1的表达量均没有呈现太大的变化,表达量均在1以下,其并未受到温度的诱导表达。
在涝害胁迫处理下,如图 7所示,将香蕉苗淹水处理24 h后,其表达量达到最高值为2.13,而在处理36 h后其表达量反而达到最低值,说明淹水处理24 h时能够高度诱导MaSIP2-1的表达。
|
| 图 6 MaSIP2-1 在低温胁迫下的差异表达 |

|
| 图 7 MaSIP2-1 在水涝胁迫下的差异表达 |
许多研究表明,水通道蛋白基因的表达和生物活性受到包括非生物胁迫,植物激素等许多信号的影响[6, 10, 16-19]。其响应非生物胁迫的调控及生物学功能是十分复杂的,在许多转基因植株中,已经证明了一些水通道蛋白能够提高对非生物胁迫的耐受性[7, 9, 20-22]。例如,在拟南芥中过表达MaPIP1;1提高了转基因拟南芥对干旱和高盐胁迫的响应,而且转基因株系的根系增长,根毛增多[23]。过表达TaAQP8使转基因植株根系在高盐胁迫下根系伸长[24]。在高盐胁迫下,烟草NtAQP1能使转基因植株提高水分利用率[7]。在200 mmol/L NaCl的处理下,大麦HvPIP2能够调节水分的流失,在非洲爪蟾卵母细胞中表现出了较强的水转运活性[17]。在植物中过量表达一些AQP能够提高转基因植物对干旱胁迫的耐受性[7, 9, 22, 24]。例如,过表达TaAQP7提高了转基因烟草对干旱胁迫的耐受性[24]。在干旱胁迫时,麻疯树根和茎中 JcPIP2被诱导表达[25]。在拟南芥中转化大麦TaTIP2;2提高了转基因拟南芥对干旱的响应,而且这种响应是通过不依赖于ABA的信号途径[26]。MusaPIP1;2转香蕉植株中,表现出了较好的抗逆的特性[27]。在Sreedharan 的研究中,将MusaPIP1;2转化香蕉,转基因植株在干旱处理后复水,其恢复能力明显强于野生型。同时,对其生理生化指标进行测定,相对于对照其丙二醛含量降低,脯氨酸含量提高,相对水含量提高,说明转基因植株具有较强的抗旱性。
本实验从香蕉中克隆出香蕉水通道蛋白基因MaSIP2-1,为了进一步研究MaSIP2-1能否响应外界的非生物胁迫,本实验用干旱、高盐、低温以及水涝胁迫处理香蕉幼苗,结果表明,在干旱胁迫处理下,土壤水分含量为60%时MaSIP2-1被高度诱导表达,当土壤水分减少至45%和30%时,MaSIP2-1表达下调,说明该基因响应外界干旱胁迫。在高盐胁迫处理下,当处理2 h时其表达量升高,在4 h时达到峰值,处理6 h后表达反而下调,呈现先升后降的趋势。该实验结果表明MaSIP2-1受到高盐胁迫的诱导表达。该结果与候晓婉等[28]报道的巴西蕉和粉蕉中MaPIP2-6在甘露醇和高盐胁迫处理下的表达趋势基本一致,在处理早期轻微下降,而后被诱导达到最大值,接着下降。结果表明,该基因在响应渗透胁迫的过程中,可能在早期出现了一个‘Shock’,随后呈现出被诱导的趋势。而在低温处理下,该基因的表达量变化差异不显著,其表达量均在1以下,表明其并未受到低温诱导表达。在拟南芥中,低温胁迫能够诱导AtPIP2;5和AtPIP2;6表达,却抑制了AtPIP1;5和AtPIP2;3等基因的表达[29]。因此,AQP家族成员对低温胁迫的响应表现出不同的模式。在水涝胁迫处理时,与对照相比,淹水处理12 h时MaSIP2-1表达下调,而处理24 h时MaSIP2-1被高度诱导表达,达到峰值,为对照的2.2倍,随着处理时间的增加当达到36 h时,其表达量下调达到最低值,说明MaSIP2-1能够被水涝胁迫诱导表达。
4 结论综上所述,本实验中克隆到的香蕉MaSIP2-1属于AQP家族中SIP亚类中的一个,QPCR实验表明MaSIP2-1能够参与非生物逆境胁迫应答,响应非生物胁迫包括干旱、高盐和水涝胁迫。
| [1] | Aharon R, Shahak Y, Wininger S, et al. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress[J]. Plant Cell, 2003, 15 : 439–447. |
| [2] | Bray EA. Molecular responses to water deficit[J]. Plant Physiol, 1993, 103 : 1035–1040. |
| [3] | Cheeseman JM. Mechanisms of salinity tolerance in plants[J]. Plant Physiol, 1988, 8 : 547–550. |
| [4] | Blumwald E. Sodium transport and salt tolerance in plants[J]. Curr Opin Cell Biol, 2000, 12 : 431–434. |
| [5] | Uehlein N, Lovisolo C, Siefritz F. Kaldenhoff:the tobacco aquaporin NtAQP1 is a membrane CO2 pore with physiological functions[J]. Nature, 2003, 425 : 734–737. |
| [6] | Kaldenhoff R, Fischer M. Aquaporins in plants[J]. Acta Physiol, 2006, 187 : 169–176. |
| [7] | Sade N, et al. The role of tobacco Aquaporin1 in improving water use efficiency,hydraulic conductivity,and yield production under salt stress[J]. Plant Physiol, 2010, 152 : 245–254. |
| [8] | Eisenbarth DA, Weig AR. Dynamics of aquaporins and water relations during hypocotyl elongation in Ricinus communis L.seedlings[J]. J Exp Bot, 2005, 56 : 1831–1842. |
| [9] | Gao Z, He X, Zhao B, et al. Overexpressing a putative aquaporin gene from wheat,TaNIP,enhances salt tolerance in transgenic Arabidopsis[J]. Plant Cell Physiol, 2010, 51 : 767–775. |
| [10] | Johanson U, Karlsson M, Johansson I, et al. The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[J]. Plant Physiol, 2001, 126 : 1358–1369. |
| [11] | Sakurai J, Ishikawa F, Yamaguchi T, et al. Identification of 33 rice aquaporin genes and analysis of their expression and function[J]. Plant Cell Physiol, 2005, 46 : 1568–1577. |
| [12] | Chaumont F, Barrieu F, Wojcik E, et al. Aquaporins constitute a large and highly divergent protein family in maize[J]. Plant Physiol, 2001, 12 : 1206–1215. |
| [13] | Maurel C, Verdoucq L, Luu DT, et al. Plant aquaporins:membrane channels with multiple integrated functions[J]. Annu Rev Plant Biol, 2008, 59 : 595–624. |
| [14] | Liu CW, Fukumoto T, Matsumoto T, et al. Aquaporin OsPIP1;1 promotes rice salt resistance and seed germination[J]. Plat Physiology and Biochemistry, 2013, 63 : 151–158. |
| [15] | Yang S, Cui L. The action of aquaporins in cell elongation,salt stress and photosynthesis[J]. Sheng Wu Gong Cheng Xue Bao, 2009, 25(3) : 321–327. |
| [16] | North GB, Nobel PS. Heterogeneity in water availability alters cellular development and hydraulic conductivity along roots of a desert succulent[J]. Ann Bot, 2000, 85 : 247–255. |
| [17] | Horie T, Kaneko T, Sugimoto G, et al. Mechanisms of water transport mediated by PIP aquaporins and their regulation via phosphorylation events under salinity stress in barley roots[J]. Plant Cell Physiol, 2011, 52 : 663–675. |
| [18] | Chaumont F, Moshelion M, Daniels MJ. Regulation of plant aquaporin activity[J]. Biol Cell, 2005, 97 : 749–764. |
| [19] | Bienert GP, et al. Membrane transport of hydrogen peroxide[J]. Biochim Biophys Acta, 2006, 1758 : 994–1003. |
| [20] | Lian HL, Yu X, Ye Q, et al. The role of aquaporin RWC3 in drought avoidance in rice[J]. Plant Cell Physiol, 2004, 45 : 481–489. |
| [21] | Guo L, Wang ZY, Lin H, et al. Expression and functional analysis of the rice plasma-membrane intrinsic protein gene family[J]. Cell Res, 2006, 16 : 277–286. |
| [22] | Zhou S, Hu W, Deng X, et al. Overexpression of the wheat aquaporin gene,TaAQP7,enhances drought tolerance in transgenic tobacco[J]. PLoS One, 2012, 7 : e52439. |
| [23] | Xu Y, Hu W, Liu JH, et al. A banana aquaporin gene,MaPIP1;1,is involved in tolerance to drought and salt stresses[J]. BMC Plant Biology, 2014, 14 : 59. |
| [24] | Hu W, Yuan Q, Wang Y, et al. Overexpression of a wheat aquaporin gene,TaAQP8,enhances salt stress tolerance in transgenic tobacco[J]. Plant Cell Physiol, 2012, 53 : 2127–2141. |
| [25] | Jang HY, Yang SW, Carlson JE, et al. Two aquaporins of Jatropha are regulated differentially during drought stress and subsequent recovery[J]. J Plant Physiol, 2013, 170(11) : 1028–1038. |
| [26] | Xu CH, et al. Heterologous expression of the wheat aquaporin gene TaTIP2;2 compromises the abiotic stress tolerance of Arabidopsis thaliana[J]. PLoS One, 2013, 8(11) : e79618. |
| [27] | Sreedharan S, Shekhawat UK, Ganapathi TR. Transgenic banana plants overexpressing a native plasma membrane aquaporin MusaPIP1;2 display high tolerance levels to different abiotic stresses[J]. Plant Biotechnology Journal, 2013, 11 : 942–952. |
| [28] | 候晓婉, 胡伟, 颜彦, 等. 香蕉MaPIP2-6基因的克隆、亚细胞定位及表达分析[J]. 西北植物学报, 2015, 35(3) : 427–433. |
| [29] | Jang JY, Kim DG, Kim YO, et al. An expression analysis of a gene family encoding plasma membrane aquaporins in response to abiotic stresses in Arabidopsis thaliana[J]. Plant Molecular Biology, 2004, 54(5) : 713–725. |





