2. 广西农科院作物遗传改良生物技术重点实验室,南宁 530007;
3. 广西农科院蔬菜研究所,南宁 530007
2. Guangxi Key Laboratory of Crop Genetic Improvement and biotechnology,Guangxi Academy of Agricultural Sciences,Nanning 530007;
3. Vegetable Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007
肌动蛋白(Actin)是一种普遍存在于真核生物细胞中的结构蛋白质,是构成细胞骨架中微丝的主要组分。它是单一多肽链的球状蛋白,由375-377个氨基酸组成[1]。由于actin蛋白是组成型表达,在细胞中能稳定表达,常作为半定量RT-PCR以及实时荧光定量PCR分析基因表达水平的经典内参基因[2-4]。至今,已相继从拟南芥[5]、水稻[6]、玉米[7]、长穗偃麦草[8]、木薯[9]、百合[10]、陆地棉[11]、海州香薷[12]及香樟[13]等高等植物中克隆出Actin基因。这些基因在真核细胞进化过程中高度保守,氨基酸序列同源性高达70%-100%。
山药为薯蓣科(Dioscoreaceae)薯蓣属(Dios-corea)草本植物,是一种药食兼用的重要块茎类经济作物[14]。薯蓣全球共有600多个种,其中山药品种(D. opposita)为全球最重要的6大可食用的薯蓣品种之一[15],在亚洲国家被广泛种植[16],也已成为我国山药的主栽品种之一。我国山药种植面积已由2008年的20万hm2左右发展到2013年的近47万hm2[17]。因此,山药的产量和品质不仅关系到山药产业的生产效益问题,而且关系到国家的粮食安全问题。为促进山药产业的发展,近10年来,科技工作者加强了山药栽培技术[18-20]、新品种选育[21-23]、深加工[24]等方面的研究,而在山药块茎生长发育、产量形成调控机理等方面的基础研究很薄弱。基因表达量差异的研究,需要一个恒定表达的内参基因作为标准来衡量。目前,已有报道借用其他物种的Actin作为内参基因[25-27],在GenBank中仅有盾叶薯蓣(俗称黄姜,D. zingiberensis)的1个Actin蛋白质和mRNA片段的记录,并被作为内参基因在紫山药上进行应用[28],而尚未见有关山药(D. opposita)的Actin基因克隆和应用研究的报道。因此,获取山药中Actin基因,分析测定其表达稳定性,以确定其是否能够作为山药植物内参基因使用,对今后山药重要调控和功能基因表达的研究具有重要意义。本研究采用RT-PCR法进行山药actin基因克隆,并进行序列比对分析,同时结合实时荧光定量PCR(RT-qPCR)技术研究其在山药叶片、地上茎、地下块茎以及不同发育时期的块茎和叶片中的稳定性,旨在为山药优良内参基因的确定、山药生长发育中肌动蛋白的作用等研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料以广西农科院经济作物研究所选育的山药品种“桂淮5号”为供试材料,分别取块茎膨大期的叶片、地上茎、地下块茎以及不同发育时期的块茎,经液N2速冻后放入-80℃冰箱中保存备用。
1.1.2 主要试剂与仪器DL2000 DNA Marker、Taq DNA聚合酶、dNTP、大肠杆菌JM109菌株、克隆载体pMDTM19-T、RNA提取试剂盒、反转录试剂盒、胶回收试剂盒等均购自TaKaRa公司,氨苄青霉素(Amp)、异丙基硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚-β-D-吡喃半乳糖苷(X-Gal)购自上海生工。RT-qPCR反应试剂为iTaq Universal SYBR Green Supermix、0.2 mL低位白色8联管以及光学级8联管平顶盖等购自美国伯乐(Bio-Rad)公司。荧光定量PCR仪为美国伯乐公司生产的CFX-96实时荧光定量系统。
1.2 方法 1.2.1 引物的设计及合成通过比对GenBank中已公布的其他植物Actin基因cDNA序列,根据保守区域利用Primer5.0软件设计一对简并引物,上游引物DoAct-R:5′-TGAYAATGGDACWGGNATGG-3′,下游引物DoAct-F:5′-CACTTCCKGTGVACAATGG-3′(其中:Y=C/T,D=A/T/G,W=A/T,N=A/C/G/T,K=G/T,V=G/C/A),预测所得片段长度约为1 100 bp;根据DoActin基因核苷酸序列的特异区域设计一对实时荧光定量PCR引物DoAct-RTR:5′-GAGCAAGGAA-ATCACAGCAC-3′和DoAct-RTF:5′-TCAGGGAAG-CCAAGATAGAG-3′,扩增片段138 bp。引物合成和基因测序由北京奥科鼎盛生物科技有限公司完成。
1.2.2 山药总RNA的提取根据TaKaRa的MiniBE-ST多糖多酚植物组织总RNA抽提试剂盒说明书,分别提取山药叶片、地上茎、地下块茎中的总RNA。用IMPLEN超微量紫外分光光度计测定OD260和OD280值及RNA浓度,用1.5%琼脂糖凝胶电泳检测RNA的完整性。
1.2.3 RT-PCR扩增根据PrimeScriptTMⅡ第一链cDNA合成试剂盒操作说明书,取1 µg RNA反转录合成第一链cDNA,作为PCR扩增山药Actin基因片段的模板。PCR扩增反应体系为25 µL,具体如下:cDNA 2.0 µL,10× PCR Buffer(含20 mmol/L Mg2+)2.5 µL,2.5 mmol/L dNTP 2.0 µL,10 µmol/L Primer-R 1 µL,10 µmol/L Primer-F 1 µL,Taq DNA聚合酶(5 U/μL)0.2 μL,ddH2O 16.3 μL。反应条件为:94℃预变性 5 min;94℃变性 30 s,45-48℃退火 45 s,72℃延伸 1 min,35个循环;72℃延伸 10 min,4℃下低温放置。2%琼脂糖凝胶检测 PCR 扩增产物。
1.2.4 PCR扩增产物回收检测扩增产物与预期大小相符后,另做8管20 μL体系,合并,在1.5%的琼脂糖凝胶上电泳,利用TaKaRa的MiniBESTVer.4.0琼脂糖凝胶DNA回收试剂盒,回收目的条带。用IMPLEN超微量紫外分光光度计测定OD260和OD280值及回收产物的浓度。
1.2.5 PCR扩增产物的连接及转化参照克隆载体pMDTM19-T克隆试剂盒说明书,根据测得的回收产物的浓度确定产物DNA加入的量,将回收目的条带连接于克隆载体pMDTM19-T上,并转化大肠杆菌JM109感受态细胞,在含Amp、X-Gal、IPTG的LB固体培养基上筛选培养,挑选白色菌落扩大培养,采用目的条带引物检测菌液PCR,送阳性克隆测序。
1.2.6 Actin基因的序列分析应用NCBI的ORF程序对所得的序列查找开放阅读框,并推导出其氨基酸序列。使用NCBI中的Blast对所得基因的核苷酸序列与氨基酸序列进行比对,根据结果选取各种植物的Actin氨基酸序列,采用DNAMAN软件比对多序列,采用MEGA5.1软件构建多序列进化树。
1.2.7 DoActin基因的定量表达分析(1)反应体系的优化:采用SYBR Green染料法,在Bio-Rad CFX-96荧光定量PCR仪上进行扩增和数据分析。分别对荧光定量引物的退火温度、引物浓度、循环条件(2步法和3步法)进行优化,确定最佳扩增体系和条件。优化后的RT-qPCR反应体系为:Mix 10 µL,DoAct-RTR 1 µL,DoAct-RTF 1 µL,cDNA(稀释3倍)2 µL,ddH2O 6 µL。扩增条件为:95℃ 3 min,95℃ 5 s,60℃ 30 s,循环数39个。(2)熔解曲线分析和标准曲线的建立:首先采用普通PCR,产物用1%琼脂糖凝胶电泳检测,再对RT-qPCR产物熔解峰进行分析,以确定得到的产物是否为目的产物。以其中一份阳性样品cDNA进行5倍梯度稀释作为模板,采用优化好的条件进行RT-qPCR,建立标准曲线。(3)提取山药膨大期的叶片、地上茎、地下块茎以及不同发育时期块茎和叶片中的总RNA,用吸光值法测定不同组织的RNA量。不同组织取1 µg RNA进行逆转录,然后进行RT-qPCR分析。根据各个样品的平均CT值,利用Excel 2010作图。
2 结果 2.1 总RNA的提取及检测以山药块茎为材料提取总RNA,经1.5%琼脂糖凝胶电泳检测,结果显示28S rRNA、18S rRNA条带整齐清晰,且28S rRNA的亮度约为18S rRNA的2倍(图 1),表明获得的总RNA较完整。

|
| 图 1 山药块茎总RNA 电泳图 |
经紫外分光光度计测定和分析,RNA样品OD260/OD280的平均值为1.95,OD260/OD230的平均值为2.06,浓度为580-810 ng/µL,表明所提取的总RNA样品基本没有酚类、蛋白质及其他小分子物质的污染,纯度较高,可用于反转录反应。
2.2 RT-PCR扩增以第一链cDNA为模板,用引物Primer-F和Primer-R在不同退火温度下进行PCR扩增,获得一条约为1 100 bp的条带,与预期的目的片段大小相似(图 2)。根据相同量的PCR产物的亮度可知,在47℃下产物条带最亮,说明引物对Primer-F和Primer-R适宜的退火温度为47℃。

|
| 图 2 不同退火温度下的PCR 产物 |
将目的条带进行凝胶回收,紫外分光光度计测得的回收产物OD260/OD280为1.8,OD260/OD230为2.0,浓度为177 ng/μL,说明回收的DNA产物纯度高,无蛋白质和盐分的污染。
2.4 回收产物的克隆以pMDTM19-T Vector为载体,吸取适量的回收产物DNA进行TA连接,转化大肠杆菌JM109。在选择培养基(含Amp、X-Gal、IPTG)上挑取10个白色菌落,菌落PCR鉴定重组质粒,结果(图 3)表明,10个克隆中有7个为阳性克隆。
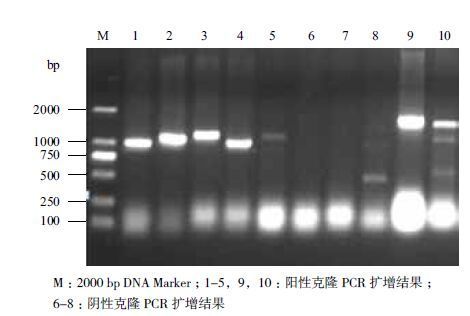
|
| 图 3 菌落PCR 阳性克隆检测 |
送其中5个阳性克隆进行测序,其测序结果完全一致,得到1 091 bp片段,编码358个氨基酸。将核苷酸序列在NCBI网站上进行Blastn比对分析。结果表明,山药和油棕等其他100多种植物Actin核苷酸序列的相似性均在83%以上,其中与海枣(Phoenix dactylifera,LOC103720863)Actin-2的同源性达86%。由此推断,本研究所获得的基因片段应该为山药肌动蛋白Actin基因片段,将其命名为DoActin,提交GenBank,登录号为KU669295。
将山药DoActin推导的氨基酸序列在NCBI网站上进行Blastp比对分析,结果表明,山药与其他植物的Actin蛋白相似性都较高,为97%-99%,其中与番荔枝(Annonacherimola,AFD62269.1)及木本棉(Gossypiumarboreum,KHG20985.1)的相似性达99%。将山药Actin蛋白与NCBI数据库中筛选出的22种植物的Actin蛋白,采用DNAMAN进行了多序列比较分析,结果发现有339个氨基酸处于保守区域,而仅有38个氨基酸不保守(图 4),即不同植物的Actin蛋白氨基酸序列只有在少数位置有突变发生,说明了植物肌动蛋白基因高度保守。

|
| 图 4 山药DoActin 基因编码的氨基酸序列与其他作物Actin 氨基酸序列的比对 |
从NCBI下载与山药肌动蛋白同源性较高的不同类型的22个Actin蛋白氨基酸序列,采用MEGA5.1软件,以邻位相连法(neighbor-joining,NJ)构建进化树,各参数的设置采用默认值。结果(图 5)显示,22个植物Actin蛋白被分进了两个亚群即ClassⅠ、Class Ⅱ中。山药肌动蛋白分布在ClassⅠ中,与海枣(Phoenix dactylifera,XP_008809027.1)Act-in-2、木本棉(Gossypiumarboreum,KHG20985.1)Ac-tin-7的亲缘关系最近,说明这3种植物Actin基因之间的进化可能只是在少数核苷酸位点上产生突变。
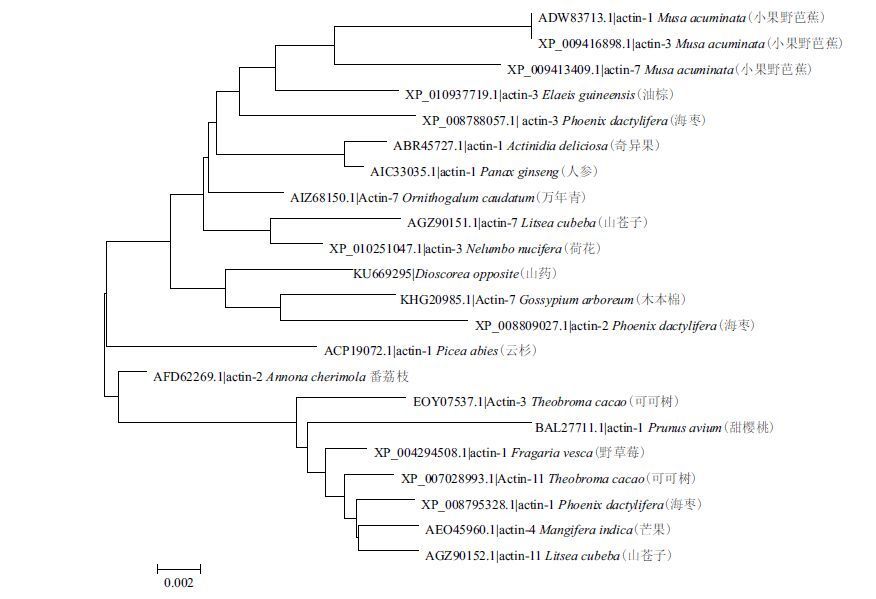
|
| 图 5 山药Actin 与其他植物Actin 的系统进化树 |
利用DoAct-RTR和DoAct-RTF引物进行普通PCR扩增,琼脂糖凝胶电泳结果显示扩增产物长度与预期长度一致,无引物二聚体和非特异条带。对荧光定量RT-PCR产物进行熔解峰分析(图 6),DoActin片段在Tm=80-80.5℃处显示特异性单峰,进一步说明扩增产物无引物二聚体及非特异性扩增,证实引物设计的合理性和特异性。

|
| 图 6 DoActin 基因的熔解峰 |
以其中一份阳性cDNA样品进行5倍梯度稀释,以优化好的条件进行荧光定量RT-PCR扩增。得到的扩增曲线(图 7)和标准曲线(图 8),结果显示,以Cq值为纵坐标(Y),以稀释倍数的对数为横坐标(X)建立的相对定量标准曲线,在所使用的浓度范围内具有良好的线性关系(R2=0.996),扩增效率为99.3%。
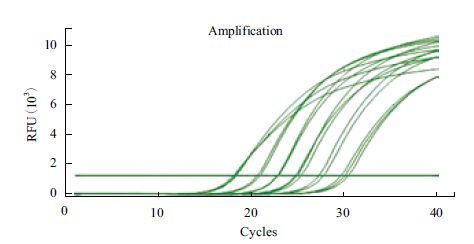
|
| 图 7 DoActin 基因的扩增曲线 |
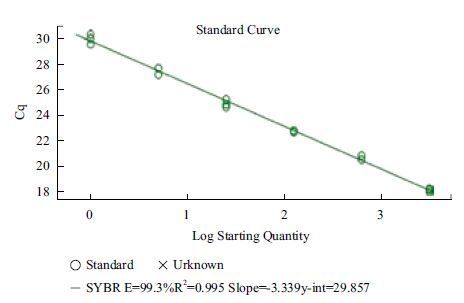
|
| 图 8 DoActin 基因的标准曲线 |
RT-qPCR分析结果显示,DoActin基因在山药块茎膨大中期的地下块茎、地上嫩茎、叶片中的平均CT值无显著差异(图 9-A),不具有组织表达特异性;DoActin基因在山药地下块茎形成期、膨大前期、膨大中期、膨大后期,以及成熟期的各个块茎样品中的平均CT值间也无显著差异,且在这些时期的各个叶片样品中的平均CT值之间也无显著差异(图 9-B),说明DoActin基因在不同的发育时期的块茎和叶片中表达量基本一致。因此,DoActin应该为组成型表达的肌动蛋白基因。

|
| 图 9 山药DoActin 基因在植物不同器官(A)及不同发育 时期的块茎和叶片(B)中的平均CT 值 |
目前,在半定量PCR或实时荧光定量PCR分析中,有多种类似的看家基因被选作内参基因,如肌动蛋白基因(ACT)、甘油醛 -3-磷酸脱氢酶基因(GAPDH)、18S和 28S核糖体RNA基因(18S rRNA、28S rRNA)及肽链延伸因子(ef1-α)基因等[29-31]。但在大多植物的表达研究中,Actin基因家族是使用最频繁的管家基因。肌动蛋白参与真核生物细胞的许多重要的生命活动,如:细胞分裂、细胞伸长、胞吞、细胞信号转导、重力传感、顶端生长、细胞器运动及细胞程序性死亡等[32-34]。Actin基因不论在核苷酸还是氨基酸水平上都具有高度的保守性和同源性,在各种组织中恒定表达,因而常被作为研究其他基因的表达模式及调控机制的分子内标,以比较不同来源的基因表达量的差异[35],主要包括ACT2/7、ACT8和ACT11等[4]。因此,本研究也是最先考虑Actin作为研究山药生长发育调控基因表达的内参基因。对克隆到的1个山药肌动蛋白基因(DoActin)比对分析发现,cDNA的同源性小于氨基酸,表明在不同植物中,Actin基因的核苷酸序列虽然有一定的变异,但氨基酸序列却具有较高的稳定性和一致性,这保证了Actin基因功能的稳定性,这与前人[9, 10]的研究结果一致。
本研究中Actin进化树表明,山药Actin与海枣Actin-2、木本棉Actin-7的亲缘关系最近,推测它们之间的功能最相似,即推测所克隆到的DoActin能在山药细胞中稳定表达。本实验中RT-qPCR结果显示,DoActin在山药的各个组织、块茎发育的各个时期都有稳定的表达,且表达水平基本一致,因此推断DoActin为组成型表达的肌动蛋白基因,适宜将其作为研究山药其他调控基因表达的内参基因。至于山药中是否存在Actin基因家族,要在后续研究中加以证实。另外,同一物种如海枣、山苍子中不同类型的Actin蛋白却分布在不同的亚群中,说明肌动蛋白基因的分化可能发生在物种分化之前,这与Zhang等[36]、孔卫青和杨金宏[37]的研究结果相似。
本研究对DoActin的克隆填补了山药Actin研究领域的空白,丰富了高等植物Actin的核酸数据库,为进一步深入研究Actin的功能、保守性、变异性及其与生命起源与进化的关系提供了新的数据,同时也为下一步研究山药中重要调控基因的表达模式奠定了前期工作基础。
4 结论本研究所获得的1个山药DoActin,其与GenBank收录的前100种其他植物肌动蛋白基因在核苷酸、氨基酸水平的同源性分别在83%和97%以上,说明高等植物的Actin基因是一种高度保守的看家基因。DoActin基因在山药的各个器官以及不同发育期的块茎和叶片中表达量稳定,适宜将其作为研究山药其他调控基因表达的内参基因。
| [1] | Liang WH, Tang CR, Wu NH. Cloning and characterization of a new actin gene from Oryza sativa[J]. Prog Nat Sci, 2004, 14 : 867–874. |
| [2] | Peng XJ, et al. Improved drought and salt tolerance of Arabidopsis thaliana by transgenic expression of a novel DREB gene from Leymus chinensis[J]. Plant Cell Rep, 2011, 30 : 1493–1502. |
| [3] | 张勇, 汤浩茹, 罗娅, 等. 草莓 FaCBF1基因的克隆及表达分析[J]. 园艺学报, 2014, 41(2) : 240–248. |
| [4] | 袁伟, 万红建, 杨悦俭. 植物实时荧光定量PCR内参基因的特点及选择[J]. 植物学报, 2012, 4 : 427–436. |
| [5] | An YQ, McDowell JM, Huang S, et al. Strong constitutive expression of the Arabidopsis ACT2/ACT8 actin subclass in vegetative tissues[J]. Plant J, 1996, 10 : 107–121. |
| [6] | Reece KS, et al. Genomic nucleotide sequence of four rice(Oryza sativa)actin genes[J]. Plant Mol Biol, 1990, 14 : 621–624. |
| [7] | Alexandrov NN, et al. Insights into corn genes derived from large-scale cDNA sequencing[J]. Plant Mol Biol, 2009, 12 : 179–194. |
| [8] | 郭强, 孟林, 毛培春, 等. 长穗偃麦草Actin基因片段克隆及表达模式分析[J]. 生物技术通报, 2014(3) : 73–78. |
| [9] | 许娟, 罗兴录. 木薯Actin基因片段的克隆及序列分析[J]. 生物技术通报, 2011(6) : 65–70. |
| [10] | 梁云, 袁素霞, 冯慧颖, 等. 百合肌动蛋白基因lilyActin的克隆与表达分析[J]. 园艺学报, 2013, 7 : 1318–1326. |
| [11] | Li XB, Fan XP, Wang XL, et al. The cotton ACTIN1 gene is functionally expressed in fibers and participates in fiber elongation[J]. Plant Cell, 2005, 17 : 859–875. |
| [12] | 蔡深文, 熊治廷, 刘晨, 等. 海州香薷Actin基因片段克隆及表达分析[J]. 生物技术通报, 2015, 31(2) : 111–115. |
| [13] | 李勇鹏, 张力维, 姚瑶, 等. 香樟Actin基因的克隆及表达分析[J]. 生物技术通报, 2015, 31(5) : 120–127. |
| [14] | Arthur Q, Villordon IG, Nurit F. Root architecture and root and tuber crop productivity[J]. Trends Plant Sci, 2014, 7 : 419–425. |
| [15] | Aighewi BA, Asiedu R, Maroya N, et al. Improved propagation methods to raise the productivity of yam(Dioscorea rotundata Poir.)[J]. Food Sec, 2015(7) : 823–834. |
| [16] | Kim SK, Lee SC, Choi HJ, et al. Bulbil formation and yield responses of Chinese yam to application of gibberellic acid,mepiquat chloride and trinexapac-ethyl[J]. J Agron Crop Sci, 2003, 189 : 255–260. |
| [17] | 韦本辉. 中国淮山药栽培[M]. 北京: 中国农业出版社, 2013. |
| [18] | 温国泉, 陆宇明, 钦洁, 等. 植物生长调节剂(组合)对南方地区淮山药叶片营养及产量的影响[J]. 西南农业学报, 2010, 4 : 1177–1181. |
| [19] | 龙雯虹, 孟金贵, 张雪梅. 山药零余子对多效唑的响应部位和化感作用研究[J]. 种子, 2012, 6 : 51–53. |
| [20] | 胡碧奎, 肖能武, 王军民, 等. 鄂西北地区山药高产优质栽培技术[J]. 吉林农业, 2012, 6 : 116. |
| [21] | 吕军峰, 郭天文, 侯慧芝, 等. 山药新品种‘陇药1号’[J]. 园艺学报, 2011, 6 : 1215–1216. |
| [22] | 韦本辉, 甘秀芹, 刘斌, 等. 淮山药新品种“桂淮7号”的选育及栽培要点[J]. 南方农业学报, 2012, 6 : 764–766. |
| [23] | 谢国强, 王蓉蓉, 余国庆, 等. 山药新品种-瑞山药[J]. 中国蔬菜, 2013, 13 : 32–34. |
| [24] | 黄略略, 乔方, 叶晓梦, 等. 不同干燥方式对铁棍山药品质的影响[J]. 食品与生物技术学报, 2014, 11 : 1210–1215. |
| [25] | 周生茂, 曹家树, 等. 山药SuSy基因全长cDNA序列的结构、进化和表达[J]. 中国农业科学, 2009, 7 : 2458–246. |
| [26] | 周生茂, 王玲平, 向珣, 等. 山药PAL基因全长cDNA序列的克隆、表达与分析[J]. 核农学报, 2008, 6 : 781-788–859. |
| [27] | 周生茂, 王玲平, 等. 山药ANS基因的克隆和分子特性及其与花青素积累的关系[J]. 园艺学报, 2009, 9 : 1317–1326. |
| [28] | 闫瑞霞, 殷剑美, 韩晓勇, 等. 紫山药花青素调控基因DaF3H的克隆及表达分析[J]. 园艺学报, 2014, 4 : 701–712. |
| [29] | Lopez-Pardo R, de Galarreta JIR, Ritter E. Selection of housekeeping genes for qRT-PCR analysis in potato tubers under cold stress[J]. Mol Breeding, 2013, 23(1) : 39–45. |
| [30] | Eisenberg E, Levanon EY. Human housekeeping genes,revisited[J]. Trends Genet, 2013, 29(10) : 569–574. |
| [31] | Lopez-Pardo R, de Galarreta JIR, Ritter E. Selection of housekeeping genes for qRT-PCR analysis in potato tubers under cold stress[J]. Mol Breeding, 2013, 23(1) : 39–45. |
| [32] | Pei WK, Du F, Zhang Y, et al. Control of the actin cytoskeleton in root hair development[J]. Plant Sci, 2012, 187 : 10–18. |
| [33] | Li J, Henty-Ridilla JL, Huang S, et al. Capping protein modulates the dynamic behavior of actin filaments in response to phosphatidic acid in Arabidopsis[J]. Plant Cell, 2012, 24(9) : 3742–3754. |
| [34] | Smertenko A, Franklin-Tong VE. Organisation and regulation of the cytoskeleton in plant programmed cell death[J]. Cell Death Differ, 2011, 18 : 1263–1270. |
| [35] | Wasteneys GO. The cytoskeleton and growth polarity[J]. Plant Biol, 2003, 3 : 503–511. |
| [36] | Zhang DQ, Du QZ, Xu BH, et al. The actin multi-gene family in populus:organization,expression and phylogenetic analysis[J]. Mol Genet Genom, 2010, 284 : 105–119. |
| [37] | 孔卫青, 杨金宏. 桑树肌动蛋白actin基因全长序列的克隆与分析[J]. 广西植物, 2012, 3 : 362–366. |




