2. 甘肃省油菜工程技术研究中心,兰州 730070;
3. 中国农科院生物技术研究所,北京 100081
2. Rapeseed Engineering Technology Research Center of Gansu,Lanzhou 730070;
3. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081
启动子是基因5′端与RNA酶及一些反式作用因子结合的区域,是指RNA聚合酶识别、结合和开始转录的一段DNA序列。生物能够根据自身的需要及环境的改变,定时、定位及定量地表达所需的基因产物,在这个过程中,作为调控元件之一的启动子发挥了重要的作用[1]。通常基因的表达模式由其上游启动子所决定,在基因启动子区通常存在不同的顺式或反式作用元件,克隆基因启动子序列并对其中的转录因子结合位点进行分析是了解基因转录表达模式及其调控机制的关键。
miRNAs是一类在进化上保守的长约21 nt的非编码单链RNA,在生物体生长发育过程、抗生物或者非生物胁迫中起着非常重要的作用,在基因表达调控的网络中处于核心位置[2, 3],有效地抑制其靶基因编码的蛋白质的合成,或以其他调节机制来抑制靶基因的表达。近年来,关于克隆、分析植物miRNA启动子的报道较多,如毛果杨ptr-MIR156a[4]、草莓miR390[5]、番茄 Sly-miR167a[6],此外,Han等[7]利用生物信息学对大豆降解组文库miRNA的启动子进行了分析。前人研究结果表明Bna-miR1140基因是芸薹属特异miRNA[8],并通过降解组测序分析得到Bna-miR1140的靶基因为一种糖基转移酶(glycosyltransferase)和响应调节因子(Arabidopsis response regulator ARR8-like protein)[9],而关于Bna-miR1140功能的研究鲜见报道。miRNA自身的转录调控是miRNA 在整个调控网络中第一步,也是非常重要的一步。本文为研究Bna-miR1140的表达模式及其调控机理,依据本实验室前期的油菜miRNA芯片实验结果,利用plantCARE软件对Bna-miR1140上游1.5 kb的序列进行生物信息学分析,找到TATA-box,G-box等启动子的关键元件,然后设计引物从油菜基因组DNA中扩增出该1.5 kb片段并构建了miR1140 pro∷GUS植物表达载体,转化油菜,获得转基因株系,GUS染色分析Bna-miR1140的表达特异性,旨在为进一步揭示Bna-miR1140基因的时空表达和功能作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 油菜品种甘蓝型油菜(Brassica napus L.)栽培种westar。
1.1.2 菌株和载体根癌农杆菌LBA4404、植物表达载体pPZP212均由中国农业科学院生物技术研究所提供。克隆载体pEASY-T1 Cloning Vector(10 ng/μL)和大肠杆菌(Escherichia coli)感受态细胞Trans 1-T1购自北京全式金生物公司。
1.1.3 酶、试剂盒和主要的化学试剂Taq DNA聚合酶购自北京泽星生物公司;各种限制性内切酶购自NEB公司;Go3S 柱离心式PCR产物回收试剂盒V3.1 K141购自申能博彩生物科技公司;Trizol购自上海生物工程有限公司;IPTG、X-gal、T4 DNA连接酶购自Promege公司。普通的化学药品均为国产分析纯试剂。
1.2 方法 1.2.1 油菜Bna-miR1140基因启动子的扩增根据本实验室前期的油菜miRNA芯片实验结果,对Bna-miR1140上游1.5 kb的序列设计引物,上游引物5′端添加Hind Ⅲ 酶切位点,下游引物5′端添加XbaⅠ酶切位点;引物序列编号为Bna-miR1140ProFw、Bna-miR1140ProRv;测序引物NOS70按照植物表达载体pPZP212中NOS终止子序列设计;鉴定引物Bna-miR1140ProFw1和gusRv按照miR1140 pro∷GUS构建上的miR1140 pro序列和GUS基因序列设计。引物由上海生物工程有限公司合成,序列详见表 1 。以CTAB法从油菜幼苗中提取的DNA为模板,PCR扩增1 351 bp的Bna-miR1140基因启动子片段。PCR反应体系:Taq(2 U/mL)0.5 mL,10×Taq reaction buffer 2.0 mL,dNTP mix(10 mmol/L each)0.5 mL,Bna-miR1140ProFw(10 mmol/L)0.5 mL,Bna-miR1140Pro Rv(10 mmol/L)0.5 mL,油菜DNA 1.0 mL,dH2O 15 mL。PCR反应条件:94℃预变性4 min;94℃变性40 s,53℃退火40 s,72℃延伸40 s,共35个循环;72℃延伸10 min。
依据载体pEASY-T1 Cloning Vector使用说明进行T连接反应,反应结束后转化大肠杆菌Trans1-T1。通过蓝白斑筛选得到的单克隆经PCR和双酶切鉴定后送北京中科希林生物公司用引物M13﹢和M13-进行双向测序验证。利用plantCARE在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子序列的顺式作用元件进行在线分析,找到TATA-box,G-box等启动子的关键元件。用限制性内切酶Hind Ⅲ和Xba I对pPZP212质粒和测序正确的Bna-miR1140Pro-pEASY-T1质粒进行双酶切,凝胶电泳切胶回收1 351 bp和11 124 bp的DNA片段,胶回收后的Bna-miR1140Pro片段和pPZP212载体片段用T4 DNA连接酶连接,然后转化大肠杆菌感受态Trans1-T1,再PCR和酶切鉴定阳性重组子Bna-miR1140Pro-Ppzp212,对鉴定正确的阳性重组子摇菌后送北京中科希林生物公司用引物Bna-miR1140ProFw和NOS70进行双向测序验证。测序验证正确的阳性重组子Bna-miR1140Pro-Ppzp212(以下简写为miR1140 pro∷GUS)电击转化农杆菌LBA4404。
1.2.3 油菜的转化及阳性植株鉴定按照Prem L Bhalla和Mohan B Singh的方法[10](略有改变),通过农杆菌介导浸染油菜子叶柄法转化油菜。经Kanamycin不同梯度培养筛选到的生根壮苗炼苗移栽后,用CTAB法提取其DNA,以miRProFw1/gusRv和miRProFw/gusRv两对鉴定引物分别进行PCR扩增,1.5%琼脂糖凝胶电泳检测,扩增出1 905 bp和622 bp条带的为阳性株,PCR阳性对照模板为质粒miR1140 pro∷GUS;阴性对照为未经转化的油菜基因组DNA。
1.2.4 转miR1140pro∷GUS油菜T1代阳性株组织化学染色收集经PCR鉴定为阳性的转miR1140 pro∷GUS油菜T1代植株各组织器官,分别放入 1.5 mL EP管中,加适量配制好的GUS染色缓冲液(浸没材料为宜),于37℃温育8-10 h,检查X-gluc的着色情况,并用75%-95%梯度浓度的乙醇由先低浓度再高浓度的顺序室温脱色,直至叶片呈透明无色,最后用无菌水清洗2次,在体式显微镜下观察着色情况。
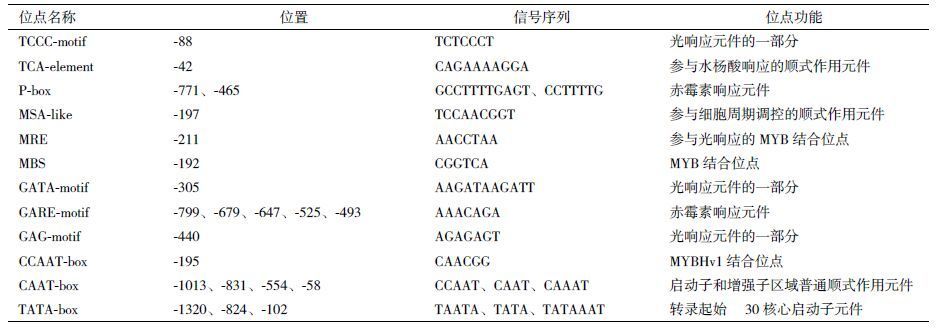
2 结果 2.1 油菜Bna-miR1140启动子片段的扩增以提取和纯化的油菜DNA作为模板,Bna-miR1140ProFw为正向引物,Bna-miR1140ProRv为反向引物进行PCR扩增Bna-miR1140启动子序列,片段长1 351 bp左右( 图 1-A )。PCR产物与pEASY-T1 Cloning Vector连接后,利用引物Bna-miR1140ProFw/Bna-miR1140ProRv、酶Xba I/Hind Ⅲ分别对质粒Bna-miR1140Pro-pEASY-T1进行PCR和双酶切鉴定,结果( 图 1-B、1-C )显示质粒PCR条带和酶切条带大小均与理论大小一致,说明Bna-miR1140启动子序列PCR产物成功连接到克隆载体。引物M13﹢和M13-对Bna-miR1140Pro-pEASY-T1双向测序,用软件Vector NT I9.0将序列拼接,序列长1 351 bp。利用plantCARE在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子序列的顺式作用元件进行在线分析,结果( 表 2 )显示,该启动子含有与转录必需的RNA聚合酶结合的TATA盒(TATA-box),以及在调控基因转录效率中发挥重要作用的CAAT盒(CAAT-box)。另外序列中包含了其他2种顺式作用元件:参与水杨酸应答的TCA元件(TCA-element)和参与细胞周期调控的元件(MSA-like),还含有一些光响应和赤霉素响应的元件。
|
| 图 1 油菜Bna-miR1140启动子的克隆及酶切鉴定 A:Bna-miR1140ProFw/Bna-miR1140ProRv扩增油菜基因组DNA;B:Bna-miR1140ProFw/Bna-miR1140ProRv扩增Bna-miR1140Pro-pEASY - T1质粒DNA;C:Xba I/Hind III双酶切Bna-miR1140Pro-pEASY-T1产生的片段。1:以油菜基因组DNA为模板;2:以Bna-miR1140Pro-pEASY - T1质粒DNA为模板;M:DNA Marker;N:以H2O为模板 |
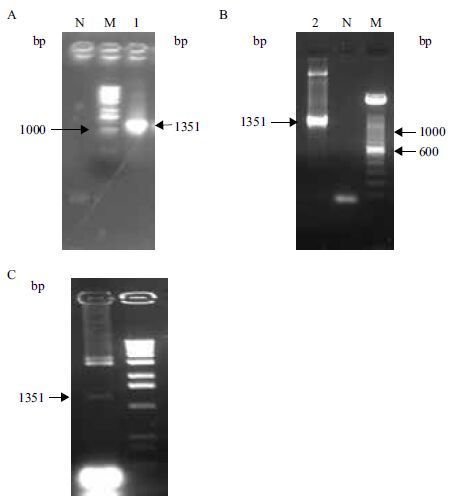
用Hind Ⅲ/Xba I分别双酶切植物表达载体质粒pPZP212和测序验证正确的克隆质粒miR1140Pro-pEASY-T1,切胶回收目的片段( 图 2-A和2-B ),并连接。先用引物Bna-miR1140ProFw和Bna-miR1140ProRv 进行PCR扩增,再用酶EcoR I/Hind Ⅲ、Xba I/Nco I、Xho I/Nco I等3对酶分别进行双酶切,酶切结果见图 2-C 、2-D、2-E。EcoR I/Hind Ⅲ双酶切产生的片段大小为3 510 bp,Xba I/Nco I双酶切产生的片段大小2 335 bp,Xho I/Nco I双酶切产生的两个片段大小分别为1 399 bp和193 bp,3次酶切片段大小符合理论值。PCR和酶切均鉴定为阳性的重组子miR1140pro∷GUS经测序验证获得最终的植物表达载体Bna-miR1140Pro-Ppzp212。将质粒miR1140pro∷GUS转化农杆菌LBA4404感受态细胞,用鉴定表达载体构建的方法筛选到了阳性克隆。
|
| 图 2 油菜Bna-miR1140启动子植物表达载体构建及酶切鉴定 A:pPZP212酶切后胶回收片段;B:miR1140Pro-pEASY-T1酶切后胶回收的Bna-miR1140启动子片段;C:EcoR Ⅰ/Hind Ⅲ双酶切miR1140pro∷GUS片段;D:Xba Ⅰ/Nco I双酶切miR1140pro∷GUS片段;E:Xho Ⅰ/Nco I双酶切miR1140pro∷GUS片段 |
转化了植物表达载体miR1140pro∷GUS的农杆菌LBA4404(OD650nm=0.5)悬浮液共计浸染300个具有2 mm叶柄的油菜子叶,在恢复培养后,进行了愈伤组织诱导,总共诱导出愈伤295个,出愈率98%。选取无褐化、无污染的培养皿中的愈伤250个,在低浓度25 mg/L kanamycin抗性的芽诱导培养基中生长,诱导出芽67个,芽诱导率 27%。挑取生长健壮、无污染和无褐化的54个发生芽继续在低浓度25 mg/L kanamycin抗性的芽生长培养基中生长4周,然后转移至高浓度50 mg/L kanamycin抗性的筛选培养基中生长4周,筛选出绿苗数10个,白化苗21个,坏死和污染的苗23个。将所有绿苗转接到生根培养基上,一月后发生根的苗数为7株,出根率为70%。通过高浓度50 mg/L kanamycin抗性筛选后,初步确定7株呈阳性。
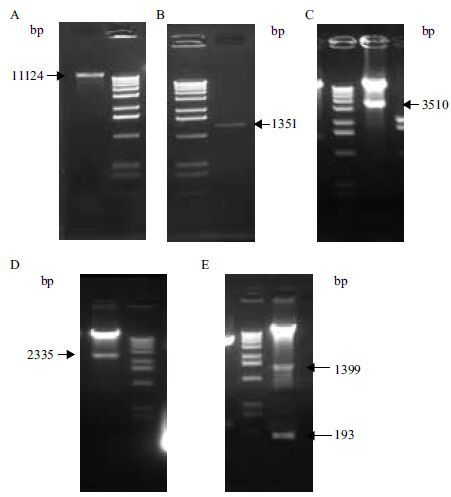
以抗性筛选为阳性的转化miR1140pro∷GUS的T0代油菜苗基因组DAN为模板,利用miRProFw1/gusRv和miRProFw/gusRv两对引物分别对这些DNA进行PCR扩增,WT作为阴性对照,大肠杆菌质粒miR1140pro∷GUS作为阳性对照。琼脂糖凝胶电泳检测后( 图 3 ),两对引物的PCR扩增鉴定阳性结果一致,并且分别扩增出的片段大小与阳性对照相同,条带大小分别为1 905 bp、622 bp。通过kanamycin抗性筛选和PCR鉴定,最后确定转Bna-miR1140启动子的油菜T0代阳性苗共5株。
|
| 图 3 转化miR1140 Pro∷GUS油菜T0代阳性株PCR鉴定 A:miRProFw1/gusRv扩增目的条带;B:miRProFw/gusRv扩增目的条带;M:DNA Marker;N:阴性对照;P:阳性对照;1-7:miR1140 Pro∷GUS转化油菜T0株系 |
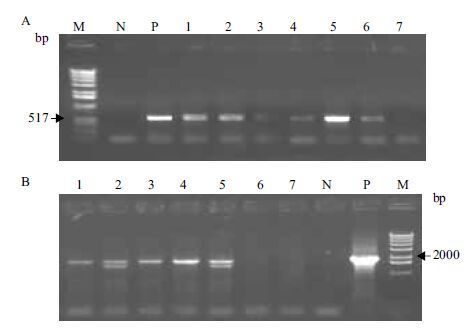
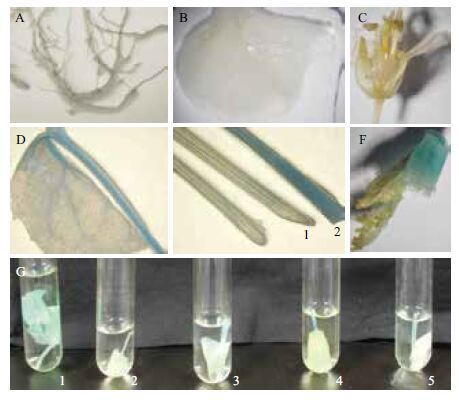
由于构建的miR1140 pro∷GUS植物表达载体中带有miR1140 pro驱动的报告基因GUS,所以可以通过对转Bna-miR1140启动子的T1代油菜的5个株系中的阳性株进行各组织GUS染色,观察GUS基因的表达,以野生型油菜和转空载体pPZP212的油菜作为对照。染色结果( 图 4 )表明,在转miR1140 pro∷GUS的T1代阳性株油菜中,GUS基因未在根、叶、花中表达,仅在油菜的叶柄和芽分生组织中表达,由此说明Bna-miR1140的表达模式为特异性表达。
|
| 图 4 转miR1140 pro∷GUS油菜T1代阳性株组织化学染色 A-F:分别为根、叶、花、带叶柄的叶、叶柄、芽分生组织。其中,E中的1是WT,2是miR1140 pro∷GUS油菜叶柄;G中1和2分别为pPZP212和WT;3-5是miR1140 pro∷GUS |
通常功能基因的表达模式由其上游启动子所决定,在基因启动子区一般存在不同的顺式或反式作用元件。在植物体内,不同的转录因子与这些元件结合从而调控基因表达量的升高或降低。microRNA作为近年来发现的一类新的调控型小分子RNA备受人们关注,并且在生物体生长发育过程中起着重要的作用。目前,人们将microRNA的研究着力于其加工成熟过程以及其生物学功能上,并取得重要的成果,关于miRNA的转录和启动子功能的研究报道也较多。RNA聚合酶II和Ⅲ均可以参与miRNA的转录[11, 12],作为聚合酶II基因的一个重要特征,启动子有着非常重要的作用。Lee等[13]首次通过实验发现人体来源的miR23a是由RNA聚合酶II转录而来,他们发现其前体转录物具有RNA聚合酶II转录产物的特征,即5′端具有帽子结构,而3′端具有PolyA结构。Kasschaukd等[14]也研究发现许多pri-miRNA含有5′帽子和3′ poly(A)尾巴结构,而这是由RNA聚合酶II转录的mRNA的典型特征,之后Xie等[15]发现在其研究的miRNA的前体上游序列中普遍存在着TATA-box,这预示着这些序列可能具有启动子活性。
miRNA特异的表达模式可能取决于其上游启动子的调控,而且,miRNA启动子的调控模式与功能基因启动子类似,能够指导miRNA在植物特定发育时期,特定组织中发挥重要调控作用[16]。克隆miRNA前体上游的序列,通过连接报告基因gus,转化拟南芥等植物后进行GUS组织化学分析和GUS活性的测定,可以分析启动子不同的调控模式及其miRNA的功能。Sunkar 等[17]在研究拟南芥中miR398参与植物抗氧化胁迫的分子机理时,将miR398b 基因上游2 kb的序列与gus报告基因相连并转化拟南芥。GUS染色结果显示,miR398b 基因的上游序列能够驱动gus基因在拟南芥的轮座叶,茎和花药中表达。此外,该研究小组还发现,经过Cu和Fe离子处理后,转基因植株的GUS 着色明显变浅,这与miR398b 响应氧化胁迫处理下调是完全吻合的。Robert等[18]将miR159a和miR159b 茎环结构上游序列与gus报告基因连接构建表达载体并转化拟南芥,对转基因拟南芥的染色结果表明,miR159a和miR159b的启动子驱动的gus基因具有相似的表达模式,且与其靶基因的表达模式也非常相似。miR398a已证明可以参与植物抵抗氧化胁迫过程,miR398a在拟南芥中过表达可以提高拟南芥对病原菌的抗性,由其表达模式推测它可能参与了某些物质的运输[17]。Wang等[19]研究了拟南芥中miR160 与根尖形成的相互关系,在实验中将miR160 前体上游序列与gus报告基因相连后转化拟南芥,GUS染色显示miR160能够在主根维管组织和侧根原基处有所表达,而在根尖部位表达量微弱,连同其他数据证明miR160 在根尖形成过程发挥重要的调控作用。
Bna-miR1140是芸薹属特异miRNA,关于其功能研究和表达调控均未见报道。本研究将目标启动子与GUS报告基因融合,通过转化油菜和GUS化学染色分析发现miR1140启动子为特异性启动子,GUS仅在叶柄及叶腋中表达,即表明miR1140在叶柄和叶腋中表达。植物通过在叶腋中形成新的分生组织产生分枝,分枝的形成受到植株发育阶段、环境因素和激素的严格调控[20]。miRNA参与油菜分枝生长发育的分子机理研究几乎是一片空白,目前还没有从油菜中克隆出任何控制分枝的相关基因及miRNA,这与分枝在油菜株型育种中的重要地位极其不符合。研究miRNA参与调控油菜分枝形成和发育的遗传控制机理,可以完善高等植物发育生物学的理论。同时,对于克隆鉴定调控油菜分枝发育的miRNA基因,结合分子育种手段,培育理想油菜株型,以及增加油菜产量和降低油菜生产成本极具现实意义。
4 结论本研究对miRNA基因上游1 351 bp的序列进行分离,并构建了miR1140 pro∷GUS植物表达载体,得到5株转化miR1140 pro∷GUS的油菜T0代阳性株。通过对阳性株油菜各组织的GUS化学染色分析表明,miR1140前体序列上游1.5 kb区域具有启动子的功能,能够驱动GUS在油菜中的表达。对miR1140 pro∷GUS转基因油菜根、茎、叶、叶腋(茎尖分生组织,SAM)、叶柄、花、种荚等组织、器官进行GUS染色分析,结果表明GUS仅在叶柄及叶腋中表达。
| [1] | 况守龙, 胡延章. 启动子的克隆和研究方向[J]. 重庆工学院学报, 2007, 21(1) : 136–139. |
| [2] | Wang JW, Schwab R, Czech B, et al. Dual effects of miR156-targeted SPL genes and CYP78A5/KLUH on plastochron length and organ size in Arabidopsis thaliana[J]. Plant Cell, 2008, 20 : 1231–1243. |
| [3] | Guo HS, Xie Q, Fei JF, et al. MicroRNA directs mRNA cleavage of the transcription factors NAC1 to downregulation auxin signals for Arabidopsis lateral root development[J]. Plant Cell, 2005, 17(5) : 1376–1386. |
| [4] | 陈英, 王浩然, 许庆, 等. Ptr-MIR156a启动子克隆及特征分析[J]. 南京林业大学学报:自然科学版, 2011, 35(6) : 1–5. |
| [5] | 李贺, 毛健鑫, 戚华彩, 等. 草莓 miR390 基因及其启动子的鉴定与表达分析[J]. 果树学报, 2014, 31(3) : 362–369. |
| [6] | 苗青, 李正国, 杨迎伍, 等. 番茄Sly-miR167a启动子的分离及功能分析[J]. 热带作物学报, 2011, 32(4) : 653–657. |
| [7] | Han YQ, Zheng HU, Zheng DF, et al. Analysis of promoters of microRNAs from a Glycine max degradome library[J]. J Zhejiang Univ Sci B(Biomedicine & Biotechnology), 2014, 15(2) : 125–132. |
| [8] | Wang L, Wang MB, Tu JX, et al. Cloning and characterization of microRNAs from Brassica napus[J]. FEBS Lett, 2007, 581(20) : 3848–3856. |
| [9] | Xu MY, Dong Y, Zhang QX, et al. Identification of miRNAs and their targets from Brassica napus by high-throughput sequencing and degradome analysis[J]. BMC Genomics, 2012, 13 : 421–436. |
| [10] | Palatnik JF, Allen E, Wu X, et al. Control of leaf morphogenesis by microRNAs[J]. Nature, 2003, 425 : 257–263. |
| [11] | Zeng Y, Wagner EJ, Cullen BR. Both natural and designed microRNAs can inhibit the expression of cognate mRNAs when expressed in human cells[J]. Mol Cell, 2002, 9 : 1327–1333. |
| [12] | Chen CZ, Li L, Lodish HF. MicroRNAs modulate hemmopoietic lineage differentiation[J]. Science, 2004(5654) : 83–86. |
| [13] | Lee Y, Kim M, Han J, et al. MicroRNA genes are transcribed by RNA polymerase II[J]. EMBO J, 2004, 23(20) : 4051–4060. |
| [14] | Kasschau KD, Xie Z, Allen E, et al. P1/HC-Pro,a viral suppressor of RNA silencing,interferes with Arabidopsis development and miRNA unction[J]. Dev Cell, 2003, 4(2) : 205–217. |
| [15] | Xie Z, Allen E, Fahlgren N, et al. Expression of Arabidopsis MicroRNA genes[J]. Plant Physiol, 2005(138) : 2145–2154. |
| [16] | 田鑫. 拟南芥胁迫诱导microRNA的分离和功能研究及microRNA启动子分析[D]. 泰安:山东农业大学,2009. |
| [17] | Sunkar R, Kapoor A, Zhu JK. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J]. Plant Cell, 2006(18) : 2051–2065. |
| [18] | Allen RS, Li JY, Stahle MI, et al. Genetic analysis reveals functional redundancy and the major target genes of the Arabidopsis miR159 family[J]. Proc Natl Acad Sci, 2007(104) : 16371–16376. |
| [19] | Wang JW, Wang LJ, Mao YB, et al. Control of root cap formation by MicroRNA targeted auxin response factors in Arabidopsis[J]. Plant Cell, 2005, 17 : 2204–2216. |
| [20] | Ongaro V, Bainbridge K, Williamson L, et al. Interactions between axillary branches of Arabidopsis[J]. Mol Plant, 2008, 1 : 388–400. |