2. 大连民族大学生命科学学院 大连民族大学生物技术与资源利用国家民委-教育部重点实验室,大连 116605
2. Key Laboratory of Biotechnology and Resource Utilization,State Ethnic Affairs Commission and Ministry of Education,Department of Life Science,Dalian Nationalities University,Dalian 116605
金黄色葡萄球菌是人类的一种重要病原菌,能引发许多严重感染。约有30%的正常人群长期携带金黄色葡萄球菌,通常存在于鼻腔内或者皮肤上,当非致病性的金黄色葡萄球菌侵染受伤的皮肤或黏膜时,也可能引起伤口的化脓感染,甚至诱发更严重的内脏器官感染,导致肺炎,心内膜炎及脓毒血症等疾病[1-3]。
目前,医院主要通过使用抗生素来治疗由金黄色葡萄球菌引起的感染,如青霉素、甲氧西林、万古霉素、庆大霉素、左氧氟沙星及克林霉素等,但金黄色葡萄球菌对环境的适应力极强,在短短的几十年内先后出现了耐青霉素菌株,耐甲氧西林菌株及耐万古霉素菌株等[4-9]。近期有文献[10]报道甲氧西林敏感金黄色葡萄球菌(MSSA)对青霉素的耐药率已达80%以上,对红霉素和克林霉素的耐药率约为50%。耐药性金黄色葡萄球菌引起的疾病感染是一个全球性的问题,其致病率在许多国家均出现上涨趋势[11],在我国,耐药性金黄色葡萄球菌引起的疾病治病率及死亡率均呈上升趋势[12-14],因此开发新的抗菌药物和抗菌靶点迫在眉睫。
金黄色葡萄球菌的致病机制与其能分泌多种细胞外毒素及胞外酶密切相关,而这些毒力因子的协同表达受多个基因组成的复杂网络调控,过程十分复杂。研究表明,agr、srr、arl、sae、lyt和wal等多个双组分信号转导系统(two component signal transduction system,TCSTS)均参与了这些毒力因子的调控过程,其中附属基因调节系统是最主要的调控系统,agr系统调控金黄色葡萄球菌多种毒力因子的表达,它是一个全局调控因子,受群体感应机制调节[15-18]。agr系统由组氨酸蛋白激酶AgrC和反应调节蛋白AgrA组成[19, 20],AgrC是有7个跨膜片段的膜蛋白,含有胞外感受域,负责识别胞外信号从而开启信号转导通路,AgrA通过改变相关基因的表达引发相应的生物学反应[20-23]。
信号转导通路的基础是磷酰基的转移[24],由于金黄色葡萄球菌组氨酸蛋白激酶AgrC可以捕捉胞外信号,并且能够发生磷酸化启动信号转导过程,因此AgrC的胞内域和跨膜域均被认为是极具潜力的药物靶点。其中通过设计和筛选阻断AgrC和AgrA之间的信号通路的抑制剂成为研究热点。
为了建立药物筛选模型必需大量获得AgrC蛋白。但是全长的AgrC表达量低且缺乏稳定性,而AgrCCTM6-7C(残基数134-430)表达量相对较高,同时AgrCCTM6-7C包含两个跨膜域,一个胞外环和一个细胞质域,含有磷酸化的位点并且保持着本身的激酶活性,即AgrCCTM6-7C蛋白可以磷酸化AgrA开启信号转导通路,对蛋白胞内域的功能研究没有影响,因此选用AgrCCTM6-7C蛋白代替全长的AgrC蛋白进行相关实验。本实验详细研究AgrCCTM6-7C蛋白分离纯化方法,优化金属离子螯合层析中缓冲液的咪唑浓度,离子交换层析中缓冲液的pH值,研究β-巯基乙醇对AgrCCTM6-7C蛋白聚集度及激酶活性的影响,旨在不影响AgrCCTM6-7C蛋白激酶活性的前提下,提高AgrCCTM6-7C蛋白的纯度和得率。
1 材料与方法 1.1 材料 1.1.1 菌株含pET-28a-AgrCCTM6-7C重组质粒的大肠杆菌(Escherichia coli)C43(DE3)由本实验室前期构建并保存。
1.1.2 培养基及缓冲液32Y培养基:3.2%(W/V)酵母浸粉,0.8%(W/V)蛋白胨,0.58%(W/V)NaCl,10 mmol/L Tris-HCl,pH7.4。实验中主要缓冲液配方如下:PBS缓冲液:137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH7.4,0.22 μm滤膜过滤;Washing buffer:10%甘油,20 mmol/L咪唑,5×CMC表面活性剂,加入PBS定容至1 L,调节pH 至7.0,0.22 μm滤膜过滤;Elution buffer:10%甘油,500 mmol/L咪唑,5×CMC表面活性剂,加入PBS定容至1 L,调节pH 至7.0,0.22 μm滤膜过滤;Buffer A:20 mmol/L Tris-HCl,1×CMC表面活性剂,定容至1 L,调节pH 至8.0,0.22 μm滤膜过滤;Buffer B:20 mmol/L Tris-HCl,1 mol/L NaCl,1×CMC表面活性剂,调节pH 至8.0,0.22 μm滤膜过滤;Brij-35 buffer:10%甘油,10 mmol/L HEPES,80 mmol/L NaCl,3×CMC Brij-35(W/V),用1×PBS 溶解定容,0.22 μm滤膜过滤,超声除气泡备用;5×Protein loading buffer:250 mmol/L Tris-HCl,pH6.8,10%(W/V)SDS,0.5%(W/V)BPB,甘油(体积分数50%),5%(V/V)β-巯基乙醇。
1.1.3 试剂及材料十二烷基二甲基氧化胺(LDAO)购自Affymetrix公司;十二烷基聚乙二醇醚(Brij-35)购自Amresco公司;4-羟乙基哌嗪乙磺酸(HEPES)购自Sigma公司;咪唑(超纯)购自Sigma公司;异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl β-D-1-Thiogalactopyranoside,IPTG)购自上海生工。
1.2 方法 1.2.1 AgrCCTM6-7C粗提液的制备AgrCCTM6-7C粗提液的制备过程如下:将含有pET-28a-AgrCCTM6-7C重组质粒的大肠杆菌C43(DE3)以2%的接种量接种于32Y培养基中,220 r/min,30℃培养30 min,当OD600在0.25-0.35时,添加终浓度为0.1 mmol/L的IPTG(Isopropyl β-D-1-Thiogalactopyranoside),220 r/min,20℃诱导24 h,6 300×g离心10 min收集培养后的菌体。用PBS缓冲液对菌体进行重悬,使湿菌体密度达到100 mg/mL,添加终浓度为1 mmol/L MgCl2、20 mmol/L咪唑,冰上孵育2 h,在800 bar压力下,用高压细胞破碎仪(JN-3000,广州聚能生物科技有限公司)破碎菌体,4℃,24 000×g下离心30 min,收集上清,去掉沉淀中未破碎的细胞和细胞碎片。将得到的上清液在4℃,300 000×g下超高速离心45 min,沉淀中加入PBS缓冲液使细胞膜完全悬浮并向细胞膜悬浮液中加入10× CMC LDAO(lauryldimethylamine oxide)进行过夜溶解,300 000×g下超高速离心35 min得到粗提液,以备后续实验使用。
1.2.2 金属离子螯合层析方法的优化将5 mL已处理好的填料(Ni SepharoseTM High Performance,GE HealthcareTM)灌入低压层析柱(Bio-Rad,型号2.5×10 cm)中,先用Washing buffer平衡10 min,然后加入10 mL粗提液,在摇床上轻柔摇5 min,使目的蛋白与填料充分结合,然后用4倍柱体积(200 mL)的Washing buffer对杂蛋白共进行4次洗脱,最终用Elution buffer将目的蛋白洗脱下来,收集用Washing buffer第4次洗脱的液体以及用Elution buffer洗脱下来的目的蛋白,进行SDS-PAGE检测。对Elution buffer和Washing buffer中咪唑浓度进行了优化,Washing buffer中咪唑浓度分别为10、20、30、50和100 mmol/L,Elution buffer中咪唑浓度分别为200、300、400、500和600 mmol/L,通过电泳检测结果确定Elution buffer和Washing buffer中最适的咪唑浓度。
1.2.3 离子交换层析缓冲液pH值的优化用离子交换层析对由金属离子螯合层析得到的AgrCCTM6-7C蛋白溶液进行进一步分离纯化。先用50 mL Buffer B清洗阴离子交换柱(Hi Trap Q,5 mL),继而用200 mL Buffer A平衡柱子后将AgrCCTM6-7C蛋白溶液灌入离子交换柱,用Buffer B、Buffer A的混合液对目的蛋白进行梯度洗脱,缓冲液中Buffer B的含量由0至100%递增;在280 nm波长下监测蛋白含量并收集目标样品。由于pH值是决定实验效果的重要因素,因此对缓冲液的pH值进行了优化,分别考察了缓冲液pH值为6.0、7.0、8.0和9.0时的纯化效果。
1.2.4 β-巯基乙醇对蛋白聚集度的影响为考虑巯基化合物对AgrCCTM6-7C蛋白聚集的影响,用激光粒度分析仪(horiba scientific nano particle analyzer SZ-100,HORIBA)对蛋白样品的粒径进行测量。在5 mL离心管中加入200 ng目的蛋白,以及终浓度分别为0、0.5、1.0、1.5、2.0和2.5 mmol/L的β-巯基乙醇,用Brij-35 buffer将反应体系补足至3 mL,混匀后于37℃孵育30 min后测量蛋白粒径大小。
1.2.5 β-巯基乙醇对AgrCCTM6-7C蛋白激酶活性的影响AgrCCTM6-7C蛋白的激酶活性是通过检测反应体系中剩余的ATP含量来间接测定的。底物在磷酸激酶的作用下与ATP发生反应,反应结束后,在反应体系中加入甲壳荧光素,使其反应体系中剩余的ATP作用,形成氧化荧光素,进而发出荧光。实验中AgrCCTM6-7C蛋白激酶活性的测定采用Kinase-Glo Luminescent Kinase Assay方法,具体实验步骤参见试剂盒说明。实验在96孔板中进行,反应体系为50 μL,含有终浓度为10 mmol/L的MgCl2和5 μmol/L的ATP,0-0.20 μg的目的蛋白,反应缓冲液为Brij-35 buffer,将整个体系在37℃孵育10 min后加入50 μL发光试剂,37℃反应10 min后用多功能酶标仪检测体系的发光强度。为验证β-巯基乙醇对AgrCCTM6-7C蛋白激酶活性的影响,在50 μL反应体系中添加终浓度为10 mmol/L的MgCl2和5 μmol/L的ATP,200 ng的目的蛋白以及不同浓度梯度的β-巯基乙醇,测定方法同上。
2 结果 2.1 金属离子螯合层析缓冲液中咪唑浓度的优化实验考察了不同咪唑浓度对杂蛋白洗脱效果的影响。收集各咪唑浓度Washing buffer洗脱过程中,最后一次洗脱液检测洗脱效果,根据电泳检测结果确定Washing buffer中的最适咪唑浓度。纯化后检测结果( 图 1-A )显示,当Washing buffer中咪唑浓度为10 mmol/L和20 mmol/L时,用4倍柱体积的Washing buffer对杂蛋白进行洗脱后,经检测洗脱液中杂蛋白的含量仍旧相对较高,而Washing buffer中咪唑浓度分别为50 mmol/L和100 mmol/L时,经检测洗脱液中都不同程度的含有目的蛋白。由于膜蛋白本身表达量就不高,而提纯过程中的损失将使目的蛋白的得率进一步下降,这不利于后续的精制,综合考虑确定Washing buffer中的最适咪唑浓度为30 mmol/L。对Elution buffer中咪唑浓度进行优化,如图 1-B 所示,图中泳道2、3、4分别代表Elution buffer中的咪唑浓度为400、500和600 mmol/L,此时Elution buffer将目的蛋白洗脱下来的同时也将洗脱下来大量的杂蛋白,严重影响目的蛋白的纯度。Elution buffer中的咪唑浓度为200 mmol/L时(泳道1),因咪唑浓度较低,不能将目的蛋白完全洗脱下来。Elution buffer中的咪唑浓度为300 mmol/L(泳道 5)时,可以将大多数目的蛋白洗脱下来,但并未发现有明显的杂蛋白被洗脱下来。因此综合以上因素选定Elution buffer中最适咪唑浓度为300 mmol/L。

|
| 图 1 Washing buffer(A)和Elution buffer(B)缓冲液咪唑浓度对蛋白分离效果的影响 (A)1-5:用200 mL咪唑浓度分别为10、20、30、40、50 mmol/L的Wash-ing buffer对样品中杂蛋白进行洗脱;M:Protein marker。(B)1-5:咪唑浓度分别为200、400、500、600和300 mmol/L的Elution buffer对目的蛋白进行洗脱;M:Protein marker |
对金属离子螯合层析缓冲液优化前后的分离效果( 图 2 )显示,优化后的溶液中杂蛋白的含量明显降低,蛋白的纯度得到了一定程度的提高,但该纯度还不能满足后续实验要求,因此还需对目的蛋白进行进一步的分离纯化。
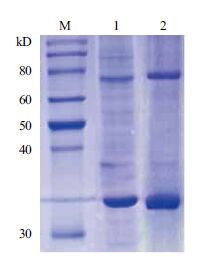
|
| 图 2 咪唑浓度优化前后的AgrCTM6-7C蛋白分离效果图 1:缓冲液中咪唑浓度优化之前AgrCTM6-7C 的纯化结果;2:优化缓冲液中咪唑浓度后AgrCTM6-7C 的纯化结果;M:蛋白marker |
分别利用pH值为6.0、7.0、8.0和9.0的缓冲液对蛋白进行分离纯化,不同pH值的缓冲液纯化结果如图 3-A 所示。对出峰部分的样品进行SDS-PAGE检测,并浓缩收集,通过蛋白的纯度和得率等因素的综合考虑,发现当缓冲液中pH值为8.0时,蛋白的得率最高,纯度也相对较好,因此选定缓冲液的最适pH值为8.0。离子交换层析缓冲液pH值为8.0时根据峰谱图,取吸收值较高的样品1、2进行电泳检测,结果如图 3-B 所示,纯化后的蛋白条带单一杂蛋白较少,但分子量为70 kD的位置始终出现明显的条带,分析可能是目的蛋白AgrCCTM6-7C的二聚体,而蛋白二聚体的存在对其结晶等后续实验的影响较大。β-巯基乙醇是一种常见的还原剂,用于保护蛋白质中自由的半胱氨酸巯基之间不会形成错误的二硫键,推测β-巯基乙醇可能会抑制蛋白二聚体的形成,因此在纯化过程中添加β-巯基乙醇以试图解决该问题。
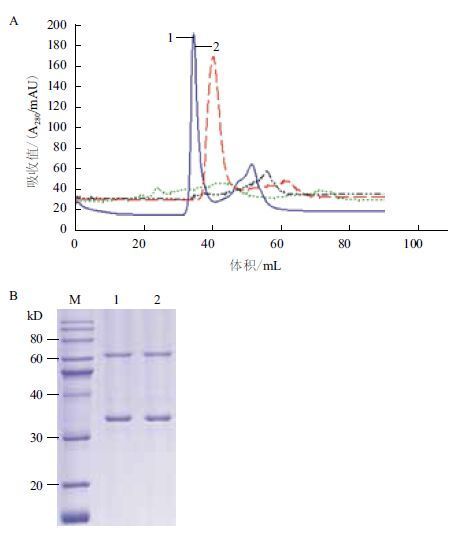
|
| 图 3 AgrCTM6-7C蛋白的离子交换层析图(A)及纯化SDS-PAGE电泳图(B) A:利用不同pH值的缓冲液对AgrCTM6-7C蛋进行的离子交换层析的结果图。黑色:pH 6.0,红色:pH 7.0,蓝色:pH 8.0,绿色:pH 9.0。B:经离子交换层析纯化后AgrCTM6-7C 蛋白的电泳检测结果图 |
在蛋白溶液中添加不同浓度的β-巯基乙醇,孵育后对目的蛋白的粒径大小进行测量,结果( 图 4 )显示,随着β-巯基乙醇浓度的增加,目的蛋白的粒径逐渐降低,当β-巯基乙醇的浓度大于1.5 mmol/L后蛋白粒径大小趋于平稳无明显变化。在纯化 AgrCCTM6-7C蛋白的过程中一组添加终浓度为1.5 mmol/L的β-巯基乙醇,另一组对照实验不添加β-巯基乙醇,经金属离子螯合层析和离子交换层析分离纯化,用SDS-PAGE对纯化后的蛋白进行检测,结果如图 5 所示。图中可见,泳道2中目的条带单一,杂蛋白含量极低,纯化效果很好,而泳道1中在二倍分子量的位置仍有明显的条带,由此可证明β-巯基乙醇可抑制二聚体的形成,在纯化过程中添加适量的β-巯基乙醇可以防止二聚体的形成,纯度得到了很大提高,可达98%以上,产量可达到15 mg/L。
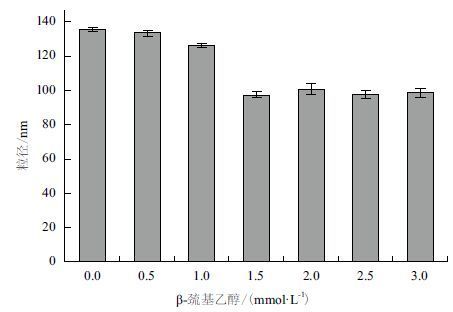
|
| 图 4 β-巯基乙醇对AgrCTM6-7C蛋白粒径大小的影响 |
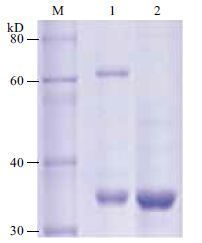
|
| 图 5 β-巯基乙醇对AgrCTM6-7C蛋白纯化效果的影响 1:分离过程未添加β-巯基乙醇AgrCTM6-7C蛋白的纯化结果;2:分离过程中添加β-巯基乙醇AgrCTM6-7C蛋白的纯化结果;M:Protein marker |
为了检测目的蛋白是否具有激酶活性,在反应体系中分别添加了0、0.05、0.10、0.15和0.20 μg的目的蛋白,并进行激酶活性的检测。检测结果( 图 6 )显示,随着蛋白含量的增多,荧光值呈下降的趋势,这表明反应体系中剩余的ATP含量逐渐降低,即随着蛋白含量的增加蛋白的激酶活性逐渐增大,因此可以证明目的蛋白具有激酶活性。为考察β-巯基乙醇对AgrCCTM6-7C激酶活性的影响,向反应体系中分别添加200 ng AgrCCTM6-7C蛋白,以及终浓度分别为0.5、1.0、1.5、2.0和2.5 mmol/L的β-巯基乙醇,反应完全后检测激酶活性。结果显示,随着β-巯基乙醇浓度的增加,蛋白的激酶活性呈微弱的先增加后降低的趋势,当浓度为1.5 mmol/L时,蛋白的激酶活性最高,但数据整体浮动较小,故β-巯基乙醇对蛋白激酶活性的影响并不显著。综上可知,在分离纯化的过程中添加终浓度为1.5 mmol/L的β-巯基乙醇对蛋白的激酶活性无明显影响,但是却可以明显抑制二聚体的形成。

|
| 图 6 AgrCTM6-7C蛋白激酶活性的测定结果 |
金黄色葡萄球菌其耐药性菌株的出现也为抗生素用药带来了较大困难,进而导致病死率的升高。为了降低耐药性菌株的增长率以及延长抗生素的使用寿命,在合理使用抗生素的同时,急需研发新的抗菌药物及药物靶点[12-14]。金黄色葡萄球菌agr系统与其致病性、耐药性和细胞的基本生理功能等密切相关,若能探明agr系统的信号转导机理,将对金黄色葡萄球菌的耐药性研究产生重大影响。而金黄色葡萄球菌组氨酸蛋白激酶AgrC作为agr系统的重要组成部分,在该双组分信号转导系统中发挥着重要的作用。目前组氨酸激酶AgrC正成为药物靶点研究的热点,但是进展相对缓慢,原因是AgrC稳定性太低,使AgrC蛋白的分离纯化相对困难,从而导致其三维结构至今仍未能确定,对组氨酸激酶AgrC结构功能研究带来了较大难度。本实验以AgrCCTM6-7C作为模式蛋白,对AgrCCTM6-7C蛋白的分离纯化过程进行了多方面的优化,为后续实验研究奠定了基础。
目的蛋白AgrCCTM6-7C在C末端带有组氨酸标签,可与过渡金属离子Ni2++形成配位相互作用,进而实现蛋白的分离纯化。本实验选用Ni-NTA作为介质纯化蛋白。金属离子螯合层析是蛋白纯化过程中较为常用的方法,有研究表明咪唑的浓度对蛋白纯化效果影响很大,洗脱杂蛋白时咪唑浓度过低会导致纯化后杂蛋白含量过高,蛋白纯度降低,收集目的蛋白时,咪唑浓度过低会导致目的蛋白不能完全被收集,而咪唑浓度过高又容易带入过多的杂蛋白[25, 26],因此有必要对Washing buffer和Elution buffer中咪唑的浓度进行优化,以提高目的蛋白的纯度及得率。通过对实验结果的综合分析,最终选定Washing buffer中咪唑的最适浓度为30 mmol/L,Elution buffer中最适咪唑浓度为300 mmol/L。金属离子螯合层析的缓冲液经优化后,目的蛋白AgrCCTM6-7C的纯化效果有了明显提高,杂蛋白大大减少,但仍有部分杂蛋白未被分离出去,因此利用离子交换层析技术对目的蛋白进行进一步的分离纯化。
离子交换层析是一种用不同离子浓度梯度的盐溶液对目的蛋白进行洗脱的分离技术。根据 AgrCCTM6-7C氨基酸序列,通过ExPASy Param tool软件在线分析表明,AgrCCTM6-7C的等电点pI约为5.0,理论上当缓冲液的pH值大于蛋白等电点时,蛋白带负电,可与阴离子交换柱中的填料结合,从而与杂蛋白分离开来,实现目的蛋白的分离纯化。缓冲液中盐离子浓度和pH值是影响纯化效果的主要因素,由于过高的盐离子浓度不利于后续实验,因此盐离子浓度最终选定可以将目的蛋白置换出来的最低浓度。通过对纯化效果的分析,优化后选定缓冲液的最适pH值为8.0。
AgrCCTM6-7C蛋白经过金属离子螯合层析和离子交换层析后得到的目的蛋白中杂蛋白含量很低,但在二倍分子量的位置始终有一条明显的杂带,且含量相对较多,根据分子量大小分析可能为AgrCCTM6-7C 蛋白的二聚体。疏水作用的存在及二硫键的形成是导致蛋白形成二聚体的主要原因,破坏疏水作用常用的方法是使用尿素等强变性剂,但尿素引起的蛋白质变性有时很难完全复性。有文献[27-29]报道,在现代生物技术里,在下游产品的分离、纯化过程中β-巯基乙醇的应用均十分广泛。断裂二硫键常用的方法主要是过甲酸氧化法和巯基化合物还原法,目前普遍使用的方法是用β-巯基乙醇处理蛋白样品,以抑制二硫键的形成,防止蛋白形成多聚体。为避免目的蛋白形成二聚体,在实验过程中的缓冲液中添加了一定量的β-巯基乙醇。结果表明当β-巯基乙醇浓度达到1.5 mmol/L时,目的蛋白的粒径最小,因此在纯化蛋白的过程中添加终浓度为1.5 mmol/L的β-巯基乙醇,经电泳结果分析可有效抑制目的蛋白二聚体的形成。激酶活性测定结果证明,1.5 mmol/L的β-巯基乙醇并不影响AgrCCTM6-7C蛋白的激酶活性。
4 结论本研究优化了AgrCCTM6-7C蛋白的分离纯化方法,最终在不影响AgrCCTM6-7C蛋白激酶活性的前提下,显著提高AgrCCTM6-7C蛋白的纯度和得率,纯度可达98%以上,产量可达15 mg/L。
| [1] | 王军华, 权春善, 郑维, 等. 金黄色葡萄球菌附属基因调节系统[J]. 中国生物工程杂志, 2008, 28(6) : 93–99. |
| [2] | 唐俊妮, 史贤明, 曾志光, 等. 金黄色葡萄球菌毒力调控系统TCRSs和SarA[J]. 上海交通大学学报:农业科学版, 2009, 27(2) : 171–176. |
| [3] | 宋娟, 楚雍烈. 金黄色葡萄球菌基因调节系统研究进展[J]. 生命科学, 2012, 24(5) : 463–469. |
| [4] | Rasko DA, et al. Anti-virulence strategies to combat bacteria-media-ted disease[J]. Nat Rev Drug Discov, 2010, 2 : 117–128. |
| [5] | Barczak AK, Hung DT. Productive steps toward an antimicrobial targeting virulence[J]. Curr Opin Microbiol, 2009, 5 : 490–496. |
| [6] | Cegelski L, Marshall GR, et al. The biology and future prospects of antivirulence therapies[J]. Nat Rev Microbiol, 2008, 1 : 17–27. |
| [7] | Dancer SJ, Kirkpatrick P, Corcoran DS, et al. Approaching zero:Temporal effects of a restrictive antibiotic policy on hospital-acquired Clostridium difficile,extended-spectrumβ-lactamase-producing coliforms and meticillin-resistant Staphylococcus aureus[J]. Int J Antimicrob Agents, 2013, 41(2) : 137–142. |
| [8] | Hiramatsu K, Aritaka N, Hanaki H, et al. Dissemination in Japanese hospitals of strains of Staphylococcus aureus heterogeneously resistant to vancomycin[J]. Lancet, 1997, 9092 : 1670–1673. |
| [9] | Weigel LM, Clewell DB, Gill SR, et al. Genetic analysis of a high-level vancomycin-resistant isolate of Staphylococcus aureus[J]. Science, 2003, 302(5650) : 1569–1571. |
| [10] | 刘琳娟, 等. 肿瘤专科医院金黄色葡萄球菌的分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25(2) : 291–293. |
| [11] | Grundmann H, Aires-de-Sousa M, Boyce J, et al. Emergence and resurgence of meticillin resistant Staphylococcus aureus as a public-health threat[J]. Lancet, 2006, 368(9538) : 874–885. |
| [12] | 袁本清, 宋发谷, 张爱群, 等. 金黄色葡萄球菌耐药性变迁探讨[J]. 中华医院感染学杂志, 2014, 24(24) : 5989–5991. |
| [13] | 刘彩林, 孙自镛, 陈中举, 等. 2006-2011年金黄色葡萄球菌耐药性变迁分析[J]. 中国抗生素杂志, 2013, 6 : 467–472. |
| [14] | 陈叶红, 等. 金黄色葡萄球菌耐药性变迁及抗菌药物应用分析[J]. 中华医院感染学杂志, 2014, 24(2) : 342–344. |
| [15] | Novick RP, Ross H, Projan S, et al. Synthesis of staphylococcal virulence factors is controlled by a regulatory RNA molecule[J]. EMBO J, 1993, 12(10) : 3967–3975. |
| [16] | Novick RP, Projan SJ, Kornblum J, et al. The agr P2 operon:an autocatalytic sensory transduction system in Staphylococcus aureus[J]. Mol Gen Genet, 1995, 248(4) : 446–458. |
| [17] | Benito Y, Kolb FA, Romby P, et al. Probing the structure of RNAIII,the Staphylococcus aureus agr regulatory RNA,and identification of the RNA domain involved in repression of protein A expression[J]. RNA, 2000, 6(5) : 668–679. |
| [18] | Tegmark K, et al. Regulation of agr-dependent virulence genes in Staphylococcus aureus by RNAIII from coagulase-negative staphylococci[J]. J Bacteriol, 1998, 12 : 3181–3186. |
| [19] | Bhate MP, et al. Signal transduction in histidine kinases:Insights from newstructures[J]. Structure, 2015, 6 : 981–994. |
| [20] | Wang B, Zhao A, Novick RP, et al. Activation and inhibition of the receptor histidine kinase AgrC occurs through opposite helical transduction motions[J]. Mol Cell, 2014, 53(6) : 929–940. |
| [21] | Mascher T, Helmann JD, Unden G. Stimulus perception in bacterial signal-transducing histidine kinases[J]. Microbiol Mol Biol Rev, 2006, 70(4) : 910–938. |
| [22] | Gao R, Stock AM. Biological insights from structures of two-component proteins[J]. Annu Rev Microbiol, 2009, 1(63) : 133–154. |
| [23] | Srivastava SK, Rajasree K, Fasim A, et al. Influence of the AgrC-AgrA complex on the response time of Staphylococcus aureus quorum sensing[J]. J Bacteriol, 2014, 196(15) : 2876–2888. |
| [24] | Shor E, Chauhan N. A case for two-component signaling systems as antifungal drug targets[J]. PLoS Pathog, 2015, 2 : 632–647. |
| [25] | 李淑娟, 等. 金属螯合亲和层析介质用于六聚组氨酸融合蛋白的纯化研究[J]. 生物工程学报, 2007, 23(5) : 941–946. |
| [26] | QIAGEN公司. 六联组氨酸标记蛋白高水平表达纯化手册 [M]. 2003. |
| [27] | 齐明, 钟理, 李伟溢. 巯基乙醇的应用现状和发展趋势[J]. 聚氯乙烯, 2006, 2 : 1–3. |
| [28] | 张强, 刘玲娜. 2-巯基乙醇生产技术与应用[J]. 化学中间体, 2011, 11 : 43–45. |
| [29] | 田勇, 刘传玉, 王文彬, 等. 2-巯基乙醇的合成与应用进展[J]. 黑龙江科学, 2011, 2(3) : 35–47. |




