2. 昆山博青生物科技有限公司,昆山 215316
2. Kushan BioGreen Technology Co.,Ltd., Kunshan 215316
金黄色葡萄球菌是临床最常见的化脓性球菌,是医院交叉感染的主要来源[1-3]。金葡菌感染能诱发多种疾病,且容易引发大规模爆发性感染,尤其是耐甲氧西林金葡菌(MRSA)的多药耐药性和交叉耐药性给临床治疗带来极大的困难[4-11]。目前,以万古霉素为代表的糖肽类抗生素是治疗MRSA感染的首选用药。但是,近年来,由于万古霉素的应用增加,陆续发现对万古霉素中介和耐药的金葡菌(VISA和VRSA)[12-14]。因此,迫切需要开发与传统抗生素作用模式不同的新型抗菌药物。
溶葡萄球菌酶(lysostaphin,Lysn)是一种含Zn2+的金属蛋白酶,具有肽链内切酶活性[15],能特异性地水解金葡菌细胞壁肽聚糖交联结构甘氨酸五肽桥,从而产生破壁溶菌作用,具有极强的抗金葡菌活性[16-18]。体外条件下rLysn清除金葡菌的作用非常快,在≥MIC水平(约0.03-0.125 µg/mL),对受试菌通常30 min 内可杀灭90%以上,2-4 h可杀灭99.9%以上[19]。对MRSA也有同样显著的体外抗菌效果,并且优于糖肽类抗生素万古霉素[20-22]。Lysn对金葡菌具有的快速溶菌作用,使得其成为国内外研发抗耐药金葡菌感染的热点[23-25]。目前国内已经将重组溶葡萄球菌酶(recombinant lysostaphin,rLysn)研制成药用制剂,用于治疗皮肤创面金葡菌感染。
对rLysn成品中的蛋白含量测定,可以控制和评价rLysn成品的质量。由于rLysn在制剂制备过程中加入了人血白蛋白作为保护剂,常规的蛋白含量测定方法不适合成品中蛋白含量的测定。目前采用的C18柱反相高效液相色谱法测定rLysn成品蛋白质含量[26],但该法的分离效果不好,且洗脱程序复杂。本实验采用体积排阻高效液相色谱法(size exclusion-high performance liquid chromatography,SE-HPLC),测定rLysn成品中的蛋白含量,旨在高效分离rLysn和人血白蛋白,并简化实验流程,为提高rLysn成品质量标准奠定基础。
1 材料与方法 1.1 材料 1.1.1 样品和标准品rLysn理化对照品(蛋白含量为619 µg/支,批号:20120202)、rLysn成品(400 U/支,批号:20120801)、不含rLysn的空白制剂(安慰剂,批号:20120802),上海高科联合生物技术研发有限公司制备。
1.1.2 主要试剂及仪器Agilent 1260 HPLC色谱仪,美国Agilent公司;色谱柱:TSK gel 2000SWXL(7.8 mm×30 cm,5 µm),日本Tosoh公司;NaCl,Na2HPO4·12H2O,NaH2PO4,分析纯,国药集团。
1.1.3 色谱条件色谱柱:TSK gel 2000SWXL(7.8 mm×30 cm,5 µm);流动相:20 mmol/L磷酸缓冲液(pH7.0)含0.3 mol/L NaCl;流速:0.5 mL/min;柱温:25℃;检测波长:280 nm。
1.2 方法 1.2.1 溶液的制备 1.2.1.1 对照品溶液将rLysn理化对照品用超纯水溶解并稀释制成1 mg/mL和1.6 mg/mL的溶液。
1.2.1.2 供试品溶液取rLysn成品1支,用1 mL超纯水溶解。
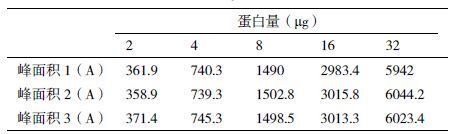
1.2.2 方法的验证 1.2.2.1 线性分析取1 mg/mL理化对照品溶液,分别进样2、4、8、16和32 µL,按此进样量各重复进样2次,以进样量(µg)为横坐标,样品峰面积(S)为纵坐标,绘制标准曲线,进行线性回归,计算相关系数(r2)。
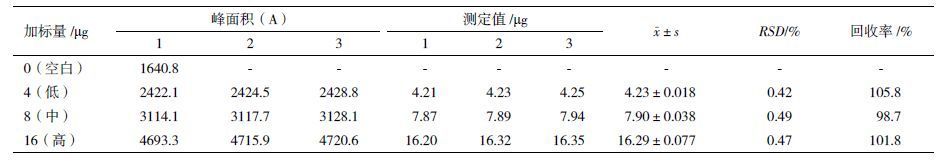
1.2.2.2 准确性验证取1.6 mg/mL理化对照品溶液将空白制剂和rLysn成品溶解并稀释至理化对照品加标终浓度分别为0、0.2、0.4和0.8 mg/mL,每一浓度上样20 µL。计算加标回收率。按照上述方法重复测定3次。
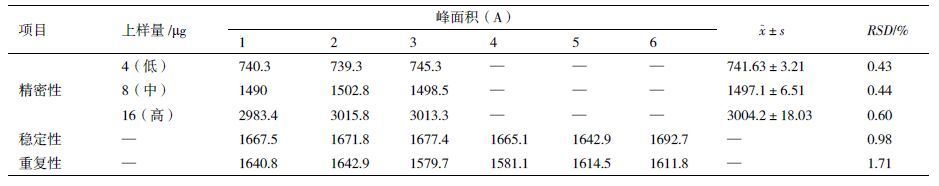
1.2.2.3 精密度验证用浓度为1 mg/mL的理化对照品溶液,采用体积法进样,分别进样4、8和16 µL,得到低、中、高3种进样量(4、8和16 µg)的峰面积。每一种进样量在不同工作日分别测定一次,计算每一种进样量的峰面积的均值、标准差和RSD。
1.2.3 稳定性取同一份供试品溶液,每次上样20 µL,每小时进样1次,共6次,计算rLysn峰面积和RSD。
1.2.4 重复性取同一批供试品溶液6份,分别进样1次,每次上样20 µL,计算rLysn峰面积和RSD。
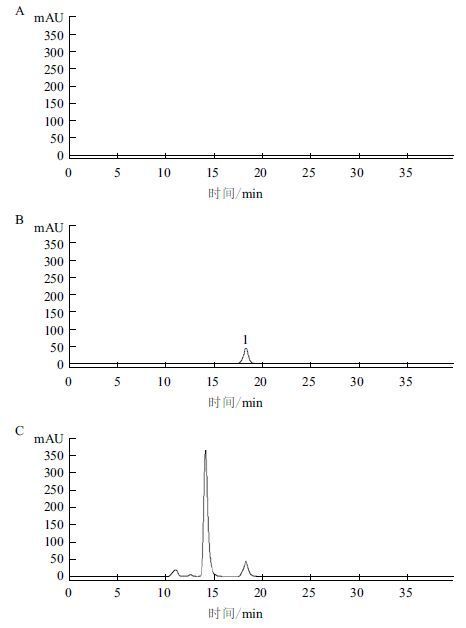
2 结果 2.1 SE-HPLC色谱分析rLysn理化对照品及rLysn成品的SE-HPLC色谱图( 图 1 )显示,rLysn和人血白蛋白的分离度大于2.5,表明本色谱方法能够满足成品中各组分达到基线分离。
|
| 图 1 SE-HPLC色谱分析图 1:rLysn峰;A:空白对照;B:rLysn理化对照品;C:rLysn成品 |
经5次进样,计算峰面积,结果见下表 1 ,得到的回归方程和相关系数分别为y=185.93x-2.0042,r2=1;y=189.46x-17.138,r2=1;y=188.49x-6.9125,r2=1。结果表明,rLysn在2-32 µg范围内与峰面积成良好的线性关系(注:后续数据均由回归方程Y=189.46x-17.138,r2=1得出)。
空白制剂加标回收率结果见表 2,3 种浓度的加标回收率在101.6%、103.8%和103.5%,平均回收率为102.9%,表明该测定方法准确性高。成品加标回收率结果见表 3,3 种浓度的加标回收率分别为105.8%、98.7%和101.8%,平均回收率为102.1%,进一步表明该测定方法准确性高。
3种不同上样量的rLysn理化对照品,分别于不同试验日进行精密度试验。数据取自3次标准曲线实验结果( 表 4 ),RSD<1%,表明该方法精密度高。
取同一份供试品溶液,每小时进样1次,共6次,结果见表 4 ,RSD为0.98%,表明样品溶解后在6 h内稳定性良好。
2.2.5 重复性取同一批供试品溶液6份,分别进样1次,共6次,结果见表 4 ,RSD为1.71%,表明该方法重复性良好。
3 讨论rLysn对金葡菌具有良好的体外抗菌活性,且对甲氧西林敏感的金葡菌(MSSA)和MRSA有同样显著的抗菌效果。rLysn药用制剂,能有效治疗金葡菌感染,且不易产生耐药性[27]。对rLysn制剂中主药蛋白即rLysn含量进行测定,能有效控制和评价制剂的质量。
由于rLysn冻干粉制剂中含有人血白蛋白,为了确定成品中rLysn的蛋白质含量,需要选用一种合适的方法,能够将rLysn与人血白蛋白有效分离,同时又能定量测定rLysn的蛋白质含量。根据两者分子量大小差异,采用体积排阻高效液相色谱法,将成品中的rLysn与其它作为保护剂的蛋白成分按照分子量大小进行分离。由于选择体积排阻高效液相法,洗脱程序变得简化,我们选择含氯化钠的磷酸缓冲液作为流动相。该方法在一定条件下,可以将rLysn和人血白蛋白有效分离,在2-32 µg上样量范围内,rLysn理化对照品上样量和峰面积之间呈现良好的线性关系,相关系数r2=1。因此,可以制备标准曲线,根据成品中rLysn的峰面积计算出成品中rLysn的蛋白质含量。
与RP-HPLC法相比,SE-HPLC法能更好的分离rLysn和人血白蛋白,该法的线性范围2-32 µg比RP-HPLC法的5-30 µg范围更宽,准确性比RP-HPLC法更好,精密度(RSD<1%)远高于RP-HPLC法(RSD在3%-6%),且稳定性良好。在rLysn成品蛋白质含量测定上,SE-HPLC比RP-HPLC更加简便、准确,更适合用于rLysn成品蛋白质含量测定。
4 结论本实验建立了一种测定rLysn成品蛋白质含量的SE-HPLC法,该方法简便、准确、重复性好。在该方法确定的测定条件下,可以将rLysn和人血白蛋白有效分离,并且以rLysn理化对照品作对照,在一定上样量范围内,可以对样品中的rLysn进行准确定量。该方法可用于rLysn成品蛋白质含量的测定,从而更好的控制和评价该制剂的质量。
| [1] | 李胜利, 张婴元, 吴菊芳, 等. 葡萄球菌医院感染的调查研究[J]. 中华医院感染学杂志, 1998, 8(2) : 65–67. |
| [2] | 李梓萌, 孙志, 李威, 等. 金黄色葡萄球菌的耐药性分析及流行病学分型[J]. 中华医院感染学杂志, 2012, 22(12) : 2485–2487. |
| [3] | 周勇, 杨乐和, 林雪峰, 等. 金黄色葡萄球菌临床分离株的耐药谱变迁[J]. 中华医院感染学杂志, 2012, 22(11) : 2409–2411. |
| [4] | Edelsberg J, Weycker D, Barron R, et al. Prevalence of antibiotic resistance in US hospitals[J]. Diagn Microbiol Infect Dis, 2014, 78(3) : 255–262. |
| [5] | Hudson LO, Murphy CR, Spratt BG, et al. Diversity of methicillin-resistant Staphylococcus aureus(MRSA)strains isolated from inpatients of 30 hospitals in Orange County,California[J]. PLoS One, 2013, 8(4) : e62117. |
| [6] | Köck R, Becker K, Cookson B, et al. Methicillin-resistant Staphylococcus aureus(MRSA):burden of disease and control challenges in Europe[J]. Eurosurveillance, 2010, 15(41) : 19688. |
| [7] | 中华医学会甲氧西林耐药金黄色葡萄球菌感染治疗策略专家组. 中华医学会感染与抗微生物治疗策略高峰论坛:甲氧西林耐药金黄色葡萄球菌感染的治疗策略—专家共识[J]. 中国感染与化疗杂志, 2011, 11(6) : 401–416. |
| [8] | 郑燕红, 蔡海明. 临床感染病原菌分布及耐药菌分析[J]. 医药导报, 2011, 30(9) : 1222–1223. |
| [9] | 赵先颖, 徐元宏, 江晓平. 医院感染葡萄球菌菌种变迁与耐药性近况[J]. 中国微生态学杂志, 2003, 15(1) : 40–46. |
| [10] | 余慧菊, 康金凤, 刘瑛. 合理应用抗菌药物能减缓细菌耐药性产生[J]. 中国科技信息, 2005(12) : 136–141. |
| [11] | Grundmann H, Aires-de-Sousa M, Boyce J, et al. Emergence and resurgence of meticillin-resistant Staphylococcus aureus as a public-health threat[J]. Lancet, 2006, 368 : 874–885. |
| [12] | Khare M, Keady D. Antimicrobial therapy of methicillin resistant Staphylococcus aureus infection[J]. Expert Opin Pharmacother, 2003, 4(2) : 165–177. |
| [13] | Howden BP, Davies JK, Johnson PDR, et al. Reduced vancomycin susceptibility in Staphylococcus aureus,including vancomycin-intermediate and heterogeneous vancomycin-intermediate strains:resistance mechanisms,laboratory detection,and clinical implications[J]. Clinical Microbiology Reviews, 2010, 23(1) : 99–139. |
| [14] | 刘亚丽, 徐英春. 异质性万古霉素中介金黄色葡萄球菌:困扰我们的难题[J]. 中国感染与化疗杂质, 2013, 13(6) : 495–498. |
| [15] | Park PW, Senior RM, Griffin GL, et al. Binding and degradation of elastin by the staphylolytic enzyme lysostaphin[J]. Int J Biochem Cell Biol, 1995, 27(2) : 139–146. |
| [16] | Ehlert K, Tschierske M, Mori C, et al. Site-specific serine incorporation by Lif and Epr into positions 3 and 5 of the staphylococcal peptidoglycan interpeptide bridge[J]. Journal of Bacteriology, 2000, 182(9) : 2635–2638. |
| [17] | Climo MW, Ehlert K, Archer GL. Mechanism and suppression of lysostaphin resistance in oxacillin-resistant Staphylococcus aureus[J]. Antimicrob Agents Chemother, 2001, 45(5) : 1431–1437. |
| [18] | Harrison EF, Cropp CB. Comparative in vitro activities of lysostaphin and other antistaphylococcal antibiotics on clinical isolates of Staphylococcus aureus[J]. Appl Environ Microb, 1965, 13(2) : 212–215. |
| [19] | Yang XY, Li CR, Lou RH, et al. In vitro activity of recombinant lysostaphin against Staphylococcus aureus isolates from hospitals in Beijing,China[J]. J Med Microbiol, 2007, 56(1) : 71–76. |
| [20] | 杨信怡, 游雪甫, 蒋建东. 溶葡球菌酶的抗菌活性研究进展[J]. 中国新药杂志, 2005, 14(9) : 1113–1117. |
| [21] | 杨信怡, 游雪甫, 娄人慧, 等. 重组溶葡球菌酶的体外抗菌活性研究[J]. 中国新药杂志, 2006, 15(24) : 2107–2111. |
| [22] | 陈旭, 王文奎, 孟志民, 等. 重组溶葡萄球菌素对烧伤创面分离的金黄色葡萄球菌的体外抗菌活性评估[J]. 上海交通大学学报:医学版, 2012, 32(11) : 1411–1414. |
| [23] | Shaw LN, Golonka E, Szmyd G, et al. Cytoplasmic control of premature activation of a secreted protease zymogen:deletion of Staphostatin B(SspC)in Staphylococcus aureus 8325-4 yields a profound pleiotropic phenotype[J]. Journal of Bacteriology, 2005, 187(5) : 1751–1762. |
| [24] | Zygmunt WA, Harrison EF, Browder HP. Microbiological activities of lysostaphin and penicillins against bacteriophage 80/81 strains of Staphylococcus aureus[J]. Appl Environ Microb, 1965, 13(3) : 491–493. |
| [25] | 杨信怡, 游学甫, 蒋建东. 溶葡球菌酶研究进展[J]. 中国生化药物杂志, 2005, 26(6) : 372–374. |
| [26] | 莫云杰, 李国栋, 陆海荣, 等. 重组溶葡萄球菌酶成品中主药蛋白质含量的测定[J]. 中国生化药物杂志, 2006, 27(3) : 163–165. |
| [27] | 卢曦, 任志涛, 李聪然. 重组溶葡萄球菌酶体外诱导的金黄色葡萄球菌耐药株生物学特征[J]. 中国感染与化疗杂志, 2015, 15(3) : 230–235. |