黄河三角洲是我国暖温带保存最完整、最广阔和最年轻的湿地生态系统,在北方河口湿地中具有代表性,地处渤海之滨的黄河入海口,土壤盐碱化尤为严重[1, 2]。盐碱土是盐土(含有可溶性盐分较高)和碱土(含有代换性钠较多)的总称,二者在形成上联系密切,常交错分布,所以,统称为盐碱土[3]。作为中国最主要的中低产田的土壤类型之一[4],盐碱土限制了植物生长,同时,独特的土壤条件造就了特殊的植被类型:盐生植物。柽柳和獐茅作为典型的盐生植物[5-8],在黄河三角洲具有代表性,前人对它们的研究多集中在植被本身的耐盐机制[9-12],而目前关于黄河三角洲生物多样性方面的研究则主要集中在土壤、动物植被分类、植物群落物种组成及多样性梯度变化等方面[13, 14],但这些研究都不是以植被下土壤微生物多样性为研究目的。
土壤真菌数量巨大,种类繁多[15-18]。传统的培养法遗漏了土壤中绝大多数真菌,难以反映真菌群落多样性全貌。分子指纹图谱如变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)和末端限制性片段长度多态性(terminal-restriction fragment length polymorphism,T-RFLP)方法虽然具有高通量的优势,能够指示不同群落结构的差别,但对微生物的认识也是有限的[19, 20]。克隆测序的方法虽然能给出微生物群落的更多信息,但与土壤真菌巨大的多样性相比,克隆文库显得太小,提供的信息仍然偏少。454高通量测序技术拥有数据产出通量高、获得信息丰富、快捷和读长长等优点,使人们有能力研究高度复杂的真菌群落和稀有的微生物类群,因此454高通量测序技术越来越多地被应用于土壤微生物生态学研究中[21-23]。454高通量测序是一种利用DNA乳胶扩增系统和皮升体积的焦磷酸的测序方法,其主要原理是[24],独特的短DNA片段与一个特别设计的DNA捕获磁珠结合,用扩增试剂使其乳化成微反应体系(包含有一个磁珠和一个独特DNA片段)并确保每个反应体系都是DNA单拷贝。DNA片段在各自反应体系中发生扩增反应后打破乳化体系,随后将带有PCR产物的磁珠放入只能容纳单个磁珠的PTP(pico titer plate)板中开始测序。
本研究利用454高通量测序技术对黄河三角洲柽柳和獐茅地土壤真菌进行研究,探讨两种典型盐生植物下土壤真菌物种种类、多样性的变化规律,对丰富我国的物种资源、保护生物多样性具有重要意义,以及为本区真菌多样性深入研究和盐碱地的改良提供基础数据和理论依据。
1 材料与方法 1.1 材料实验土样采集于黄河三角洲的中心城市——东营市河口区,在柽柳及獐茅地各选取有代表性的3个地点进行采样,具体操作是在每个地点(共6个)的0-20 cm和20-40 cm深度各取样1次(尽量避免雨季采样),共获得12个土样。将在多个地点采集的土壤分别进行充分混合,将各土样混匀并除去较大的根系等杂物后,对获得的4个土样进行编号:C1(柽柳:0-20 cm)、C2(柽柳:20-40 cm)、Z1 (獐茅:0-20 cm)和Z2(獐茅:20-40 cm)。放入液氮罐带回实验室,保存在-80℃条件下,用于生物信息学分析。
1.2 方法 1.2.1 土壤DNA提取土壤样品DNA的提取采用Omega DNA提取试剂盒(D5625-01),依据试剂盒操作说明书进行操作。
1.2.2 PCR扩增PCR扩增体系(50 μL)包括:模板DNA 10 μg、10×buffer、0.4 mmol/L dNTP(0.5 μL)、5 U/μL Taq DNA聚合酶(0.5 μL)、1 μL Bar-PCR primer F(50 μmol/L)、1 μL primer R(50 μmol/L)。PCR扩增条件为:94℃预变性5 min;95℃变性45 s,57℃退火30 s,72℃延伸45 s,30个循环;最后72℃延伸5 min。
PCR扩增用Roche 454FLX 测序平台的通用引物,包括:18S F引物(5′-CGTATCGCCTCCTCGCGCCATCAG+bar+CAGTAGTCATATGCTTGTCT-3′)、18sR引物(5′-CTATGCGCCTTGCCAGCCCGCTCAGGCTGCTGGCACCAGACTTGC-3′)。
1.2.3 数据分析将PCR产物在1%(m/v)的琼脂糖凝胶中电泳,电泳测定后采用上海生工琼脂糖回收试剂盒(cat:SK8131)对DNA进行回收。使用Qubit® 2.0荧光剂对回收产物进行定量处理。使用罗氏公司454测序仪(Roch GS FLX sequencer)进行测序。
去除非靶区域序列后,然后用uchime对得到的质量文件做进一步处理,去掉测序质量不好的序列,并对序列长度进行筛选,只保留长度在400-600 bp的序列;采用软件uclust将相似性大于97%的序列归为同一种可操作分类单元(OTU),从每个OTU中选择代表性序列,与NCBI的GenBank进行Blast比对,确定真菌序列的分类信息,获得门、纲、目、科和属各水平下的分类单元。
计算土壤真菌的多样性指标:香农指数(Shannon Index)、Chao1指数、Coverage 等。
Shannon指数计算公式:H=-(ni/N)log(ni/N)
Chao1由Chao(1984)最早提出。计算公式=Schao1=Sobs+n1(n1-1)/2(n2+1),Schao1=估计的OTU数;Sobs=实际OTU数;n1=只有一条序列的OTU数目;n2=只有两条序列的OTU数目。
Coverage:是指各样品文库的覆盖率,其数值越高,则样本中序列没有被测出的概率越低。该指数实际反映了本次测序结果是否代表样本的真实情况。计算公式为:C=1-n1/N,n1=只含有一条序列的OTU的数目;N=抽样中出现的总的序列数目。
基于Unifrac metric来比较多组样本之间的差别度量。Unifrac metric是一种基于系统发育树的计算值,可很好的用于衡量样本间物种组成的相似度[27],值在0-1之间,值越小说明样本间相似度越高。
2 结果 2.1 数据预处理结果为获取更多土壤真菌群落多样性信息,利用454高通量测序技术对真菌18S rRNA进行扩增,序列比对后分析种群多样性和结构组成。经序列质量筛选,去除碱基错配、缺失、含(N)序列和短序列等,使得质控之后序列长度大部分分布在400-600 bp之间,且C1、C2、Z1和Z2土壤真菌高质量序列数分别为4 468、4 921、6 859和7 439条,满足基本分析要求,可用于进一步的生物信息学分析。
2.2 土壤真菌种类分析本研究共获得5门(亚门)17纲37目48科51属。在门(亚门)分类水平上属于5个类群( 图 1-A ),主要包括:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉亚门(Mucoromycotina)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota),其中,子囊菌门在所有样本中的相对丰度为9.01%-75.81%,是最优势门,远远大于次优势门-担子菌门(0.83%-16.39%),表现出非常明显的优势地位。另外,毛霉亚门和球囊菌门在C2土样中不存在。在属分类水平上,优势类群主要包括(相对丰度>1.0%):Diatrype、暗球腔菌属(Phaeosphaeria)、旋孢腔菌(Cochliobolus)、Lulwoana、茎点霉属(Phoma)、绿僵菌属(Metarhizium)、Knufia、被孢霉属(Mortierella)、毛霉菌属(Mucor)。其中最优势属是Diatrype,它在C1、C2、Z1和Z2中的相对丰度依次为:0.11%、0.06%、47.81%和68.67%,而且它的相对丰度远远大于相应土样中的次优势属Phaeosphaeria,具体为:C1中0.11>0.02,C2中0.06>0.04,Z1中47.81>3.14,Z2中68.6>2.27,Diatrype表现出非常明显的优势地位,这与真菌在门中的表现规律一样,说明柽柳和獐茅地中的土壤真菌优势菌群组成相对单一。

|
| 图 1 各样地土壤真菌在门(A)及属(B)分类水平上的种类和相对丰度 |
土壤真菌群落在不同土样上的相对丰度和种类变化,见 图 1 。其中,从C1样地中共获得土壤真菌5门39属,相对丰度较高的几种依次是:旋孢腔菌(1.19%)、Knufia(1.05%)、被孢霉属(1.07%)、毛霉菌属(1.81%),其余35属的相对丰度均小于1.0%。从C2样地中共获得土壤真菌3门25属,其中,子囊菌门、担子菌门和壶菌门相对丰度分别为9.01%、0.83%和0.57%;在属水平上,相对丰度较高的只有旋孢腔菌(0.65%),其余24属的相对多度均小于1.0%。从Z1样地中共获得土壤真菌5门40属,相对丰度较高的依次是:Diatrype(47.81%)、旋孢腔菌(3.02%)、暗球腔菌属(3.14%)、Lulwoana (1.08%)、绿僵菌属(1.68%),其余35属的相对丰度均小于1.0%。从Z2样地中共获得土壤真菌5门23属,相对丰度较高的几种依次是:Diatrype(68.67%)、暗球腔菌属(2.27%)、Lulwoana(1.2%)、茎点霉属茎点霉属(1.04%),其余19属的相对丰度均小于1.0%。说明C1和Z1土壤真菌种类较多。
柽柳地中,0-20 cm土壤真菌种类多于20-40 cm土壤真菌种类;同样地,在獐茅地中,0-20 cm土壤真菌种类也多于20-40 cm土壤真菌种类。土壤真菌相对丰度的变化规律与种类上的变化规律基本一致:同一真菌,其在0-20 cm的相对丰度普遍大于20-40 cm的相对丰度。本研究中总体呈现出随土壤深度增加,真菌种类和相对丰度减少的趋势,原因可能是上层土透气性好、营养物质相对丰富。
各土样土壤真菌种类有一定差别( 图 2 ),只11个属为4个土样所共有。此外,青霉菌属(Penicillium)、盘多毛孢属(Pestalotia)、Cyphellop-hora、Ophiocordyceps、Hemileia、Burgoa、Sistotrema、Powellomyces、毛霉菌属(Mucor)、Conidiobolus、Thamnocephalis这11个属只存在于柽柳地土壤中,所有这11个属在C1中都存在,而C2中只有青霉菌属、盘多毛孢属、Cyphellophora、Hemileia、Burg- oa、Conidiobolus 6个属存在。只存在于獐茅中的属 (共12个)包括:绿僵菌属(Metarhizium)、Halosarph-eia、中国盘菌属(Peziza)、光柄菇属(Pluteus)、Filobasidium、Sakaguchia、Volvariella、裸盖菇属(Psilocybe)、Hannaella、Hyphoderma、Rhizophagus、Funneliformis,其中,Halosarpheia、中国盘菌属、Hannaella在Z2中不存在。
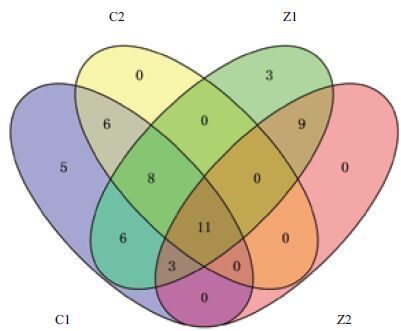
|
| 图 2 各土样真菌种类维恩图 |
柽柳和獐茅地土壤真菌群落多样性结果,见 表 1 。采用Mothur软件对群落结构多样性进行分析( 表 1 )可知,4个土样中土壤真菌覆盖率均高于89%,表明本次测序深度合理,基本能代表样本的真实情况。柽柳上层土壤OTU(操作分类单元)数最多,为858,獐茅下层土壤OTU数最少为501,前者是后者的1.7倍。4种样地中Shannon指数平均值和Chao1指数平均值由高到低依次为C1>Z1>C2>Z2,其中,C1的Shannon指数平均值和Chao1指数平均值分别是Z2相应指数的1.2倍和2.4倍。由此可见,柽柳地土壤真菌比獐茅地土壤真菌丰富,且柽柳上层土壤真菌多样性最丰富。
从 图 3 可以看出,Z1和Z2真菌群落间的Unifrac metric值最小,为0.269 9;C1和Z1真菌群落间的Unifrac metric值为0.387 7;C2和Z2、C1和C2真菌群落间的Unifrac metric值分别为0.683 6、0.690 2,说明Z1和Z2真菌群落间的相似性最大,而C1和C2真菌群落间相似性最小。表明柽柳地土壤真菌群落多样性高于獐茅地土壤真菌群落多样性,前者土壤真菌种类较后者丰富。

|
| 图 3 各土样真菌群落距离热图 |
本研究柽柳地和獐茅地土壤采集于黄河三角洲,应用高通量测序技术对其柽柳地上下层和獐茅地上下层土壤真菌种类和多样性进行了研究。
在本研究中,以子囊菌门为主(在C2中相对丰度高达75.81%),其次是担子菌门(在C1中相对丰度最高,仅为16.39%),这与袁超磊等[28]的研究结果一致,但本研究共获得5个真菌门,而后者仅仅获得3个(毛霉亚门和壶菌门未获得),这可能与柽柳和獐茅地中含有包括动植物残体的沉积物有关[29]。另外,Buée等[23]和李超等[30]都发现最丰富真菌类群为担子菌门,其次才是子囊菌门,与本研究不同,这种差异可能是由各自土壤在pH、盐分含量和CaCO3含量等性质的不同造成的。
柽柳地和獐茅地中,均是0-20 cm土壤真菌种类多于20-40 cm土壤真菌种类,总体呈现出随土壤深度增加,真菌种类减少的趋势,说明自然状态下土壤的真菌多样性受到土壤垂直分布的影响,优势真菌种群随土壤深度的变化略有差异,与前人研究一致[31, 32]。
通过多样性和相似性分析可知,柽柳地土壤真菌群落多样性高于獐茅地土壤真菌群落多样性,且柽柳上层土壤真菌多样性最丰富。由前面土壤真菌种类分析可知,獐茅地土壤真菌种类略多于柽柳地,与多样性和相似性分析的结果不一致。这可能是由于多样性和相似性分析均是以OTU为基础,而OTU是通过将多条序列按其序列间的距离对它们进行聚类,后根据序列之间的相似性作为域值分成的操作分类单元,此操作分类单元被认为可能属于属或种,也可以是菌株,所以所得结果有所不同,具体原因有待进一步研究。
4 结论本研究共获得5门(亚门)17纲37目48科51 属。在门分类水平上,子囊菌门(Ascomycota)是所有样本中的最优势门,其相对丰度远远大于次优势门担子菌门(Basidiomycota)。在属分类水平上,最优势类群是Diatrype。
本研究中土壤真菌种类和相对丰度总体呈现出随土壤深度增加,真菌种类和相对丰度减少的趋势。
C1土壤真菌的OTU数、Shannon指数、Chao1指数分别是Z2相应指数的1.7倍、1.2倍和2.4倍,且Z1和Z2真菌群落间的相似性最大,C1和C2真菌群落间相似性最小,柽柳地土壤真菌多样性高于獐茅地土壤真菌多样性。
| [1] | 范晓梅, 刘高焕, 唐志鹏, 等. 黄河三角洲土壤盐渍化影响因素分析[J]. 水土保持学报, 2010, 1(1) : 139–144. |
| [2] | 刘宁, 李新举, 赵庚星, 等. 基于GIS的黄河三角洲土壤肥力质量自动化评价[J]. 土壤通报, 2006, 37 : 1053–1057. |
| [3] | 范亚文. 种植耐盐碱植物改良盐碱土的研究[D]. 哈尔滨:东北林业大学,2001. |
| [4] | 杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5) : 837–845. |
| [5] | 左明, 张士华, 刘艳芬, 等. 黄河三角洲地区耐盐乡土植物种类及生态价值研究[J]. 中国野生植物资源, 2014(3) : 40–43. |
| [6] | 刘玉娟, 贺康宁, 王伟璐, 等. 盐胁迫对柽柳和白刺光合日变化的影响[J]. 中国农学通报, 2015, 31(28) : 6–12. |
| [7] | 任广波, 张杰, 马毅. 基于HJ-1A高光谱的黄河口碱蓬和柽柳盖度反演模型研究[J]. 海洋学报, 2015, 37(7) : 51–58. |
| [8] | 夏江宝, 刘玉亭, 朱金方, 等. 黄河三角洲莱州湾柽柳低效次生林质效等级评价[J]. 应用生态学报, 2013, 24(6) : 1551–1558. |
| [9] | 张改英. 干旱胁迫下獐茅SSh文库的构建及耐旱相关基因的筛选[D]. 大连:大连理工大学,2014. |
| [10] | 马玉蕾, 王德, 刘俊民, 等. 黄河三角洲典型植被与地下水埋深和土壤盐分的关系[J]. 应用生态学报, 2013, 24(9) : 2423–2430. |
| [11] | 刘艳, 姚延梼. 耐盐碱树种柽柳对应县重盐碱地的改良效果[J]. 山西农业科学, 2015, 43(8) : 981–985. |
| [12] | 田家怡, 潘怀剑, 傅荣恕. 黄河三角洲土壤动物多样性初步调查研究[J]. 生物多样性, 2001, 3(3) : 228–275. |
| [13] | 张高生, 王仁卿. 现代黄河三角洲植物群落数量分类研究[J]. 北京林业大学学报, 2008(3) : 31–36. |
| [14] | 李新华, 王勇, 朱振林. 黄河三角洲自然保护区典型植物群落物种组成及多样性梯度变化[J]. 亚热带植物科学, 2014(2) : 135–138. |
| [15] | 高玉峰, 贺字典. 影响土壤真菌多样性的土壤因素[J]. 中国农学通报, 2010, 26(10) : 177–181. |
| [16] | 刘德胜. 黄河三角洲盐碱地真菌多样性及活性次级代谢产物的初步研究[D]. 青岛:中国海洋大学,2014. |
| [17] | Grantina L, Seile E, Kenigsvalde K. The influence of the land use on abundance and diversity of soil fungi:Comparison of conventional and molecular methods of analysis[J]. Environmental and Experimental Biology, 2011, 9 : 99–21. |
| [18] | Zhang LM, Hu HW, Shen JP. Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria inammonia oxidation of strongly acidic soils[J]. ISME J, 2012, 6(5) : 1032–1045. |
| [19] | Boon N, Top EM, Verstraete W, et al. Bioaugmentation as a tool to protect the structure and function of anactivated-sludge microbial community against a 3-chloroaniline shockload[J]. Appliedand Environmental Microbiology, 2003, 69(3) : 1511–1520. |
| [20] | Raina V, Suar M, Singh A, et al. Enhanced biodegradation of hexachlorocyclohexane(HCH)in contaminated soils via inoculation with Sphingobium indicum B90A[J]. Biodegradation, 2008, 19(1) : 27–40. |
| [21] | 张文力. 高通量测序数据分析现状与挑战[J]. 集成技术, 2012, 1(3) : 20–24. |
| [22] | 贺纪正, 袁超磊, 沈菊培, 等. 土壤宏基因组学研究方法与进展[J]. 土壤学报, 2012, 49(1) : 155–164. |
| [23] | Buée M, Reich M, Mura C, et al. 454 Pyrosequencing analyses of forest soils reveal an unexpectedly high fungal diversity[J]. New Phytologist, 2009, 184(2) : 449–456. |
| [24] | 楼骏, 柳勇, 李延. 高通量测序技术在土壤微生物多样性研究中的研究进展[J]. 中国农学通报, 2014, 30(15) : 256–260. |
| [25] | 郭飞宏, 郑正, 张继彪. PCR-DGGE技术分析塔式蚯蚓生态滤池微生物群落结构[J]. 中国环境科学, 2011(4) : 597–602. |
| [26] | 胡亮. 植被群落多样性分析指标研究[D]. 广州:中山大学,2006. |
| [27] | Lozupone C, Knight R. UniFrac:a new phylogenetic method for comparing microbial communities[J]. Applied & Environmental Microbiology, 2005, 71(12) : 8228–8235. |
| [28] | 袁超磊, 贺纪正, 沈菊培, 等. 一个红壤剖面微生物群落的焦磷酸测序法研究[J]. 土壤学报, 2013, 50(1) : 138–147. |
| [29] | 宣淮翔, 安树青, 孙庆业, 等. 太湖不同湖区水生真菌多样性[J]. 湖泊科学, 2011(3) : 469–478. |
| [30] | 李超, 梁俊峰, 周光益, 等. 十二度水自然保护区土壤真菌群落多样性研究[J]. 菌物学报, 2014, 33(1) : 152–161. |
| [31] | 姚贤民, 吕国忠, 杨红, 等. 长白山森林土壤真菌区系研究[J]. 菌物研究, 2007, 5(1) : 43–46. |
| [32] | 宋风雅, 梁鹏, 何其光, 等. 应用PCR-RFLP技术分析橡胶林土壤真菌种群动态变化[J]. 西南农业学报, 2014(6) : 2469–2477. |





