2. 中国科学院湖北产业技术创新与育成中心,武汉 430072
2. Hubei High-tech Innovation and Business Incubation Center,Chinese Academy of Sciences,Wuhan 430072
随着微生物分子技术的发展,对真菌基因组和转录组进行全序列测定进而分析关键酶、基因及其动态变化是定向改造菌种特性的依据,并已逐渐成为微生物领域的研究热点。提取基因组和转录组则是测序的第一步,其质量及收率决定着能否进行有效测序并得到高质量数据。多种真菌的基因组提取方法已见报道[1-3],但每种真菌有其独特的生理特性,基因组和转录组的提取技术和方法不尽相同。高山被孢霉(Mortierella alpina)是一类丝状真菌,是工业化生产花生四烯酸(arachidonic acid,ARA)的高产菌种,在基因序列中,有高达60%的基因参与脂肪酸代谢[4]。
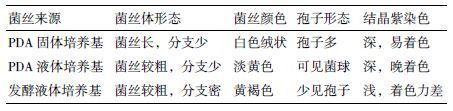
高山被孢霉培养条件一般有3种:PDA固体培养基、PDA液体培养基和发酵培养基。由PDA固体培养基及PDA液体培养基培养的菌丝提取基因组的优势在于简单易行、节约培养时间;其缺点是菌丝量较小,易受PDA培养基中马铃薯DNA的干扰;由液体发酵培养基中的菌丝提取基因组的优势在于菌丝量大,可降低外源DNA干扰,提取效率高,缺点是培养时间过长,操作相对繁琐复杂。
高山被孢霉转录组的提取过程相对于基因组提取过程对环境和操作技术的要求更高、更复杂。对于高山被孢霉转录组的提取方法报道较少[5],随着生物技术的快速发展,使用繁琐的化学试剂进行各类生物和细胞组织的基因组和转录组的提取已基本被方便快捷高效的试剂盒所取代,而进口的试剂盒价格高昂,使得很多实验室望而却步。本研究首次使用国产试剂盒对高山被孢霉转录组进行提取,并通过电泳、OD值、RT-PCR进行验证,旨在确定提取高山被孢霉转录组的最佳方法。
1 材料与方法 1.1 材料 1.1.1 实验菌株高山被孢霉Mortierella alpina cfcc88447,购于中国林业微生物菌种保藏管理中心。高山被孢霉Mortierella alpina G2,由本实验室分离获得,菌种以甘油管保存于-80℃冰箱内,每6个月转存一次。
1.1.2 仪器和设备气相色谱仪:GC1690,岛津;自动凝胶成像仪:JS-680D,500万像素,上海培清;流式芯片:Agilent 2100 生物分析仪,美国;微量紫外分光光度计:Thermo NANODROP,美国;PCR扩增仪:Bio-Rad,MyCycler,美国。
1.2 方法 1.2.1 培养基PDA固体培养基:马铃薯20%,葡萄糖2%,琼脂2%,KH2PO4 0.05%,MgSO4 0.025%,pH自然。PDA液体培养基:马铃薯20%,葡萄糖2%,KH2PO4 0.05%,MgSO4 0.025%,pH自然。菌种种子液培养基:葡萄糖8%,酵母粉2%,pH自然。菌种发酵培养基:葡萄糖8%,酵母粉2%,pH自然。
1.2.2 菌种的培养与菌丝收集菌种活化:将甘油管保存的菌种分别转接到PDA固体及液体培养基,28℃培养5-8 d,湿度40%-60%。
接种方式:制备菌悬液,按5%的接入量至100 mL种子液培养基,220 r/min,28℃,培养3 d。
发酵培养:按8%的接入量接入100 mL发酵培养基,220 r/min,28℃,培养7-10 d。
菌丝收集:刮取PDA固体培养基表面菌丝,避免刮到培养基。PDA液体培养基及发酵培养基中的菌丝使用接种环挑取,于无菌条件下使用超纯水反复清洗4-5次,将洗净菌丝转移至无菌烧杯中。
1.2.3 高山被孢霉基因组提取菌丝处理方法:将清洗完全的PDA固体培养基菌丝、PDA液体培养基和发酵培养菌丝置于真空冷冻干燥机中抽真空24 h至菌丝完全干燥,干燥后的菌丝放于研钵中,倒入液氮进行研磨,将菌丝研磨的尽量细,收集菌粉,转到离心管中。基因组提取方法:称取菌粉0.04 g,使用QIAGEN试剂盒DNeasy Plant Mini Kit进行抽提。
1.2.4 高山被孢霉转录组提取挑取发酵6 d的高山被孢霉菌丝至15 mL离心管中,用DEPC处理水清洗菌丝,反复多次,尽量去除多余水。称量菌丝0.5 g至离心管中,使用北京艾德莱生物科技有限公司的RN38-EASYspin Plus植物RNA快速提取试剂盒提取[6];比较对破碎组织及分离RNA的两种方法,方法一是直接取新鲜的菌丝组织称取。0.5 g放入研钵,加入裂解液室温下充分研磨成匀浆,迅速研磨让组织和裂解液立即充分接触以抑制RNA酶活性;方法二是称取0.5 g菌丝用液氮速冻后取出立即进行研磨,加强菌丝壁的裂解程度,研好后呈细浆状。此时加入5% β-巯基乙醇及裂解液,于65℃水浴中预热,加入到研磨好的菌浆中立即吹打混匀裂解,振荡混匀后按照试剂盒步骤进行提取。
1.2.6 分析方法 1.2.6.1 菌体生物量的测定摇瓶发酵结束后,发酵液用布氏漏斗进行抽虑;抽干的菌体会形成菌饼,计算干重W即为生物量。
1.2.6.2 总油脂抽提和计算方法(索氏提取法)将烘干的菌体放入研钵进行研磨至细小的颗粒状,称取上述研磨的颗粒(粉末)1-2g,取精确值W0,用滤纸包住,系上棉绳,放入烘箱105℃烘至恒重(约30 min),称滤纸包重量W1;将烘后的滤纸包放入索氏提取器内,用石油醚进行索氏提取,8-10 h后取出,105℃烘干,称纸包重量W2。
总油脂%=(W1-W2)/ W0×100%
1.2.6.3 油脂中ARA百分含量的测定和计算(1)样品处理(甲酯化):称取研磨菌渣0.1 g左右,加入0.5%氢氧化钾甲醇溶液1 mL,60℃水浴30 min,每5 min摇匀一次,加入三氟化硼甲醇溶液1 mL,60℃水浴30 min,每5 min摇匀一次,取出后,加入2 mL正己烷,混匀后加入1 mL饱和氯化钠溶液,反应完毕。4 000 r/min离心5 min,取上层进行气相检测。(2)气相色谱条件:DB-23ms(30.0 m×0.25 mm×0.25 μm)石英毛细管色谱柱柱;柱温程序:90℃保持1 min,以9℃/min升至240℃,保持5 min;载气:氮气;流速:约2.0 mL/min;进样口温度:250℃;进样模式:分流进样(分流比1∶10);进样量:1 μL;检测器温度:280℃。(3)计算方法:ARA百分含量的计算使用的是面积归一法,即ARA在气相检测图谱中的峰面积占总峰面积的百分比。
1.2.7 琼脂糖凝胶电泳对基因组的分析DNA样品进行电泳:取1 μL loading buffer(6×)与5 μL DNA样品混合,缓慢将样品及Marker分别注入加样孔中,跑胶电压90 V。在琼脂糖凝胶电泳成像系统中使用配套软件,进行样品质量分析。样品浓度使用Thermo NANODROP设备进行测定。
1.2.8 琼脂糖凝胶电泳对转录组的分析RNA样品进行电泳:取1 μL loading buffer(6×)与5 μL RNA样品混合,缓慢将样品及Marker分别注入加样孔中,跑胶电压100 V。在琼脂糖凝胶电泳成像系统中使用配套软件,进行样品质量的分析。样品浓度使用Thermo NANODROP设备进行测定。
1.2.9 RT-PCR取1.2.4中方法二提取的转录组,使用北京艾德莱生物科技有限公司的PC1801试剂盒合成第一链cDNA。引物设计:选取高山被孢霉GMER蛋白设计引物进行RT-PCR,即LR1:5′-ATGTCTCCCTCAAAGTCGGTCATCATGGTC-3′;LR2:5′-CCATAGTTGGAGTCGTGGGGAGGTCCTT-3′。反应体系:使用北京艾德莱生物科技有限公司的PC0902 Taq PCR MassterMix。PCR扩增程序如为:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1-2 kb/min,共40个循环;72℃ 8 min。
1.2.10 高山被孢霉结晶紫染色方法载玻片固定:在无菌条件下,用接种环挑取少量菌丝于干净的载玻片上涂布均匀,加热以杀死菌种并使其粘附固定;草酸铵结晶紫染1 min;自来水冲洗,去掉浮色。
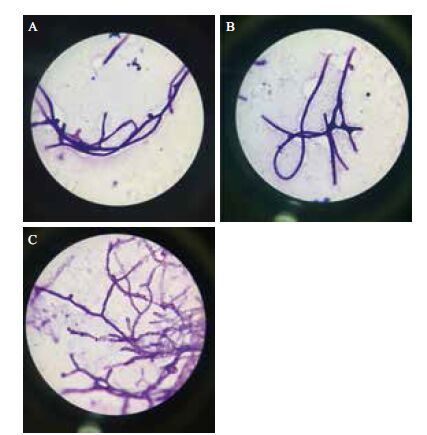
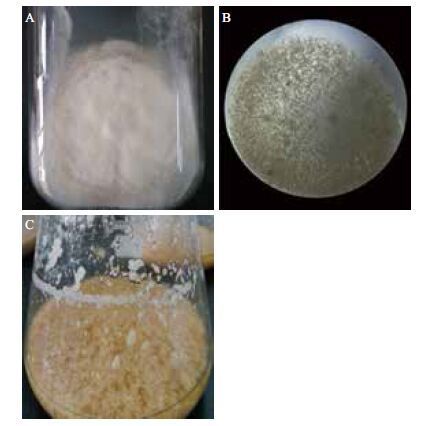
2 结果 2.1 高山被孢霉菌丝来源对基因组提取的影响对PDA固体培养基培养的高山被孢霉菌丝、PDA液体培养基中的菌丝和三角瓶中培养的液体发酵菌丝进行同等条件下的基因组提取实验,比较菌丝生理状态、提取纯度和提取收率,并确定最优的基因组提取方法。本实验所使用菌种为高山被孢霉cfcc88447,培养于PDA固体培养基、PDA液体培养基的菌丝与发酵培养基中生长的菌丝略有不同( 表 1 ),显微镜观察染色后的对比图片见图 1 ,染色前培养于PDA固体培养基、PDA液体培养基和发酵培养基中的菌丝生长状态,见图 2 。
|
| 图 1 高山被孢霉PDA固体培养基(A)、PDA液体培养基(B)、发酵培养基(C)经草酸铵结晶紫染色后的形态比较 |
|
| 图 2 高山被孢霉PDA固体培养基菌丝(A)、PDA液体培养基菌丝(B)、发酵培养基菌丝(C)的形态比较 |
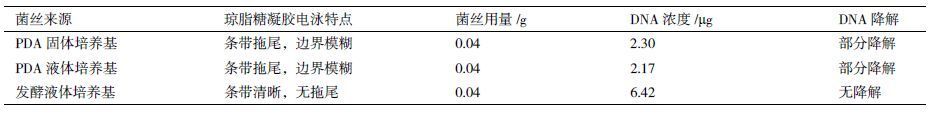
琼脂糖凝胶电泳图( 图 3 )显示,PDA培养基中菌丝提取的基因组条带不清晰,并出现了严重拖尾现象( 图 3 中泳道1和2),而Marker样品的条带清晰,分离效果较好,证明电泳条件无问题。相对比而言,使用液体发酵菌丝提取的高山被孢霉基因组条带非常清晰,无拖尾现象。经反复实验证实,均出现此结果,表明PDA培养基培养的高山被孢霉菌丝用作基因组提取原料,样品出现了部分DNA断裂现象,且培养基中的马铃薯不易彻底去除,从而导致对DNA样品造成污染,进而对基因组测序造成干扰,影响DNA测序过程的分析和结果的准确性。对基因组样品进行收率计算,使用液体发酵菌丝提取的基因组收率高且条带清晰,满足测序要求( 表 2 )。

|
| 图 3 菌丝不同培养方式提取基因组的琼脂糖凝胶成像图谱比较 1,2:分别为高山被孢霉cfcc88447 PDA固体培养基及液体培养基培养的菌丝作为原料提取的基因组DNA样品,样品上样量4 μL;3和4:高山被孢霉cfcc 88447液体发酵菌丝作为原料提取的基因组DNA样品,泳道3为4 μL上样量,泳道4为2 μL上样量;M:标准λ DNA/Hind III Marker |
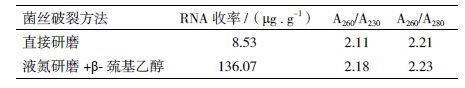
进口转录组提取试剂盒价格昂贵,且并非适合所有微生物转录组的提取,有时出现提取效率低,转录组纯度和质量不理想等问题。本研究首次尝试使用国产转录组试剂盒进行高山被孢霉的转录组提取[7, 8],研究使用国产试剂盒提取高山被孢霉的转录组提取效果和条件,如该方法成功,将大大节约提取成本,还可对国产品牌起到一定的宣传推广作用。该实验所用菌株为本实验室保存的高山被孢霉G2菌。按照试剂盒提供方法所述进行转录组提取实验,见1.2.4中的具体提取方法描述,使用方法一中所述的在新鲜的菌丝体中加入裂解液,室温下将菌丝充分研磨成匀浆,经反复实验,该方法提取得到的RNA浓度偏低达不到转录组测序所需总量和浓度要求( 图 4 中泳道1),推测由于高山被孢霉细胞壁中几丁质含量较高,普通裂解液不能对其进行完全破碎,导致RNA释放受限,收率偏低。因而,在菌丝体处理方法上加以改进,使用1.2.4中所述的方法二进行提取,并用液氮对菌丝进行迅速冷冻加强菌丝壁的破碎程度,然后使用裂解液及β-巯基乙醇的共同作用来裂解细胞壁释放总RNA( 图 4 泳道2),经反复实验,均证明RNA浓度提高了10-20倍以上,5S条带非常弱,说明RNA无明显降解,经RT-PCR,成功获得GMER的基因片段( 图 4 泳道3),因此所获高山被孢霉转录组的浓度和质量均达到测序的标准[9],具体浓度见表 3 。

|
| 图 4 RNA及RT-PCR琼脂糖凝胶成像 M:标准λ DNA/Hind III Marker;1:直接裂解的方法所得高山被孢霉G2的RNA样品,上样量2 μL;2:使用液氮研磨及β-巯基乙醇共同作用下裂解菌丝后所得高山被孢霉G2的RNA样品,上样量为2 μL;3:提取出的RNA经PCR的GMER基因片段,上样量为2 μL |
根据表 3 中数据显示可知,使用两种方法所获得的RNA最终的A260/A230均大于2,说明使用该试剂盒脱盐较充分,A260/A280均大于2,且在数值2.2左右,说明蛋白去除较彻底,经比较两种菌丝的前处理方法,证明以第二种方法,将菌丝速冻后进行研磨提取,并加入β-巯基乙醇,可大大提高RNA收率,其质量也可达到测序所需标准。综合分析证明该试剂盒适合于高山被孢霉的转录组提取。
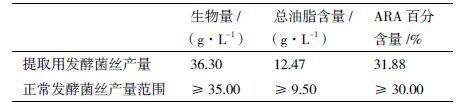
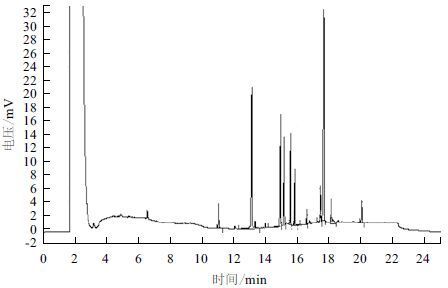
2.3 高山被孢霉基因组和转录组提取所使用的发酵菌丝的验证高山被孢霉的每批次发酵是否正常主要是通过评判发酵菌丝的生物量、其中总油脂含量和ARA的百分含量这3项指标,用以作为任何下一步实验结果讨论的基本依据。本研究中所涉及的基因组和转录组提取条件和技术的研究所使用的发酵菌丝体均同步进行了该3项指标的测定,达到预期水平后方可进行下一步的提取条件和技术的研究工作,ARA的GC图谱见图 5 ,ARA的峰出现在17.763 s,含量为油脂总量的31.8791%。提取用菌丝发酵产量及正常发酵取值范围,见表 4 。
|
| 图 5 气相检测ARA图谱 |
高山被孢霉属于长菌丝真菌类,含有丰富的多糖和蛋白质,菌丝壁较厚,在不同的培养基中培养的菌丝体状态均不相同,需找出可提取高质量DNA的菌丝体培养来源,以满足基因组测序和其他分子生物学操作的高标准要求。在真菌菌丝来源方面,本研究尝试了使用来源为PDA固体培养基、PDA液体培养基和发酵培养基的菌丝作为实验材料,经反复证明,PDA固体培养基和PDA液体培养基培养的菌丝提取的基因组出现部分降解断裂现象,并不适合用于DNA提取,推测是由于PDA培养基中含有马铃薯,不易去除干净,可干扰最终DNA的纯度影响测序结果,并且可能由于PDA培养基培养的菌丝内可降解DNA的酶含量较高,或者马铃薯中可降解高山被孢霉的DNA酶难以去除导致最终DNA的部分降解。而使用发酵液培养的菌丝作为原料进行基因组的提取,可获得符合要求的高质量DNA,无断裂降解,且收率较高,可满足包括基因组测序在内的各类分子生物学操作分析使用。关于真菌的基因组提取方法,文献中多有报道,一般可采用冷冻研磨CTAB法及试剂盒提取法,所得的总DNA纯度和浓度也较高,较适合分子生物学操作的要求[10]。另有文献指出采用微波炉加热法取代液氮研磨以使丝状真菌破壁,也达到了较好的提取效果[11-13]。
经本研究表明,使用国产试剂盒用于提取高山被孢霉转录组,方法简易,效率高,蛋白质残留少,效果稳定,重复性好等优点,经电泳、OD值、RT-PCR三种方法的验证,提取的RNA适合于转录组测序及常规分子生物学分析,在液氮研磨及β-巯基乙醇的提取方法中,经证明可增加RNA收率在10-20倍以上,并且RNA无降解。推测可能是由于真菌组织中含有一定量的酚类化合物,其被氧化后与RNA结合,从而导致RNA分离困难,β-疏基乙醇的加入可避免酚类化合物被氧化,进而提高RNA的终浓度。而且,高山被孢霉菌丝体长且细胞壁因几丁质含量较高,使用常规的普通裂解液很难将壁完全破碎,因此使用低温速冻的物理学破壁方法配合裂解液才能达到完全或大部分破壁的目的,提高收率,同时提取转录组所用菌丝的发酵产量正常,通过新一代测序技术可以有效确定高山被孢霉发酵期间基因表达情况。
因不同真菌或植物在细胞壁结构、转录组大小及酚类等杂质对RNA提取的影响,在提取过程中,对试剂盒的基本方法加以改进已较为普遍。除了本研究提到的改进方法,另有研究表明在进行葡萄叶片RNA提取时,延长提取试剂与样品的接触时间操作可以显著提高RNA提取纯度[14]。随着转录组的研究及RNA-Seq逐步受到重视,利用新一代测序技术能够更为快速、准确地为人们提供更多的生物体转录信息,进而揭示生物体的基因表达、研究结构变异及发现新基因等[15]。
4 结论在基因组提取过程中,经本研究对高山被孢霉3种培养方式的对比表明,PDA固体培养基及PDA液体培养基培养的高山被孢霉菌丝因出现了部分DNA断裂、培养基中的马铃薯对DNA样品造成污染等,提取的DNA会影响测序结果的分析及准确性。与之相反,使用液体发酵液中培养的菌丝提取的高山被孢霉基因组条带清晰基本无降解,且收率较高,可用于DNA测序分析。在转录组提取过程中,使用经改进的菌丝前处理方法,即使用快速冷冻物理方法,并配合β-巯基乙醇的共同作用,经证明可大大增加RNA收率,且RNA降解率非常化纯度高,所提RNA适于测序或其他相关研究。
| [1] | 陈锋菊, 李百元, 杨冰, 等. 一种经济快速提取丝状真菌基因组DNA的方法[J]. 生命科学研究, 2010, 14(2) : 122–124. |
| [2] | 程国旺, 吴中华, 徐剑, 等. 高山被孢霉DNA提取方法的比较与改进[J]. 安徽农业大学学报, 2004, 31(2) : 203–206. |
| [3] | 蔡文娇, 徐大彬, 蓝霞, 等. 一种提取真菌基因组DNA的新方法[J]. 农业研究与应用, 2014, 3(3) : 95–110. |
| [4] | Wang L,Chen W,Feng Y,et al. Genome characterization of the oleaginous fungus Mortierella alpina[J]. 2011,6(12):319-325. |
| [5] | 任岩. 高山被孢霉全基因组序列破译、转录组分析、岩藻糖代谢研究及阴沟肠杆菌全基因组序列破译[D]. 天津:南开大学,2010. |
| [6] | Cheng YQ, Liu JF, et al. Construction of ethylene regulatory network based on the phytohormones related gene transcriptome profiling and prediction of transcription factor activities in soybean[J]. Acta Physiol Plant, 2013, 35(4) : 1303–1317. |
| [7] | 吴田, 蓝增全. 茶梅花瓣总RNA提取方法的比较和分析[J]. 中国农学通报, 2013, 29(28) : 129–133. |
| [8] | Bajpai PK, et al. Production of arachidonic acid by Mortierella alpina ATCC 32222[J]. J Ind Microb, 1991, 8(3) : 179–186. |
| [9] | 刘建民. 高山被孢霉多不饱和脂肪酸合成相关基因克隆及转化甘蓝型油菜研究[D]. 武汉:华中科技大学,2010. |
| [10] | 张晓晖, 郭春华, 江晓霞, 等. 康氏木霉基因组DNA提取方法的比较研究[J]. 生物技术通报, 2007(5) : 128–130. |
| [11] | 刘少华, 等. 一种快速简便的植物病原真菌基因组DNA提取方法[J]. 植物病理学报, 2005, 35 : 362–365. |
| [12] | 何慧, 何松哲, 陈懿, 等. 六种真菌基因组DNA快速提取方法比较[J]. 中华临床感染病杂志, 2015, 8(1) : 36–41. |
| [13] | 蒋云露, 杨建涛, 王猛, 等. 四川泡菜盐卤中微生物总基因组DNA提取方法的比较[J]. 中国酿造, 2015, 34(4) : 90–92. |
| [14] | 杨晓燕, 等. 适合转录组测序的葡萄叶片总RNA试剂盒提取法的改进[J]. 生物技术通报, 2013(6) : 215–220. |
| [15] | 张春兰, 秦孜娟, 王桂芝, 等. 转录组与RNA-Seq技术[J]. 生物技术通报, 2012(12) : 51–56. |