细菌广泛存在于人类生活的环境当中,人们身体内外也存在着大量的共生菌群。一些细菌会导致人类严重的疾病,甚至死亡。黏附是细菌入侵的第一步,细菌已进化出一些表面分子和结构促使其黏附到宿主细胞表面,如菌毛、鞭毛和黏附素等。细菌也会产生一些毒素、侵袭素,还有细菌的III型分泌系统,在这些因子的共同作用下,细菌能够顺利地与宿主细胞结合,并且将入侵的信息传递到宿主细胞当中,促使宿主细胞中的激酶发生磷酸化,传递细胞信号调节细胞骨架运动,最终促进细菌的入侵。在一些细菌入侵宿主细胞的过程中,细胞黏着斑激酶起重要的调节作用。细菌首先会诱导细胞黏着斑激酶自身的磷酸化,同时激活下游信号通路,调节肌动蛋白聚合,引起细胞骨架重排,最终导致细胞膜的内陷,细菌侵入宿主细胞。为了深入探讨细菌侵入非吞噬细胞的整个过程及调控机制,本文就细菌对非吞噬细胞的黏附、侵入以及细胞黏着斑激酶信号通路在此过程中的调节作用进行综述。
1 细菌对宿主细胞的黏附黏附是病原菌入侵宿主细胞的第一步,这个过程需要病原菌的黏附因子和宿主细胞表面受体的特异性结合,进而有助于病原菌在宿主细胞表面的定植。细菌已进化出特殊的表面分子和结构促使其能黏附到宿主细胞的表面。细菌有大量的能够黏附到宿主细胞表面的相关结构,如菌毛、纤毛、荚膜和鞭毛等[1]。菌毛是革兰氏阴性菌表面的重要结构其主要功能是使细菌黏附到宿主细胞上。在革兰氏阴性菌中,与黏附相关最典型的是I型菌毛、P菌毛和IV型菌毛。I型菌毛和P菌毛主要通过伴侣—引领的途径形成[2]。例如,引发肾盂肾炎的大肠杆菌P菌毛,就是通过这一途径完成菌毛的装配,其分为三步:(1)菌毛子集通过II型分泌系统,到达细胞膜周质;(2)膜周质中的伴侣分子与菌毛子集结合,并且将菌毛子集运送到细胞外膜上的引领分子;(3)由引领分子对菌毛子集进行装配[3]。其P菌毛通过PapG蛋白黏附到尿路细胞上糖脂的α-D-吡喃半乳糖-(1-4)糖脂-β-D-吡喃半乳糖苷[4]。IV型菌毛的形成则与I型菌毛和P菌毛的形成过程有所不同。IV型菌毛在细胞质膜内首先形成一个完整的菌毛,然后通过挤压到达细胞膜外[5]。以上3种类型的菌毛均在黏附过程中起重要的作用。细菌表达的黏附相关的蛋白为黏附素,黏附素不仅分布在菌毛、鞭毛这些结构的末端、或轴上,也分布在细菌细胞表面。例如,磷壁酸是革兰氏阳性细菌细胞壁组成成分,金黄色葡萄球菌、表皮葡萄球菌和化脓性链球菌的黏附过程与磷壁酸有关。金黄色葡萄球菌表面有许多黏附素,如纤连蛋白结合蛋白(fibronectinbinding proteins,FnBPs)、胶原蛋白结合蛋白(collagen adhesin,Cna)、聚集因子(clumping factors,Clfs)等。其中,纤连蛋白结合蛋白与细胞外基质结合,细胞外基质与宿主细胞结合,从而起到黏附的作用[6]。除了细菌细胞表面的黏附素,细菌(主要是革兰氏阴性菌)自身分泌产生的蛋白到达细胞外膜,黏附到细胞外基质或者宿主细胞表面[7],同时促进细菌的聚集,如引发小肠结肠炎的耶尔森菌中的YadA[8]。
宿主细胞膜表面有些糖类、蛋白等可作为细菌黏附的主要受体。哺乳动物的宿主细胞表面有许多黏附分子,这些黏附受体主要分为四大类:整合素、钙黏蛋白、免疫蛋白超家族和选择素[9]。整合素普遍存在于细胞与细胞、细胞与细胞外基质的黏附过程中,它是宿主细胞表面的一个异二聚体,由α和β两个不同的亚单位,按照不同的组合构成,其中β1整合素家族通常是细胞外基质的受体。有整合素参与的黏附,要与细胞外基质结合共同完成黏附作用(这种黏附方式叫做间接黏附),细胞外基质包括纤连蛋白(fibronectin,Fn)、层黏连蛋白、胶原蛋白。由整合素介导产生结合的细菌有小肠结肠炎耶尔森菌[10]、金黄色葡萄球菌、化脓性链球菌等。整合素不仅能介导病原菌与宿主细胞的黏附,并且与细胞信号转导具有密切的联系,有研究表明,耶尔森菌外膜蛋白侵袭素促进β1整合素的聚合,激活酪氨酸激酶,引起细胞骨架中肌动蛋白的重排,从而促进病原菌的入侵[11, 12]。
病原菌与宿主细胞特异性黏附机制有两种:一是直接黏附,即细菌自身表面的黏附素可直接与宿主细胞表面的受体结合,如大肠杆菌、李斯特菌[13]、耶尔森菌[14]和淋病奈瑟菌[15]。二是间接黏附,即宿主细胞自身向胞外产生的一些大分子物质,如细胞外基质(extracellular matrix,ECM),这些大分子物质能促进宿主细胞与病原菌的结合,从而达到黏附目的。这些细菌具有与细胞外基质结合的能力,一般是一些革兰氏阳性菌,如链球菌和葡萄球菌[16]。
细菌与宿主细胞发生黏附是一个复杂的过程,不仅仅通过细菌与宿主细胞的一些表面结构来完成。例如,肠致病性大肠杆菌(enteropathogenic Escheri- chia coli,EPEC)和肠出血性大肠杆菌(enterohem-orrhagic Escherichia coli,EHEC)。EPEC/EHEC的束状菌毛对宿主细胞进行黏附,然后经过III型分泌系统分泌的细菌效应物Tir嵌入到宿主细胞膜上,与细菌表面的外膜蛋白紧密素(Intimin)相互结合,促进细菌与宿主细胞的进一步结合,与此同时,结合的部位会形成一个基座。基座的形成是通过Tir与 intimin相互作用,被磷酸化了的Tir诱导蛋白质适配器NCK,使得神经综合征蛋白(neuronal wiskott-aldrich syndrome protein,N- WASP)和Arp2 / 3复合物(actin-related protein 2/3)募集到细菌与宿主细胞结合的部位,导致黏附部位的肌动蛋白聚合从而形成一个基座[17]。肌动蛋白结合蛋白如踝蛋白会被募集到基座,用来稳定其的结构。
2 细菌侵袭进入宿主细胞细菌入侵宿主细胞的过程中会伴随着肌动蛋白细胞骨架的重新排列。细菌进入非吞噬细胞的机制有拉链式机制和触发式机制[18]:(1)拉链式机制指细菌通过与宿主细胞发生黏附,调节宿主细胞内的一系列信号通路,从而导致细胞骨架发生重排,细胞表面的膜形成伪足,包裹于细菌周围,细菌内陷于细胞膜[19]。此过程不发生大规模的细胞骨架重排。依靠这种入侵机制,典型的细菌有耶尔森菌、产单核细胞李斯特菌和金黄色葡萄球菌[12, 20]。(2)触发式机制与前者相比,此过程会引起大规模的细胞骨架重排,在细菌与宿主细胞表面结合的过程中,宿主细胞膜上会在临近入侵细菌的表面形成大型片状或者伪足样结构,将细菌卷入到细胞内[18]。这种入侵机制的典型细菌有志贺氏菌和沙门氏菌。细菌入侵细胞伴随着细胞骨架的重排,细胞骨架发生重排,则是由于细菌与宿主细胞发生黏附的过程中,模拟了宿主信号传递最终导致细胞骨架重排。黏着斑激酶(focal adhesion kinase,FAK)、GTP酶通过对相关蛋白的酪氨酸磷酸化,产生一系列对下游分子的级联反应,最终导致细胞骨架发生重排。例如,GTP酶Rho家族中有Rac、Cdc42、Rho,它们是调控肌动蛋白的主要成员。细胞外基质可诱导Rac活化,调节片状伪足的形成,Cdc42诱导迁移细胞前沿肌动蛋白丝状伪足的形成。细菌激活宿主的蛋白激酶不仅仅依赖黏附的过程,有时,病原菌分泌的毒力因子可以直接进入到非吞噬细胞中,与宿主细胞中的蛋白激酶发生作用,从而控制与调节细胞骨架的重排。沙门氏菌产生一些易位效应蛋白,这些效应物可以促进细菌的初始入侵。易位蛋白SipC经过III型分泌系统,进入宿主细胞,促使肌动蛋白聚合并且与F-actin结合;同时SopE激活Rho GTP酶,促进肌动蛋白聚合和膜皱褶形成[21]。志贺氏菌通过III型分泌系统分泌的蛋白OspE作用在整合素的相关酶上,可以促进整合素和黏着斑的表达量上调,并且表达黏着斑的运动能力降低,从而使得黏附细胞外基质的能力提高[22]。
3 细胞黏着斑激酶与细菌入侵FAK是一类胞质非受体蛋白酪氨酸激酶,可以整合许多细胞外信号,如整合素和机械牵拉等。FAK是相关联的非受体和非膜蛋白酪氨酸激酶(protein- tyrosine kinase,PTK)[23],其不含有与Src蛋白的SH2(Src homology 2)或SH3(Src homology 3)相互作用的结构域。与FAK有关的PTK已经被分离,包括黏着斑激酶β(cell adhesion kinaseβ,CAKβ),蛋白酪氨酸激酶2(proline-rich tyrosine kinase 2,PYK2),相关黏附斑酪氨酸激酶(related adhesion focal tyrosine kinase,RAFTK),钙依赖型酪氨酸激酶(calcium-dependent protein-tyrosine kinase,CADTK)和黏着斑激酶2(focal adhesion kinase 2,FAK- 2)[24-27]。FAK主要包含3个结构域:N末端结构域含有FERM区域,它是整合素的作用位点。当病原菌与宿主细胞发生黏附之后,随之整合素被激活,整合素β亚基的胞内部分与FAK结合,进而通过Src、磷脂酰肌醇3激酶(phosphtidylinositol 3-kinase,PI3K)等通路将胞外基质的信号导入胞内,引起肌动蛋白的聚合。中间的激酶结构域(PTK),可以激活下游的通路。FAK至少含有6个酪氨酸位点,分别是Tyr-397、Tyr-407、Tyr-576、Tyr-577、Tyr-861和Tyr-925[28, 29]。Tyr-397是FAK主要的磷酸化部位,可以发生自体磷酸化[30]。磷酸化的Tyr-397可以与Src的SH2结构域结合[31],形成复合体,并且激活下游通路。FAK的C末端结构域(FAT)约100个氨基酸,起到黏着斑靶向定位的功能,FAT可以与桩蛋白(Paxillin)[32]和裸蛋白(Talin)[33]结合,从而引起肌动蛋白(Actin)的聚合。在激酶结构域和FAT结构域之间,含有两个脯氨酸基序,其中靠近C末端结构域的脯氨酸基序能够与GTPase的SH3结构域结合[34, 35]。GRAF是RhoGTPases的激活蛋 白,RhoGTPases参与细胞骨架重建并在细胞外信号转导到细胞内发挥着重要的作用。前述我们知道细菌与宿主细胞相互作用,模拟信号转导机制,引起局部肌动蛋白丝聚合,促进细菌内化。FAK在这一过程中发挥着关键的调节作用。
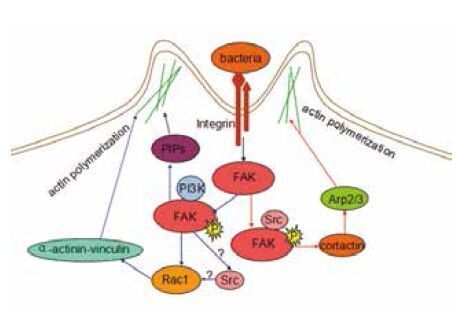
FAK参与细菌入侵的过程,是由整合素介导的细菌引起的细胞内化。例如,尿路致病性大肠杆菌入侵膀胱细胞(图 1)。尿路致病性大肠杆菌的菌毛是I型菌毛,编码菌毛的基因是fim基因,I型菌毛首先对宿主细胞进行黏附,整合素α3β1是宿主细胞的黏附受体。菌毛FimH通过识别整合素N端链接的甘露糖聚糖残基,并逐个地与整合素子集α3和β1进行固定[36],与此同时,整合素和F-actin不断地被募集到细菌的黏附部位。在细菌黏附部位,整合素募集并激活宿主细胞内多种适配器,从而引起细胞信号转导,产生细胞骨架的重排,进一步促进细菌的入侵。整合素能够募集和激活FAK、Src和Rho家族的GTP酶[37]。活化的FAK与PI3K形成瞬时复合物,产生一些磷脂酰磷酸盐(Phosphotidylinositides,PIPs),这些磷脂酰磷酸盐作为第二信号,可以调节肌动蛋白的动力,一些纽蛋白和α辅肌动蛋白参与到细胞骨架的重排[38-40]。与此同时,Rho家族GTP酶中的Rac1也促进细菌入侵位点的细胞骨架重排。
|
| 图 1 细菌入侵非吞噬细胞的信号通路 蓝色箭头:尿路致病性大肠杆菌入侵膀胱细胞;红色箭头:金黄色葡萄球菌入侵293细胞的信号通路 尿路致病性大肠杆菌通过两条途径侵入细胞中:(1)磷酸化的FAK与PI3K形成瞬时复合物产生PIPs,PIPs产生第二信号,调节肌动蛋白的聚合;(2)FAK-PI3K复合物激活下游的Rac1和Rac1调控α-辅肌动蛋白和纽蛋白,使得肌动蛋白聚合促进其侵入细胞。Src参与调控细菌入侵,其具体机制尚不明确。金黄色葡萄球菌通过整合素激活FAK,磷酸化的FAK与Src形成复合物。FAK—Src复合物作用于皮层肌动蛋白,调控Arp2/3复合物,促进其侵入细胞 |
在金黄色葡萄球菌入侵非吞噬细胞的过程(图 1),金黄色葡萄球菌表面表达的纤连蛋白结合蛋白FnBPs,也称作金黄色葡萄球菌的黏附素,以纤连蛋白Fn为桥梁,将细菌表面的FnBPs和α5β1整合素连接起来[41]。研究表明,缺失FnBPs的菌株突变体会丧失入侵的功能。还有一种热休克蛋白,可以与整合素形成共受体,通过Fn为桥梁,将细菌与宿主细胞进行连接,产生细胞的内化[42],但是这个作用的机制在真核细胞中还不清楚。在金黄色葡萄球菌入侵293T细胞时,由整合素介导的细菌入侵,不仅可以促进FAK在入侵位点的聚集,还能募集一些相关的蛋白,如张力蛋白、纽蛋白等。有研究表明,缺陷型的FAK[43]和缺陷型的Src[44]细胞可以抵制金黄色葡萄球菌的入侵。这表明,FAK在细菌入侵宿主细胞的过程中发挥重要的作用。被整合素募集并激活的FAK在其397位点上发生自体磷酸化,并与Src结合形成复合物,FAK和Src复合物可以使肌动蛋白的相关蛋白产生磷酸化,从而调控下游的信号通路。皮层肌动蛋白是Src的一个重要底物,在细菌入侵过程中的作用尤为重要。皮层肌动蛋白是肌动蛋白的结合蛋白,它是许多信号转导的枢纽,并参与Arp2 / 3复合物的聚集(皮层肌动蛋白的NTA(N-terminal acidic motif)结构域能够与Arp2 / 3复合物结合[45],被激活的Arp2 / 3复合物能使肌动蛋白生成支细丝,并保持70度角[46]),Arp2 / 3复合物调控肌动蛋白的聚合,肌动蛋白能够控制细胞骨架的重排,从而促进病原菌或病毒的入侵。另一条控制肌动蛋白的通路是,皮层肌动蛋白的SH3结构域结合并激活N-WASP[47, 48],N-WASP激活Arp2/3复合物,使得肌动蛋白进行聚合。
已有许多实验证明,FAK调控细菌入侵细胞的过程。李斯特菌、假结核耶尔森菌、大肠杆菌、引发脑膜炎的奈瑟氏菌等,在这些细菌入侵的过程中,FAK均起到重要的作用。总而言之,细菌入侵细胞会伴随着胞内黏着斑激酶、Src酶、GTP酶、磷脂酸-3-激酶等产生细胞信号通路转导,最终引起肌动蛋白聚合,细胞骨架发生重排,促进细菌的入侵。
4 展望细菌与宿主之间的相互作用机制是目前研究的热点。细菌改变并利用宿主细胞信号转导系统,引起肌动蛋白细胞骨架重排,使其侵入到非吞噬细胞中,FAK起着关键的调控作用。但是,是否还有其他的蛋白分子也参与调控细菌入侵的过程;这些蛋白分子参与调控细菌入侵的过程是独立于FAK还是与FAK协同调控?这些问题还需要进一步的探索。细菌侵入非吞噬细胞可以逃避免疫攻击,再加上抗生素抗药性的问题给有效治疗细菌感染增加了难度,细菌在侵入非吞噬细胞中的调控机制研究为抗菌治疗提供了新的思路,除了利用抗生素还可通过抑制其侵入和对宿主细胞功能的影响来治疗胞内菌的感染。深入研究细菌在侵入非吞噬细胞中的分子机制为寻找新药物靶点和探索新抗菌药奠定理论基础。
| [1] | 郭晓奎, 童善庆. 细胞微生物学[M]. 上海: 第二军医大学出版社, 2004 : 94-96. |
| [2] | Kline KA, Fälker S, Dahlberg S, et al. Bacterial adhesins in host-microbe interactions[J]. Cell Host Microbe, 2009, 6 : 580–592. |
| [3] | Pizarro-Cerdá J, Cossart P. Bacterial adhesion and entry into host cells[J]. Cell, 2006, 124(4) : 720–727. |
| [4] | Hultgren SJ, Normark S, Abraham SN. Chaperoneassisted assembly and molecular architecture of adhesive pili[J]. Annu Rev Microbiol, 1991, 45 : 383–415. |
| [5] | Wolfgang M, van Putten JP, Hayes SF, et al. Components and dynamics of fiber formation define a ubiquitous biogenesis pathway for bacterial pili[J]. EMBO J, 2000, 19(23) : 6408–6418. |
| [6] | Foster TJ, Geoghegan JA, Ganesh VK, et al. Adhesion, invasion and evasion:The many functions of the surface proteins of Staphylococcus aureus[J]. Nat Rev Microbiol, 2014, 1 : 49–62. |
| [7] | Stones DH, Krachler AM. Fatal attraction:how bacterial adhesins affect host signaling and what we can learn from them[J]. Int J Mol Sci, 2015, 16(2) : 2626–2640. |
| [8] | B?lin I, Wolf-Watz H. Molecular cloning of the temperature-inducible outer membrane protein 1 of Yersinia pseudotuberculosis[J]. Infect Immun, 1984, 43(1) : 72–78. |
| [9] | Juliano RL. Signal transduction by cell adhesion receptors and the cytoskeleton:functions of integrins, cadherins, selectins, and immunoglobulin-superfamily members[J]. Annu Rev Pharmacol Toxicol, 2002, 42 : 283–323. |
| [10] | El Tahir Y, Skurnik M. YadA, the multifaceted Yersinia adhesion[J]. Int J Med Microbiol, 2001, 291(3) : 209–218. |
| [11] | Isberg RR, Barnes P. Subversion of integrins by enteropathogenic Yersinia[J]. J Cell Sci, 2001, 114(1) : 21–28. |
| [12] | Boyle EC, Finlay BB. Bacterial pathogenesis:exploiting cellular adherence[J]. Curr Opin Cell Biol, 2003, 15(5) : 633–639. |
| [13] | Pizarro-Cerdá J, et al. Entry of Listeria monocytogenes in mammalian epithelial cells:an updated view[J]. Cold Spring Harb Perspect in Med, 2012, 2(11) : a010009. |
| [14] | Isberg RR, Leong JM. Multiple beta 1 chain integrins are receptors for invasin, a protein that promotes bacterial penetration into mammalian cells[J]. Cell, 1990, 60(5) : 861–871. |
| [15] | N?gele V, Heesemann J, Schielke S, et al. Neisseria meningitids adhesin NadA targets β1 integrins:functional similarity to Yersinia invasin[J]. J Biol Chem, 2011, 286(23) : 20536–20546. |
| [16] | Hoffmann C, et al. Integrin-mediated uptake of fibronectin-binding bacteria[J]. Eur J Cell Biol, 2011, 90(11) : 891–896. |
| [17] | Campellone KG, Leong JM. Nck-independent actin assembly is mediated by two phosphorylated tyrosines within enteropathogenic Escherichia coli Tir[J]. Mol Microbiol, 2005, 56(2) : 416–432. |
| [18] | 张湘燕, 郭晓奎, 刘晶星, 等. 细菌利用宿主肌动蛋白细胞骨架进入非吞噬细胞的机制[J]. 细胞生物学杂志, 2002, 24(3) : 155–158. |
| [19] | Swanson JA, Baer SC. Phagocytosis by zippers and triggers[J]. Trends Cell Biol, 1995, 5(3) : 89–93. |
| [20] | Alva-Murillo N, López-Meza JE, Ochoa-Zarzosa A. Nonprofessional Phagocytic Cell Receptors Involved in Staphylococcus aureus Internalization[J]. Biomed Res Int, 2014, 2014 : 538–546. |
| [21] | Hardt WD, Chen LM, Schuebel KE, et al. S. typhimurium encodes an activator of Rho GTPases that induces membrane ruffling and nuclear responses in host cells[J]. Cell, 1998, 5 : 815–826. |
| [22] | Kim M, Ogawa M, Mimuro H, et al. Reinforcement of epithelial cell adhesion to basement membrane by a bacterial pathogen as a new infectious stratagem[J]. Virulence, 2010, 1(1) : 52–55. |
| [23] | Parsons JT, Parsons SJ. Src family protein tyrosine kinases:cooperating with growth factor and adhesion signaling pathways[J]. Curr Opin Cell Biol, 1997, 9(2) : 187–192. |
| [24] | Sasaki H, Nagura K, Ishino M, et al. Cloning and kinase characterization of cell adhesion kinase beta, a novel protein-tyrosine kinase of the focal adhesion subfamily[J]. J Biol Chem, 1995, 270(36) : 21206–21219. |
| [25] | Lev S, Moreno H, Martinez R, et al. Protein tyrosine kinase PYK2 involved in Ca2+-induced regulation of ion channel and MAP kinase functions[J]. Nature, 1995, 376(6543) : 737–745. |
| [26] | Avraham S, London R, Fu Y, et al. J Biol Chem, 1995, 270:27742-27751[J]. J Biol Chem, 1995, 270 : 27742–27751. |
| [27] | Yu H, Li X, Marchetto GS, et al. Activation of a novel calcium-dependent protein-tyrosine kinase[J]. J Biol Chem, 1996, 271(47) : 29993–29998. |
| [28] | Calalb MB, et al. Tyrosine phosphorylation of focal adhesion kinase at sites in the catalytic domain regulates kinase activity:a role for Src family kinases[J]. Mol Cell Biol, 1995, 2 : 954–963. |
| [29] | Schlaepfer DD, Hunter T. Evidence for in vivo phosphorylation of the Grb2 SH2-domain binding site on focal adhesion kinase by Src-family protein-tyrosine kinases[J]. Mol Cell Biol, 1996, 16(10) : 5623–5633. |
| [30] | Burgaya F, Toutant M, Studler JM, et al. Alternatively spliced focal adhesion kinase in rat brain with increased autophosphorylation activity[J]. J Biol Chem, 1997, 272(45) : 28720–28725. |
| [31] | Schwartz MA, et al. Integrins:emerging paradigms of signal transduction[J]. Annu Rev Cell Dev Biol, 1995, 11 : 549–599. |
| [32] | Brown MC, et al. Identification of LIM3 as the principal determinant of paxillin focal adhesion localization and characterization of a novel motif on paxillin directing vinculin and focal adhesion kinase binding[J]. J Cell Biol, 1996, 135(4) : 1109–1123. |
| [33] | Chen HC, Appeddu PA, Parsons JT, et al. Interaction of focal adhesion kinase with cytoskeletal protein talin[J]. J Biol Chem, 1995, 270(28) : 16995–16999. |
| [34] | Hildebrand JD, Taylor JM, Parsons JT. An SH3 domain-containing GTPase-activating protein for Rho and Cdc42 associates with focal adhesion kinase[J]. Mol Cell Biol, 1996, 16(6) : 3169–3178. |
| [35] | Ohba T, Ishino M, Aoto H, et al. Interaction of two proline-rich sequences of cell adhesion kinase beta with SH3 domains of p130Cas-related proteins and a GTPase-activating protein[J]. Biochem J, 1998, 330(Pt 3) : 1249–1254. |
| [36] | Eto DS, Jones TA, Sundsbak JL, et al. Integrin-mediated host cell invasion by type 1-piliated uropathogenic Escherichia coli[J]. PLoS Pathog, 2007, 3(7) : e100. |
| [37] | Martinez JJ, Hultgren SJ. Requirement of Rho-family GTPases in the invasion of Type 1-piliated uropathogenic Escherichia coli[J]. Cell Microbiol, 2002, 4(1) : 19–28. |
| [38] | Shoelson SE, Sivaraja M, Williams KP, et al. Specific phosphopeptide binding regulates a conformational change in the PI 3-kinase SH2 domain associated with enzyme activation[J]. EMBO J, 1993, 12(2) : 795–802. |
| [39] | Yin HL, Janmey PA. Phosphoinositide regulation of the actin cytoskeleton[J]. Annu Rev Physiol, 2003, 65 : 761–789. |
| [40] | Hartwig JH, Bokoch GM, Carpenter CL, et al. Thrombin receptor ligation and activated Rac uncap actin filament barbed ends through phosphoinositide synthesis in permeabilized human platelets[J]. Cell, 1995, 82(4) : 643–653. |
| [41] | Joh D, Wann ER, Kreikemeyer B, et al. Role of fibronectin-binding MSCRAMMs in bacterial adherence and entry into mammalian cells[J]. Matrix Biol, 1999, 18(3) : 211–223. |
| [42] | Dziewanowska K, Carson AR, Patti JM, et al. Staphylococcal fibronectin binding protein interacts with heat shock protein 60 and integrins:role in internalization by epithelial cells[J]. Infect Immun, 2000, 68(11) : 6321–6328. |
| [43] | Agerer F, Lux S, Michel A, et al. Cellular invasion by Staphyloco-ccus aureus reveals a functional link between focal adhesion kinase and cortactin in integrin-mediated internalization[J]. J Cell Sci, 2005, 118 : 2189–2200. |
| [44] | Agerer F, Lux S, Michel A, et al. Cellular invasion by Staphyloco-ccus aureus reveals a functional link between focal adhesion kinase and cortactin in integrin-mediated internalisation[J]. J Cell Sci, 2005, 118(10) : 2189–2200. |
| [45] | Martinez-Quiles N, et al. Erk/Src phospho-rylation of cortactin acts as a switch on-switch off mechanism that controls its ability to acti-vate N-WASP[J]. Mol Cell Biol, 2004, 12 : 5269–5280. |
| [46] | Pollard TD, Cooper JA. Actin, a central player in cell shape and movement[J]. Science, 2009, 326(5957) : 1208–1212. |
| [47] | Kurisu S, Takenawa T. The WASP and WAVE family proteins[J]. Genome Biol, 2009, 10(6) : 226. |
| [48] | Martinez-Quiles N, Ho HY, Kirschner MW, et al. Erk/Src phosphorylation of cortactin acts as a switch on switch off mechanism that controls its ability to activate N-WASP[J]. Mol Cell Biol, 2004, 24(12) : 5269–5280. |




