分子生物学是支撑现代昆虫学发展的一项关键技术[1, 2]。 随着分子生物学的发展,从核酸分子水平上对昆虫进行物种鉴定、物种多样性评估以及物种亲缘关系的研究,是目前重要的研究手段[3]。而有效的基因组DNA提取方法无疑是昆虫分子生物学研究的重要前提。蜜蜂为群居动物,世界各地均有分布,在传授花粉的过程中扮演着至关重要的角色[4-6]。关于从蜜蜂组织提取DNA 的方法已有报道,但仍以新鲜标本、酒精浸泡和冷冻保存标本为对象[7-11],以干标本为实验材料提取总DNA的报道极少见[12]。在实际工作中,很难直接用新鲜标本和冷冻标本进行试验,野外通常以酒精泡制和干制方法收集标本。酒精浸泡虽然能更好地保护DNA,但因携带不便并容易导致标本关键鉴定部位褪色。因此,在实际野外取材工作中,多数标本都是以干标本带回实验室,并经回软后针插制成干标本。目前,最简便且无害的回软方法为水蒸汽回软法,但DNA 化学性质极不稳定,可以通过水解或氧化作用自发地降解[13],而且高温也会加剧DNA的分解,干标本再经放置更加大了提取DNA 的难度。另外,尚未有人对蜜蜂不同部位DNA的提取效果进行研究。因此,本实验参照传统的SDS-饱和酚氯仿法通过对不同处理方式和保存方式的蜜蜂标本4个部位进行DNA提取比较,旨在以蜜蜂为对象针对干标本制作过程中回软这一关键操作提供数据支持,同时也为标本DNA的提取工作提供更好的选择方案。
1 材料与方法 1.1 材料 1.1.1 实验标本蜜蜂标本均采自山西省大同市兴云街大同大学北校区,经鉴定为膜翅目蜜蜂科蜜蜂属西方蜜蜂(Apis mellifera linnaeus,1758)。新鲜标本经无水乙醇或乙酸乙酯短暂处理,干标本均采用数显恒温水浴锅隔水蒸汽回软1.5 h。
1.1.2 实验仪器及试剂HC-3018R高速冷冻离心机(安徽中科中佳),DYY-10C电泳仪(北京六一),Tannon 1600凝胶成像系统(上海天能科技),DTC PCR仪(西安天隆科技),UPH-Ⅱ-60L优普系列超纯水机(成都超纯科技有限公司),HH-6数显恒温水浴锅(金坛市国旺实验仪器厂),蛋白酶K,Gold View Ⅰ型核酸染液,DL2000 Plus Marker(宝生物工程),2×Taq PCR StarMix with Loading Dye,Direct-LoadTM λ DNA/HindIII Marker(北京华大基因),16S rRNA及CO Ⅰ引物(上海生工),软件:Quantity One。
1.2 方法 1.2.1 蜜蜂DNA的提取方法所有标本提取DNA前均使用超纯水冲洗数秒后用滤纸除去残余水分,之后采用传统的蛋白酶K消化-饱和酚氯仿抽提法进行蜜蜂DNA的提取[14]。对传统方法进行部分改良,恒温水浴消化2 h后补加酶液50 μL以提高消化水平。饱和酚氯仿抽提前,使用TE溶液补加体系至800 μL以减少抽提过程中的损失。
1.2.2 琼脂糖凝胶电泳及定量分析总DNA点样于0.8%的琼脂糖凝胶,PCR产物点样于1.5%的琼脂糖凝胶(均含5%的Gold ViewerⅠ型核酸染液),80 V电泳60 min,至凝胶成像系统观察并拍照保存。正交实验电泳图采用软件Quantity One对目标条带区进行光密度测定作为定量分析依据。
1.2.3 正交试验设计根据单因素实验的结果,采用L16(42)正交表,研究不同温度处理和提取部位对DNA提取结果的影响。正交试验的两因素四水平如 表 1 。
以新鲜标本的足部,无水乙醇浸泡标本的足部,自然干燥保存标本的头部、胸部、腹部、足部及正交实验各部位最优水平提取到的DNA为模板,采用线粒体DNA中16S rDNA通用引物(上游引物:5′-TTATTCACCTGTTTAWCAAAAACAT-3′和下游引物:5′-TATAGATAGAAACCAATCTG-3′)和CO Ⅰ通用引物(上游引物:5′-AATTGGWGGWTTYGGAAAYTG-3′ 和下游引物:5′-GGTAATCAGAGTATCGWCGNGG-3′)(简并碱基W代表A/T,简并碱基N代表A/T/G/C)进行PCR扩增[15, 16]。PCR反应体系为10 μL,其中模板DNA 0.5 μL,上游引物和下游引物各1.25 μL,PCR Taq Mix 5 μL,ddH2O 2 μL。PCR扩增程序为93℃预变性1 min;92℃变性10 s,54℃退火30 s,68℃延伸1 min,15个循环后,每循环一次延伸时间延长10 s再进行15个循环;68℃再延伸7 min,最后4℃保温。
2 结果 2.1 新鲜标本总DNA的提取结果用饱和酚法分别对经乙酸乙酯和无水乙醇收集的新鲜蜜蜂标本进行体细胞DNA的提取,提取样品经电泳检测,结果如 图 1 所示。从无水乙醇收集标本的4个部位均可提取到总DNA,且条带清晰、明亮、基本成线形,但其中4个DNA样品均在同一位置出现另一条条带。而乙酸乙酯收集新鲜标本中,足部DNA提取效果最佳,腹部DNA基本降解。

|
| 图 1 乙酸乙酯(A)及无水乙醇(B)处理后的新鲜蜜蜂总DNA提取结果 M:DNA分子量标准;H:头部;C:胸部;A:腹部;L:足部;1:平行样中的第1个样品;2:平行样中的第二个样品 |
用饱和酚法分别对经无水乙醇浸泡和自然干燥后室温保存半年的蜜蜂标本进行体细胞DNA的提取,结果如 图 2 所示。两种保存方式对标本DNA完整度影响均较小。从无水乙醇浸泡标本获得的总DNA条带清晰,谱带整齐明亮,且无拖尾现象,但其中多数DNA样品也均在同一位置出现另一相对分子质量较小的条带。对于自然干燥处理室温保存半年的蜜蜂标本,由足部提取的DNA条带单一,较为清晰,而胸部提取的DNA条带略淡。

|
| 图 2 无水乙醇浸泡(A)及自然干燥(B)室温保存半年后的蜜蜂总DNA提取结果 M:DNA分子量标准;H:头部;C:胸部;A:腹部;L:足部;1:平行样中的第1个样品;2:平行样中的第二个样品 |
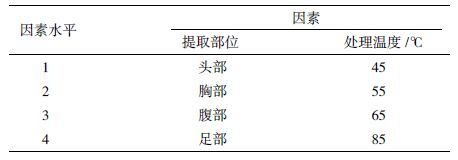
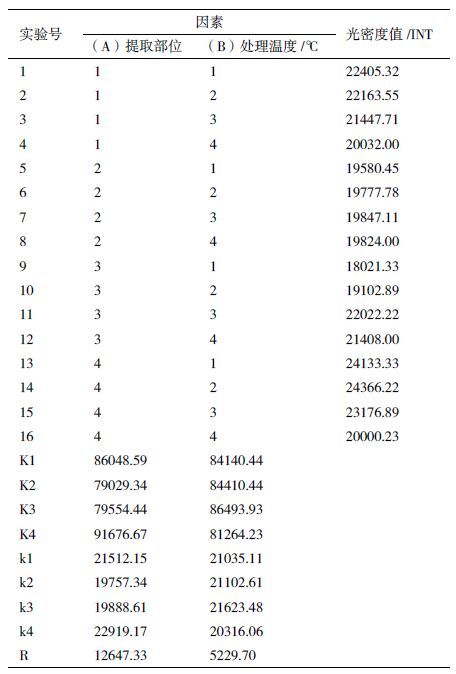
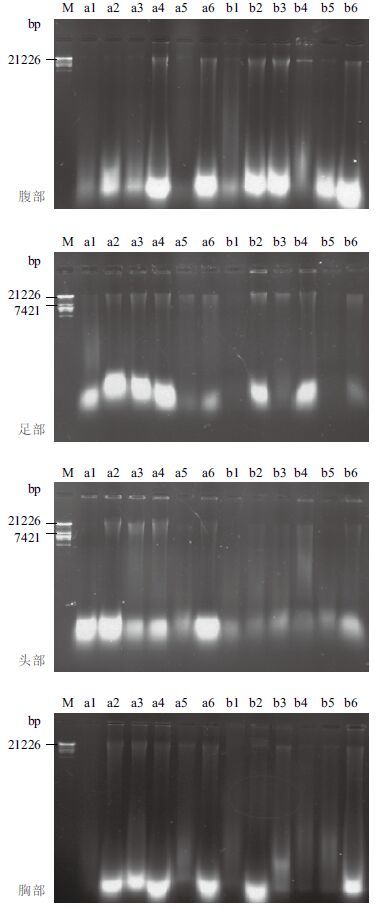
经6个温度回软后保存半年的蜜蜂干标本DNA提取结果如 图 3 所示,4个回软温度(45℃、55℃、65℃和85℃)对各部位DNA的破坏性较小;95℃高温水汽回软后,蜜蜂干标本各部位的DNA几乎完全降解,仅在腹部呈现一条很淡的条带;75℃回软后仅胸部和腹部有一条弱带,头部和足部均未有条带出现。蜜蜂4个部位中,头部经高温水汽回软后DNA条带均呈现弥散状;胸部、腹部和足部提的DNA条带相对清晰完整,受回软温度的影响较小。
|
| 图 3 回软处理后蜜蜂总DNA提取结果 M:DNA分子量标准;1-6:依次表示95℃、45℃、55℃、65℃、75℃和85℃水汽回软的蜜蜂标本;a:平行样中的第一个样品;b:平行样中的第二个样品 |
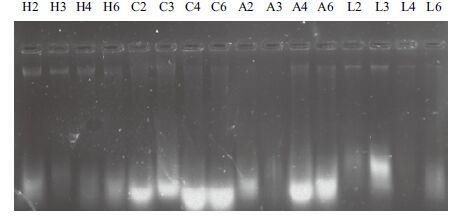
通过分析正交实验电泳图,结果如 图 4 和 表 2 所示,A因素对应的最佳水平为4(足部),B因素对应的最佳水平为3(65℃处理)。DNA保存条件的最佳组合为55℃回软标本的足部,较优水平为45℃、65℃回软标本的足部和45℃、55℃回软标本的头部。
|
| 图 4 正交实验中蜜蜂总DNA的凝胶电泳图谱 H:头部;C:胸部;A:腹部;L:足部;2:45℃;3:55℃;4:65℃;6:85℃ |
实验中用16S rDNA和CO Ⅰ两对通用引物对随机选择的10个DNA样品进行了扩增,结果( 图 5 )显示,以不同的DNA样品做模板,均在相应的位置扩增出目的条带(CO Ⅰ片段的长度约为1 000 bp,16S rDNA片段的长度约为600 bp)。因此,通过本实验提取的DNA均可用于后续的PCR扩增。
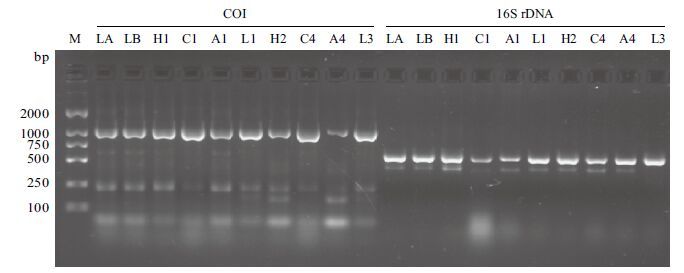
|
| 图 5 不同模板DNA的PCR扩增产物 LA:新鲜标本足部;LB:无水乙醇浸泡标本足部;H1,C1,A1,L1:自然干燥标本头部、胸部、腹部、足部;H2:45℃回软标本头部;C4:65℃回软标本胸部;A4:65℃回软标本腹部;L3:55℃回软标本足部 |
蜜蜂基因组DNA提取的研究报道集中于探讨提取方法和保存方式对DNA提取效果的影响。目前主要采用传统方法提取蜜蜂DNA[7, 11, 12, 17, 18],但也有学者根据不同的应用目的,尝试用新型方法对蜜蜂DNA进行提取[9, 19],获得较好的效果。关于干燥及保存方法对蜜蜂标本DNA完整性的影响也有相关报道[17, 18],但是不同保存方式中蜜蜂不同部位的DNA保存效果,以及不同回软温度对干标本DNA的损害度均未见报道。
本实验通过研究保存方式、提取部位、回软操作对蜜蜂标本DNA提取效果的影响,结果发现新鲜标本或久置标本均以无水乙醇固定后提取的DNA质量最佳。干标本制作前回软操作对DNA影响较大,明显劣于自然干燥保存半年标本的DNA提取效果。4个部位相比较,足部DNA提取效果最佳,而且不影响蜜蜂标本的形态鉴定。新鲜标本经乙酸乙酯处理后提取的DNA质量略差,这可能与前期处理有密切的联系。因新鲜标本组织含胞液较多,使用镊子夹取较困难,花费时间较长。而且整个解剖过程均在室温下进行,胞液中本身含有众多核酶,由于酶的高效性,短时间也会对DNA造成严重的降解。而新鲜标本若经无水乙醇短暂固定后,组织失去大部分胞液,一方面可以极大的缩短解剖所用的时间;另一方面,自由水的缺失在一定程度上抑制了胞内核酶的活性,从而减少了DNA的损伤。因而在使用新鲜标本为材料时解剖工作宜在低温下进行,或者选择使用无水乙醇短暂固定后再进行后续操作。经无水乙醇短暂固定后的新鲜标本及无水乙醇浸泡保存半年的标本提取的DNA电泳图中,多数样品呈现出另一条明显的条带,本样品经RNase A消化电泳后,确证为RNA条带,这与季清娥等[12]和董霞等[20]认为第二条带为RNA污染条带结论相同。对于自然干燥保存半年后的蜜蜂标本,其DNA保存情况依然较为理想,而同期处理保存的蝗虫及蜻蜓干标本,发现有霉变现象且DNA发生严重降解,仅有个别标本成功提取到质量较好的DNA。因此,针对昆虫干标本,其DNA保存的难易程度应该具有种属差异性,这种差异可能与它们自身的生存环境、食性及自身代谢产生的某些具有抑菌作用的特殊化合物有关。
野外干标本通常需回软后针插制成储存干标本,考虑到回软操作对标本DNA的影响,本实验设置了6个水浴温度对标本进行回软,储存半年后进行DNA的提取。在单因素实验中发现,95℃蒸汽回软的蜜蜂标本中,DNA完全降解。剩余的5个梯度温度中,相较而言,75℃蒸汽回软的蜜蜂标本提取到的DNA效果较差。因此,在设计正交试验时,剔除95℃和75℃两个温度水平。比较蜜蜂标本不同部位的DNA提取结果发现,足部与头部DNA保存较完整,不易发生降解,能提取到高质量的DNA。和志娇等[17]认为,从蜜蜂足部提取DNA容易受到花粉DNA的污染,本实验以桃花新鲜花粉及自然干燥花粉为材料均未提取到DNA,因此蜜蜂的足部虽细小但完全能用于DNA的提取。另外,本研究中取蜜蜂标本前足、中足、后足各一只便可提取到满足实验研究要求的DNA,这对于从分子水平研究那些珍贵稀有标本具有重要的意义和价值。
正交实验结果中,通过分析样品目标条带的光密度值,发现温度对不同部位产生的影响是不一致的。对于足部和头部来说,随着温度的升高,其保存的完整DNA的量总体呈下降趋势;而对于腹部与胸部来说,随着温度的升高,其保存的完整DNA量总体呈上升趋势,这说明回软过程中DNA可能不仅发生了化学降解反应,还有可能伴随着部分的酶降解反应。对于足部和头部来说,以化学降解为主,温度越高降解越严重;而对于胸部和腹部来说,以酶降解为主,温度越低,降解程度越高。由部位来看,K4>K1>K3>K2,这说明与腹部及胸部相比较,蜜蜂足部和头部虽然所含组织较少,但提取出来的完整DNA量要比其多,与我们通常认为的组织越大,提取到的DNA越好相反。这提示我们在标本中获得高浓度、高质量的DNA主要取决于标本中所保留的完整DNA的量,样品虽少,但也可以获得高浓度的DNA,而取材的多少居于次要因素。因而在提取标本DNA时,不能一味追求选择大的组织或者通过增加组织量来祈求获得高浓度、高质量的DNA,更应该注重组织的保存状况。由温度来看,K3>K2>K1>K4,即对于整体来说,65℃回软保存的完整DNA量最多;55℃与45℃回软保存的完整DNA量次之,且55℃与45℃回软对标本整体总DNA量的影响几乎没有差别;而85℃回软保存的完整DNA量较少,说明标本回软过程中,并非温度越低,保存的完整DNA越多。回软温度的确定既要考虑高温造成的化学损伤,也应注意适当的高温可以通过抑制酶的活性减弱酶降解反应从而对DNA起到一定的保护作用。
4 结论通过本研究,我们发现从不同方式保存的蜜蜂标本中均可提取到较高质量的总DNA。同自然干燥法相比,回软操作明显破坏了蜜蜂DNA的稳定性,但65℃对DNA的破坏性最小。蜜蜂DNA提取的最佳部位为足部,DNA保存最完整。通过线粒体基因16S rDNA和CO Ⅰ保守片段的扩增,进一步证实本实验提取的总DNA质量较好。
| [1] | 马丽滨, 许升全. 蚂蚁DNA提取方法的研究[J]. 陕西师范大学学报:自然科学版, 2006, 34(1) : 85–87. |
| [2] | 韩芬霞. 猪肝脏基因组DNA提取与纯化的研究[J]. 安徽农业科学, 2006, 34(16) : 3980–3981. |
| [3] | 周丽, 李飞, 魏刚. 动物DNA提取方法概述[J]. 畜牧与兽医, 2008, 40(3) : 66–68. |
| [4] | Morse RA, Calderone NW. The value of honey bees as pollinators of U[J]. Bee Culture, 2000, 128 : 1–15. |
| [5] | 郑火青, 胡福良. 蜜蜂-新兴的模式生物[J]. 昆虫学报, 2009, 52(2) : 210–215. |
| [6] | 刘朋飞, 吴杰, 李海燕, 等. 中国农业蜜蜂授粉的经济价值评估[J]. 中国农业科学, 2011, 44(24) : 5117–5123. |
| [7] | Waldschmidt AM, Salomão TMF, Barros EGD, et al. Extraction of genomic dna from melipona quadrifasciata(hymenoptera:apidae,meliponinae)[J]. Brazilian Journal of Genetics, 1997, 20(3) : 421–423. |
| [8] | 董霞, 周丹银, 兰建强, 等. 东方蜜蜂DNA提取纯化和检测[J]. 中国养蜂, 1999, 50(4) : 3–4. |
| [9] | Chaline N, Ratnieks F, Raine N, et al. Non-lethal sampling of honey bee,Apis mellifera,DNA using wing tips[J]. Apidologie, 2004, 35 : 311–318. |
| [10] | Gould EM, Taylor MA, Holmes SJ. A more consistent method for extracting and amplifying DNA from bee wings[J]. Apidologie, 2011, 42(6) : 721–727. |
| [11] | 闫华超, 贾少波, 王雪梅. 不同方法保存的蜜蜂基因组DNA提取的比较[J]. 生物技术通讯, 2011, 22(5) : 726–732. |
| [12] | 季清娥, 杨建全, 吕宝乾, 等. 不同保存条件下茧蜂标本基因组DNA的降解[J]. 华东昆虫学报, 2005, 14(2) : 115–117. |
| [13] | 庞峻峰, 张亚平. 标本DNA的研究进展[J]. 动物学研究, 2001, 22(6) : 490–496. |
| [14] | Weeler WC, Cartwright P, Hayashi CY. Arthropod phylogeny:a combined approach[J]. Cladistics, 1993, 9(1) : 1–39. |
| [15] | Cameron SA, Derr JN, Austin AD, et al. The application of nucleotide sequence data to phylogeny of the Hymenoptera:a review[J]. J Hym Res, 1992, 1(1) : 63–79. |
| [16] | Simon C, Buckley TR, Frati F, et al. Incorporating molecular evolution into phylogenetic analysis,and a new compilation of conserved polymerase chain reaction primers for animal mitochondrial DNA[J]. Annu Rev Ecol Evol Syst, 2006, 37 : 545–579. |
| [17] | 和志娇, 谭宏伟, 徐中志, 等. 蜜蜂基因组DNA提取方法的改良[J]. 西南农业学报, 2008, 21(2) : 491–493. |
| [18] | Issal MRC, Figueiredo VC, Jong DD, et al. Rapid method for DNA extraction from the honey bee Apis mellifera and the parasitic bee mite Varroa destructor using lysis buffer and proteinase K[J]. Genet Mol Res, 2013, 12(4) : 4846–4854. |
| [19] | 尉玮, 吴谦, 国占宝, 等. 斑马鱼基因组 DNA提取方法在蜜蜂上的尝试[J]. 蜜蜂杂志, 2013(10) : 6–8. |
| [20] | 董霞, 史宪伟, 汪建明, 等. 乙醇浸泡蜜蜂标本DNA的提取纯化[J]. 中国养蜂, 2001, 52(1) : 10–11. |