2. 复旦大学上海医学院 教育部/卫生部医学分子病毒学重点实验室,上海 200032
2. Key Laboratory of Medical Molecular Virology of the Ministry of Health and Ministry of Education,Shanghai Medical College,Fudan University,Shanghai 200032
新疆一枝篙(Artemisia rupestris L.)别名岩蒿,为菊科蒿属植物,是新疆哈萨克族和维吾尔族民间传统用药,其主要包括多糖类、黄酮类、生物碱等多种化学成分[1, 2],多糖为其主要活性成分,具有抗氧化、抗病毒、调节免疫系统等多种功能[3-6]。由于新疆一枝蒿具有极高的药用价值,野生一枝蒿难以满足需求,栽培一枝蒿已经成功在新疆大面积种植。国内学者对新疆一枝蒿的有效成分分离及药理作用做了大量的研究,但对一枝蒿多糖的免疫活性研究较少,尤其是比较野生与栽培一枝蒿多糖免疫活性的研究还未见报道。众所周知,DCs是体内功能最强的专职性抗原提呈细胞,未成熟DCs通过摄取抗原逐渐成熟,成熟DCs高表达共刺激分子MHCII、CD80,CD86、CD40等,并分泌多种细胞因子,从而启动初次免疫应答,发挥免疫调节作用[7, 8]。
本研究拟通过体外培养的小鼠骨髓来源DCs为平台,利用超声结合水提醇沉法[9, 10]制备新疆野生及栽培一枝蒿粗多糖,三氯乙酸法除蛋白[11, 12],蒽酮硫酸法测定多糖含量[13];流式细胞术检测小鼠DCs 表面分子CD40、CD86及CD80的表达水平和刺激后DCs抗原吞噬能力;ELASA法检测细胞培养上清中IL-12和TNF-α的分泌情况,研究和比较新疆野生与栽培一枝蒿粗多糖以及除蛋白与未除蛋白一枝蒿多糖对DCs成熟和功能的影响,旨在为开发利用新疆栽培一枝蒿提供参考,也为利用新疆药用植物筛选新型疫苗佐剂奠定一定的基础。
1 材料与方法 1.1 材料 1.1.1 动物与试剂5-6周,18-22 g的雌性C57BL/6小鼠购自新疆医科大学动物中心。新疆野生和栽培一枝蒿(市售)。BCA蛋白测量试剂盒购自Themo公司;RPMI-1640 培养液购自Gibco公司;胎牛血清购自以色列Bioind公司;流式抗体PE-CD11c、APC-CD40购自美国BD公司;IL-12、TNF-α ELISA试剂盒购自武汉博士德公司;石油醚、无水乙醇、三氯甲烷、正丁醇、蒽酮、葡萄糖等均为国产分析纯。
1.1.2 仪器超净工作台(Heal Force公司);旋转蒸发仪(上海亚荣生化仪器厂);全波长酶标仪(美国 Bio-TeK公司);磁力搅拌器(金坛市医疗仪器厂),二氧化碳培养箱(Heal Force公司);流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 新疆野生及栽培一枝蒿粗多糖的制备采用超声结合水提醇沉的方法,具体步骤如下:取适量新疆野生及栽培一枝蒿粉末,加入5倍体积的石油醚超声脱脂;加入5倍体积无水乙醇超声;抽滤干燥后加入10倍体积蒸馏水,37℃超声两次,离心合并上清,减压浓缩;加入无水乙醇静置醇沉12 h;真空抽滤烘干后得到新疆野生及栽培一枝蒿粗多糖粉末,-80℃保存备用。
1.2.2 新疆野生及栽培一枝蒿粗多糖sevage法除蛋白称取适量上述制备的新疆野生及栽培一枝蒿多糖粉末,加入100倍体积蒸馏水,磁力搅拌使其溶解,加入sevage试剂(氯仿∶正丁醇=4∶1)除蛋白,离心取上清,重复多次,减压浓缩;加入无水乙醇静置醇沉,真空抽滤干燥,得到除蛋白的新疆野生及栽培一枝蒿多糖粉末,-80℃保存备用。
1.2.3 新疆野生及栽培一枝蒿多糖含量和蛋白含量测定采用蒽酮-硫酸法检测上述制备的未除蛋白及除蛋白处理后样品中的多糖含量,以葡萄糖为标准品绘制标准曲线,得回归方程 A=0.696 8C+0.051 9,r=0.992 6,根据标准曲线方程计算样品中的多糖含量和得率。采用BCA蛋白测量试剂盒检测样品中的蛋白含量,以牛血清蛋白绘制标准曲线,得回归方程为 A=0.571 5C+0.081 6,r=0.998 7,根据标准曲线计算样品中的蛋白含量。
1.2.4 小鼠骨髓来源DCs的体外培养将C57BL/6小鼠颈椎脱臼处死,无菌状态下取股骨和胫骨,收集骨髓细胞,制成单细胞悬液,1 200 r/min离心5 min,弃上清。用含 10%血清的 RPMI-1640培养液调整细胞浓度至 1×107个/mL,加入20 ng/mL的GM-CSF,接种细胞于60 mm细胞培养皿中,置 37℃,5% CO2培养箱中培养。隔天半换液,第3天全换液。每日用显微镜观察细胞的形态和生长情况。第6天,离心收集培养的细胞,将细胞分组用于后续体外刺激实验。
1.2.5 新疆野生及栽培一枝蒿多糖体外刺激DCs选用野生一枝蒿粗多糖(Wild A. rupestris crude polysaccharides,WARCP),栽培一枝蒿粗多糖(Cultivated A. rupestris crude Polysacc-harides,CARCP),除蛋白的野生一枝蒿粗多糖(Deproteini-zation of wild A. rupestris crude Polysaccharides,DWARCP),除蛋白的栽培一枝蒿粗多糖(Deprotei-nization of cultivated A.rupestris crude polysaccharides,DCARCP)50 μg和250 μg两个剂量,分别进行体外刺激实验。上述培养的小鼠骨髓来源的DCs按1×106个/孔接种于24孔细胞培养板中,将DCs分成10组:WARCP 50 μg、WARCP 200 μg、CARCP 50 μg、CARCP 200 μg、DWARCP 50 μg、DWARCP 200 μg、DCARCP 50 μg、DCARCP 200 μg实验组,RPMI-1640阴性对照组和LPS ng/mL阳性对照组,将各种样品分别加入接种好的DCs中,每组3只小鼠进行独立重复实验,培养12 h后,用于后续检测。
1.2.6 流式细胞术检测一枝蒿多糖对小鼠DCs表面分子表达的影响一枝蒿多糖刺激小鼠骨髓来源的DCs 12 h 后,收集DCs,将细胞数调整为1×106个,进行表面分子染色,室温避光20 min,加入10 mL含0.5%胎牛血清的PBS,1 200× g离心10 min,加入300 μL PBS,过200目铜网,流式细胞术检测CD11c+CD40、CD11c+CD86及CD11c+CD80表达情况。
1.2.7 ELISA法检测一枝蒿多糖对DCs分泌细胞因子的影响分别收集上述各实验组刺激12 h后的DCs培养上清,应用ELISA kit检测细胞培养液上清中IL-12和TNF-α的含量,具体操作按 ELISA 说明书进行。反应终止后用酶标仪检测450 nm吸光值,根据标准曲线确定所测细胞因子的浓度。
1.2.8 流式细胞术检测一枝蒿多糖对小鼠DCs抗原吞噬能力的影响一枝蒿多糖刺激小鼠骨髓来源的DCs 12 h 后,各实验组加入25 μg/mL FITC-Dextran染色,37℃培养1 h,收集DCs,将细胞数调整为1×106个,加入10 mL含0.5%胎牛血清的PBS,1 200× g离心10 min,加入300 μL PBS,过200目铜网,流式细胞术检测CD11c+ Dextran表达情况。
1.2.9 统计学分析FlowJo 7.6 软件处理流式细胞术检测结果,利用 GraphPad Prism 5.0进行数据分析,数据均采用x±s,进行单因素方差分析和多组均数间的比较,差异显著标准为 P<0.05。
2 结果 2.1 新疆野生及栽培一枝蒿多糖含量和蛋白含量测定一枝蒿样品的多糖含量和蛋白含量检测结果如 表 1 所示,WARCP的多糖含量为26.18%,蛋白含量为22.23%,得率4.20%;DWARCP的多糖含量为30.94%,蛋白含量为10.67%,得率为0.88%;两者的多糖含量间无差异显著(P>0.05),蛋白含量和多 糖的得率差异显著(P<0.05)。CARCP的多糖含量 为22.14%,蛋白含量为17.69%,得率为6.50%;D- CARCP的多糖含量为27.06,蛋白含量为6.46%,得率为1.20%,两者的多糖含量间无差异显著(P>0.05),蛋白含量和多糖的得率差异显著(P<0.05),WARCP和CARCP的多糖含量、DWARCP和DCA-RCP的多糖含量间无显著差异(P>0.05)。
结果如 图 1 所示,WARCP和CARCP刺激DCs 12 h后,细胞群形态没有发生变化,与阴性对照相比,各实验组DCs的细胞数没有显著性差异(P>0.05)。

|
| 图 1 WARCP/CARCP对体外小鼠DCs细胞生长状态的影响 A:DCs细胞FSC-SSC流式图分析(x±s,n=3);B:DCs百分比(DCs+%),其中的小写字母相同表示各实验组之间没有显著性差异,P>0.05 |
DCs表面分子表达结果如 图 2 ,与未处理的DCs相比,WARCP和CARCP均能显著促进CD11c+CD40、CD11c+CD86及CD11c+CD80的表达(P<0.05);CD11c+CD40和CD11c+CD80的表达与阳性对照组LPS组相当(P>0.05),CD11c+CD86的表达高于阳性对照组(P<0.05);相同剂量的WARCP和CARCP对DCs成熟的促进作用没有显著性差异(P>0.05)。

|
| 图 2 WARCP/CARCP对体外小鼠DCs表面分子表达的影响 A,C,E:流式细胞术检测DCs 表面分子:CD40、CD86及CD80表达;B,D,F:DCs 表面CD40、CD86及CD80平均荧光强度(mean fluorescence intensity,MFI)检测结果(x±s,n=3),不同字母表示各组间差异显著(P<0.05) |
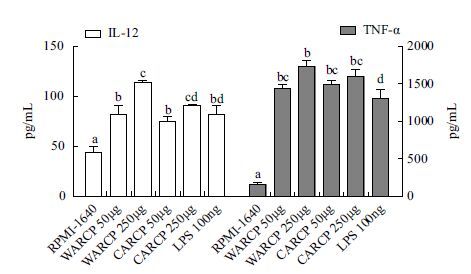
细胞因子检测的结果如 图 3 ,与未处理的DCs相比,WARCP和CARCP均能显著促进DCs细胞因子IL-12和TNF-α的分泌(P<0.05),低剂量组与阳性对照组LPS相当(P>0.05),高剂量组作用效果优于LPS对照组,且差异显著(P<0.05);相同剂量的WARCP和CARCP对IL-12和TNF-α的分泌作用没有显著性差异(P>0.05)。
|
| 图 3 WARCP/CARCP对体外小鼠DCs细胞因子分泌的影响 图中不同字母表示各组间差异显著(P<0.05) |
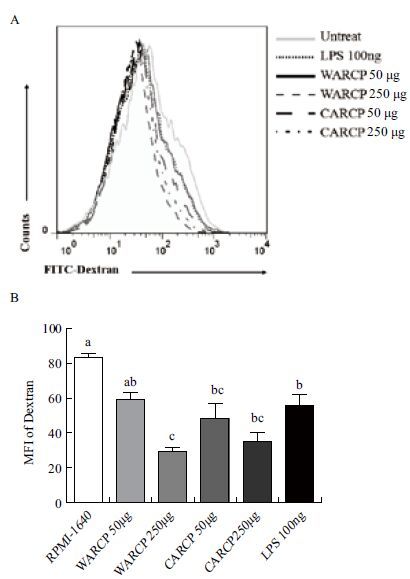
DCs吞噬FITC-Dextran结果如 图 4 ,WARCP和CARCP均能促进DCs成熟,不同剂量刺激后DCs吞噬FITC-Dextran能力显著下降(P<0.05);相同剂量的WARCP和CARCP对DCs吞噬FITC-Dextran能力没有显著性差异(P>0.05)。
|
| 图 4 WARCP/CARCP对体外小鼠DCs抗原吞噬功能的影响 A:流式细胞术检测DCs 吞噬FITC-Dextran能力;B:DCs 表面FITC-Dextran平均荧光强度(MFI)检测结果(x±s,n=3),不同字母表示各组间差异显著(P<0.05) |
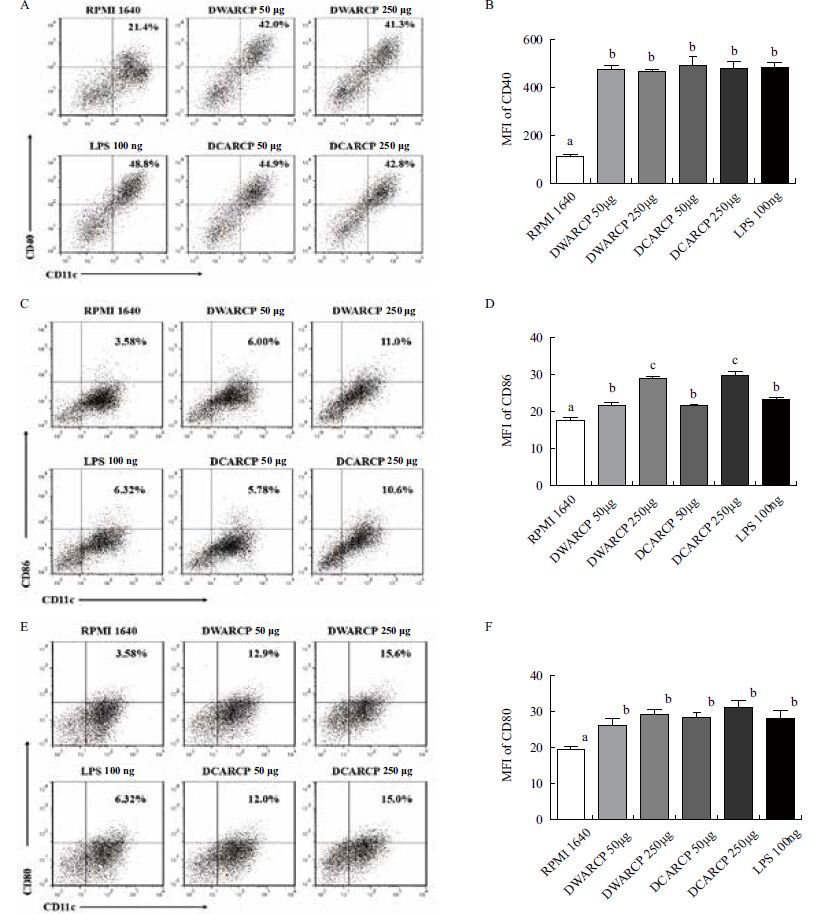
DCs表面分子表达结果如 图 5 ,DWARCP和DCARCP均能显著促进CD11c+CD40、CD11c+CD86及CD11c+CD80的表达(P<0.05),CD11c+CD40和CD11c+CD80的表达与阳性对照组LPS组相当(P>0.05),CD11c+CD86的表达高于阳性对照组(P<0.05);相同剂量的DWARCP和DCARCP对DCs成熟的促进作用没有显著性差异(P>0.05)。
|
| 图 5 DWARCP/DCARCP对体外小鼠DCs表面分子表达的影响 A,C,E:流式细胞术检测DCs 表面分子:CD40、CD86及CD80表达;B,D,F:DCs 表面CD40、CD86及CD80平均荧光强度(MFI)检测结果(x±s,n=3),不同字母表示各组间差异显著(P<0.05) |
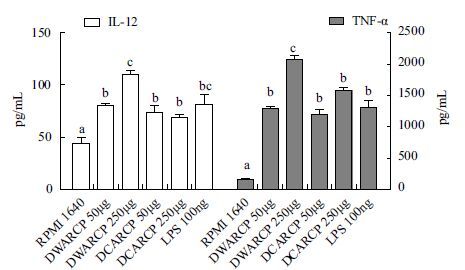
细胞因子的检测结果如 图 6 ,DWARCP和DCARCP均能显著促进DCs细胞因子IL-12和TNF-α的分泌(P<0.05),低剂量组间没有显著差异(P>0.05),与阳性对照组LPS相当(P>0.05),DWARCP高剂量组作用效果优于DCARCP高剂量组,与LPS组差异显著(P<0.05)。
|
| 图 6 DWARCP/DCARCP对体外小鼠DCs细胞因子分泌的影响 不同字母表示各组间差异显著(P<0.05) |
DCs吞噬FITC-Dextran结果如 图 7 ,DWARCP和DCARCP均能促进DCs成熟,不同剂量刺激后DCs吞噬FITC-Dextran能力显著下降(P<0.05);相同剂量的DWARCP和DCARCP对DCs吞噬FITC-Dextran能力没有显著性差异(P>0.05)。
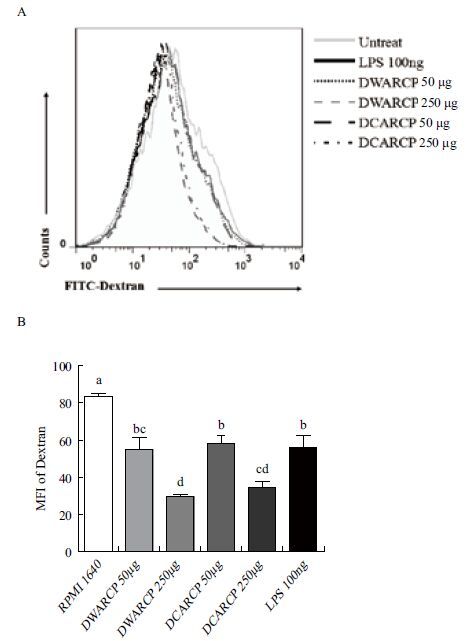
|
| 图 7 DWARCP/DCARCP对体外小鼠DCs抗原吞噬功能的影响 A:流式细胞术检测DCs 吞噬FITC-Dextran能力;B:DCs 表面FITC-Dextran平均荧光强度(MFI)检测结果(x±s,n=3),不同字母(a-b)表示各组间差异显著(P<0.05) |
结果如 图 8 ,WARCP和DWARCP均能显著促进CD11c+CD40、CD11c+CD86及CD11c+CD80的表达,也能显著促进DCs细胞因子IL-12和TNF-α的分泌,相同剂量的WARCP和DWARCP对DCs表面分子和细胞因子分泌的促进作用没有显著性差异(P>0.05)。
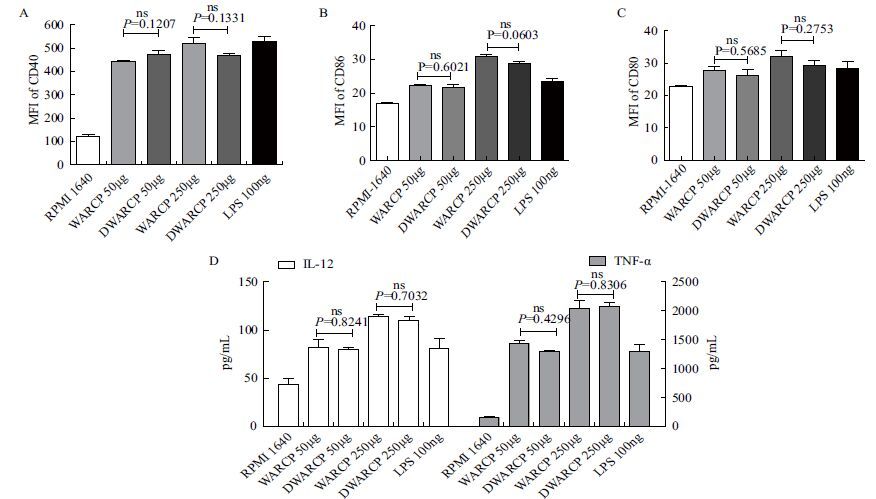
|
| 图 8 WARCP/DWARCP对小鼠体外DCs表面分子表达和细胞因子分泌的影响 A-C:DCs 表面CD40、CD86及CD80平均荧光强度(MFI)检测结果(x±s,n=3);D:DCs上清IL-12和TNF-α的表达水平 |
结果如 图 9 ,CARCP和DCARCP均能显著促进CD11c+CD40、CD11c+CD86及CD11c+CD80的表达,也能显著促进DCs细胞因子IL-12和TNF-α的分泌,相同剂量的CARCP和DCARCP对DCs表面分子表达和细胞因子分泌的促进作用没有显著性差异(P>0.05)。
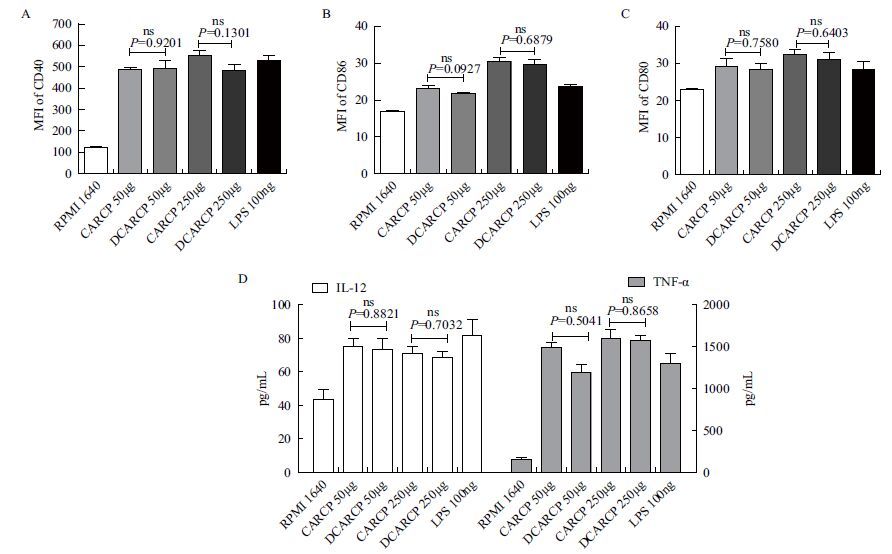
|
| 图 9 CARCP/DCARCP对小鼠体外DCs表面分子表达和细胞因子分泌的影响 A-C:DCs 表面CD40、CD86及CD80平均荧光强度(MFI)检测结果(x±s,n=3);D:DCs上清IL-12和TNF-α的表达水平 |
DCs吞噬FITC-Dextran结果如 图 10 ,不同剂量WARCP/DWARCP和CARCP/DCARCP刺激后DCs吞噬FITC-Dextran能力显著下降(P<0.05);相同剂量的WARCP/DWARCP和CARCP/DCARCP对DCs吞噬FITC-Dextran能力没有显著性差异(P>0.05)。
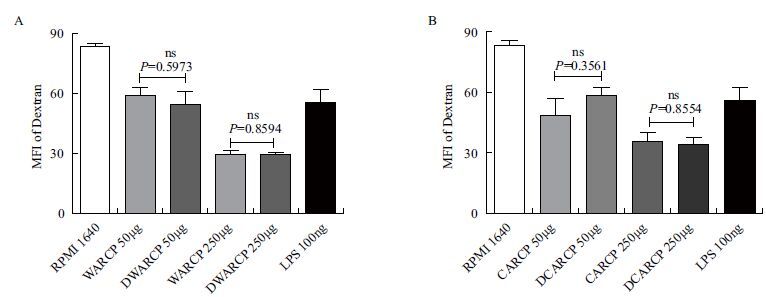
|
| 图 10 WARCP/DWARCP和CARCP/DCARCP对体外小鼠DCs抗原吞噬功能的影响 A-B:DCs 表面FITC-Dextran平均荧光强度(MFI)检测结果(x±s,n=3),不同字母表示各组间差异显著(P<0.05) |
中药多糖是一类广泛分布于植物界的重要生物活性成分,大量实验证明,中药多糖对抗肿瘤、抗病毒,抗氧化、抗衰老以及提高免疫力方面都有非常显著的效果,国内外学者已经从多种传统中药中提取多糖成分研究其免疫调节的作用,如人参多糖、黄芪多糖、茯苓多糖、淫羊藿多糖等[14-16],发现中药多糖可以通过增强DC表面分子的表达和细胞因子的分泌促进DC成熟,促进淋巴细胞增殖,启动免疫应答[17-19]。新疆一枝蒿为典型地产药用植物,由于用药量的不断增大,野生资源难以满足需要,栽培品种已经成功在新疆大面积种植,研究者们对野生一枝蒿与人工栽培的质量及有效成分进行了比较,但是对其活性成分的免疫活性比较较少,鉴于DCs在免疫系统中发挥的关键作用,本研究利用DCs作为一枝蒿多糖免疫活性的检测平台,探讨其对小鼠体外DCs的生长状态、成熟和功能的影响,比较新疆野生及栽培一枝蒿多糖的免疫活性,为更好的开发利用栽培一枝蒿的研究提供参考。
本研究结果表明,野生一枝蒿与栽培一枝蒿粗多糖样品中多糖含量差异不显著,在一定的剂量范围内对小鼠骨髓来源DCs的生长状态,细胞群形态没有影响。以多糖作为标准体外刺激小鼠骨髓来源的DCs,野生和栽培一枝蒿均可显著促进DCs的成熟和功能,且相同剂量效果差异不大。在此基础上,为了检测样品中蛋白质对多糖发挥免疫作用的影响,进行了野生一枝蒿和栽培一枝蒿样品除蛋白后,多糖含量、蛋白含量以及对DCs成熟和功能的影响探讨。研究结果发现,野生及栽培一枝蒿粗多糖样品分别除去蛋白后,多糖含量虽有所增加,但没有显著差异;蛋白含量差异显著;多糖得率差异显著,野生一枝蒿样品未蛋白的多糖得率为4.20%,除蛋白后的得率仅为0.88%,栽培样品未蛋白后的多糖得率为6.50%,除蛋白后的得率为1.20%。样体外刺激小鼠DCs后的检测结果表明,除蛋白的野生和栽培一枝蒿样品对DCs表面分子CD40、CD86及CD80的表达没有显著差异;对DCs细胞因子IL-12和TNF-α的分泌,除野生高剂量优于栽培一枝蒿外,低剂量之间没有显著差异;对DCs内吞抗原FITC-Dextran的能力没有显著性差异。不除蛋白和除蛋白的野生一枝蒿样品对促进DCs成熟和功能的影响没有显著差异,不除蛋白和除蛋白的栽培一枝蒿样品对促进DCs成熟和功能的影响也没有显著差异。这些结果表明除蛋白和不除蛋白样品对DCs的成熟和功能没有影响,但是除蛋白后样品中的多糖得率显著降低。
4 结论本实验采用超声法制备野生及栽培一枝蒿粗多糖,多糖含量分别为26.18%和22.14%;Sevage法除蛋白,去除蛋白质后多糖含量分别为30.94%和27.06%。
流式细胞术检测DCs表面分子CD40、CD86及CD80表达,ELISA法检测细胞因子IL-12和TNF-α的表达水平,流式细胞术检测刺激后DCs抗原吞噬能力,结果显示,野生及栽培一枝蒿多糖均可以显著增强DCs表面分子CD40、CD86及CD80、细胞因子IL-12和TNF-α的表达(P<0.05);降低DCs抗原吞噬能力,且相同剂量野生及栽培一枝蒿多糖对DCs的免疫活性无显著性差异(P>0.05),除蛋白和不除蛋白的野生及栽培一枝蒿多糖的免疫活性均无显著差异(P>0.05)。
新疆野生和栽培一枝蒿多糖含量差异较小,野生与栽培一枝蒿多糖对DCs的成熟和功能作用相当,除蛋白对野生和栽培一枝蒿的免疫活性影响不大。
| [1] | 汪豪, 杜慧斌, 斯拉甫.艾白. 新疆一枝蒿化学成分的研究[J]. 中国药科大学学报, 2011, 42(4) : 310–313. |
| [2] | Gu DY, Abdulla R, Aisa HA, et al. Characterization and identification of chemical compositions in the extract of Artemisia rupestris L[J]. Rapid Commun Mass Spectrom, 2012, 26 : 83–100. |
| [3] | 马俊鹏, 朱位江, 卢冬梅. 一枝蒿提取物调节小鼠免疫功能的研究[J]. 西北药学杂志, 2009, 24(3) : 197–199. |
| [4] | 陶海英, 孙玉华, 胡正梅, 等. 复方一枝蒿颗粒的抗炎、抗菌作用和对免疫功能的影响[J]. 中药药理与临床, 2007, 23(2) : 64–66. |
| [5] | 孟繁龙, 李治建, 斯拉甫·艾白, 等. 一枝蒿有效部位对小鼠免疫功能的影响[J]. 时珍国医国药, 2011, 22(3) : 537–539. |
| [6] | 李军, 刘文丽, 哈尔·札衣尔, 等. 人工栽培与野生新疆一枝蒿质量及有效成分的比较[J]. 中草药, 1996, 235–237. |
| [7] | Fukui H, Mitsui S, Harima N, et al. Novel functions of herbal medicines in dendritic cells:role of Amomi Semen in tumor immunity[J]. Microbiol Immunol, 2007, 51 : 1121–1133. |
| [8] | Garg R, Shrivastava P, van Drunen Littel-van, et al. The role of dendritic cells in innate and adaptive immunity to respiratory syncytial virus,and implications for vaccine development[J]. Expert Rev Vaccines, 2012, 11 : 1441–1457. |
| [9] | 杨芳, 曹银, 廖绪标, 等. 板栗多糖的超声波辅助提取技术[J]. 湖北农业科学, 2012, 51(12) : 2552–2555. |
| [10] | 王如涛, 吴绵斌, 林建平, 等. 植物多糖分离提取技术的研究进展[J]. 中国生物工程杂志, 2013, 33(7) : 118–123. |
| [11] | 万琴, 萧伟. 女贞子多糖除蛋白工艺的研究[J]. 中草药, 2010, 41(3) : 407–410. |
| [12] | 刘玉佳, 孔繁东, 刘兆芳, 等. 桔梗多糖Sevag法除蛋白工艺的研究[J]. 中国调味品, 2014, 39(4) : 5–7. |
| [13] | 孙晓燕, 蔡昌利, 徐丽莉, 等. 多糖含量测定方法的比较[J]. 现代中药研究与实践, 2015, 29(3) : 58–62. |
| [14] | Zhao LH, Ma ZX, Zhu J, et al. Characterization of polysaccharide from Astragalus radix as the macrophage stimulator[J]. Cell immunol, 2011, 271 : 329–334. |
| [15] | 刘景田, 党小军, 张洁. 中药多糖增强淋巴细胞免疫效应与机制研究[J]. 中国药学杂志, 1999, 34(12) : 807–809. |
| [16] | Kouakou K, Schepetkin IA, Yapi A, et al. Immunomodulatory activity of polysaccharides isolated from Alchornea cordifolia[J]. J Ethnopharmacol, 2013, 146 : 232–242. |
| [17] | Li J, Ji L, Sun L, et al. Analysis of Herba Asari polysaccharides and their immunological activity[J]. Carbohydr Polym, 2012, 87(1) : 551–556. |
| [18] | Li JY, Li JY, Zhang FC, et al. The immunoregulatory effects of Chinese herbal medicine on the maturation and function of dendritic cells[J]. J Ethnopharmacology, 2015, 2(171) : 184–195. |
| [19] | Jin M, Huang Q, Zhao K, et al. Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L[J]. Int J Biol Macromol, 2013, 5(54) : 16–23. |





