迟缓爱德华菌(Edwardsiella tarda)是革兰氏阴性菌,属肠杆菌科(Enterobacteriaceae)、爱德华菌属(Edwardsiella),是爱德华菌病的病原菌,最初是1962年从日本鳗鱼中分离[1]。该菌普遍存在于海水和淡水环境中,可以感染日本鳗鲡、真鲷、黄鰤、斑点叉尾鮰及大菱鲆等多种重要经济鱼类,也给牙鲆养殖造成严重的经济损失[2]。迟缓爱德华菌的宿主范围很广,除了鱼类是其最常见的宿主,同时还可以感染爬行类、两栖类、水生鸟类、海洋哺乳类以及其它陆生哺乳类,也可以导致人类胃肠疾病、皮肤软组织和胆管感染、菌血症、腹膜炎、脑膜炎等,而且是一种人畜共患菌[3]。
目前针对迟缓爱德华菌的检测方法主要是通过传统的细菌分离培养,进行细菌形态学和各项生理生化指标的鉴定。此外还有分子生物学鉴定方法[4]以及免疫学鉴定方法,包括间接ELISA法[5]、Dot-ELISA法[6]、竞争ELISA法[7]等。但是这些检测方法由于需要专业检测技能、昂贵的设备以及较长的检测时间等原因而在实际应用中受到很大的限制。以免疫层析原理建立起来的快速检测试纸条,具有检测快速、操作简单的特点。免疫层析试纸条的技术核心是双抗夹心ELISA,双抗夹心ELISA是在间接ELISA方法基础上发展起来的一种常用免疫检测技术,该方法灵敏度高、特异性强,已被广泛应用于人类医学[8, 9]、畜牧业[10]、水产养殖业[11, 12]、食品安全[13]等领域。本实验通过研制抗迟缓爱德华菌单克隆抗体,并进行双抗体夹心ELISA检测参数的优化,旨在为迟缓爱德华菌胶体金快速检测试纸条的研制提供参考。
1 材料与方法 1.1 材料 1.1.1 试剂与培养基RPMI 1640培养液、胎牛血清(HYCLONE公司);HAT(GIBCO公司);聚乙二醇(PEG2000,MERCK公司);弗氏完全佐剂和弗式不完全佐剂(Thermo公司);碱性磷酸酶(AP)标记的羊抗小鼠IgG(SIGMA公司);6-8周龄SPF级雌性Balb/C小白鼠(大连医科大学SPF实验动物中心);抗迟缓爱德华菌2CDM001兔源多克隆抗体由本实验室制备,纯化后的兔多抗效价为1∶320000。
1.1.2 菌株与细胞株本实验中用到的参考菌株共12株,分别为杀鲑气单胞菌Aeromonas salmonicida(MT004)、美人鱼弧菌 Vibrio damsela(ATCC33539)、副溶血弧菌 Vibrio parahaemolyticus(KCTC2471)、创伤弧菌 Vibrio vulnificus(ATCC2126)、溶藻弧菌Vibrio alginolyticus(KCCM40513)、鳗弧菌Vibrio anguillarum(KCTC2711)、鮰爱德华菌Edwardsiella ictaluri(ATCC33202)、海豚链球菌Streptococcus iniae(KCTC3657)、灿烂弧菌 Vibrio splendidus(ATCC33125)、希瓦氏菌Shewanella oneidensis(KCCM41821)、哈维弧菌Vibrio harveyi(ACTT14126)和迟缓爱德华菌Edwardsiella tarda(ATCC15947),迟缓爱德华菌分离株共6株(2CDI901、2CDA101、2CDX001、2CDM001、2CDM002、2CDM003),其中2CDM001为本实验中使用的免疫菌株,该菌株由辽宁地区患病大菱鲆分离得到。SP2/0小鼠骨髓瘤细胞为本实验室保存。
1.2 方法 1.2.1 单克隆抗体的制备参考文献[14],用灭活的迟缓爱德华菌2CDM001作为抗原,分4次免疫6周龄的Balb/C小鼠。采用细胞融合技术将免疫小鼠的脾细胞与骨髓瘤细胞进行融合,再通过间接ELISA、IFA等方法进行筛选,有限稀释法进行3次克隆。
1.2.2 单克隆抗体特性分析 1.2.2.1 特异性分析为了增强实验的准确性,本实验分别用了间接ELISA和IFA两种方法对单抗20D3进行特异性分析[15]。利用间接ELISA方法,选择1.1.2中所述12株参考菌株以及包括2CDM001菌株在内的6株迟缓爱德华菌分离菌株进行单抗特异性检测。菌株于28℃下培养24 h,用无菌PBS调节菌悬液浓度为1×108CFU/mL,分别包被96孔聚苯乙烯酶标板。一抗为单克隆抗体,取SP2/0培养上清作为阴性对照。
利用间接IFA方法[16],用PBS调整各菌株的浓度至5×108CFU/mL制作滴片,以单抗细胞20D3上清为一抗,SP2/0细胞上清为阴性对照,FITC标记的羊抗鼠IgG为显色二抗。
1.2.2.2 效价的测定利用间接ELISA技术,通过棋盘滴定法检测单克隆抗体的效价,单克隆抗体以2倍比(21 -210)进行系列稀释;包被抗原迟缓爱德华菌2CDM001以10倍比进行稀释(5×108- 5×105CFU/mL),能保持阳性的最大稀释倍数即为该单抗的效价。
1.2.3 双抗夹心ELISA方法的建立 1.2.3.1 双抗体夹心ELISA操作流程以抗迟缓爱德华菌2CDM001的多克隆抗体作为包被抗体,单克隆抗体20D3为检测单抗,AP标记的羊抗鼠IgG为显色抗体,建立检测迟缓爱德华菌2CDM001的双抗夹心ELISA方法[17]。
1.2.3.2 抗体最佳工作浓度的确定用碳酸盐缓冲液(15 mmol/L Na2CO3,35 mmol NaHCO3,pH9.6)将多克隆抗体从1∶50至1∶6 400进行2倍比系列稀释,包被96孔酶标板,使用PBS将单克隆抗体从原液、1∶2、1∶4、1∶8、1∶16、1∶32进行2倍比系列稀释,迟缓爱德华菌2CDM001浓度为5×108 CFU/mL,参照上述1.2.3.1,采用棋盘滴定法确定多克隆抗体及单克隆抗体最佳工作浓度。
1.2.3.3 特异性试验利用12株参考菌株及6株迟缓爱德华菌分离株进行特异性检测,浓度均为5×108CFU/mL。多克隆抗体及单克隆抗体均采用最佳工作浓度,参照上述1.2.3.1的双抗夹心ELISA操作流程进行特异性分析试验。
1.2.3.4 敏感性试验将迟缓爱德华菌2CDM001用PBS进行10倍系列稀释,多克隆抗体及单克隆抗体采用最佳工作浓度,参照上述1.2.3.1。
2 结果 2.1 杂交瘤细胞株经过筛选和3次克隆后,共获得11株稳定分泌抗迟缓爱德华菌2CDM001的单克隆抗体的杂交瘤细胞株,分别命名为8D11、8H4、2F4、18C12、16E2、20D3、19G2、5F7、4E6、7C5和18H9。
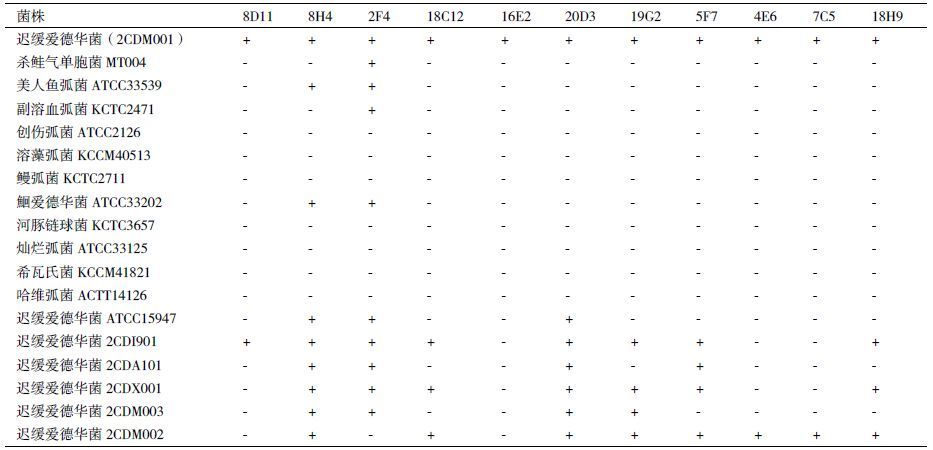
2.2 单克隆抗体效价及特异性经间接ELISA法检测,11株单克隆抗体8D11、8H4、2F4、18C12、16E2、20D3、19G2、5F7、4E6、7C5、18H9效价分别为1∶512、1∶256、1∶256、1∶256、1∶512、1∶64、1∶1024、1∶32、1∶256、1∶256、1∶512。
在特异性方面,单抗8H4和2F4特异性较差,与多种参考菌株均出现不同程度的交叉反应,而其余9株单抗特异性强,与参考菌株均不结合;但与迟缓爱德华菌分离株的检测结果(表 1)表明,仅有20D3和8H4可与所有分离株结合,但单抗8H4与美人鱼弧菌交叉反应,因此选择单抗20D3建立双抗体夹心ELISA。其余单抗均不能与实验中所有迟缓爱德华菌发生反应。
经荧光显微镜观察,迟缓爱德华菌参考菌株ATCC15947(图 1-A)和免疫菌株2CDM001(图 1-B)均出现强烈的荧光信号,阴性对照(图 1-C)和其它参考菌株均未出现荧光信号。同时对比迟缓爱德华2CDM001在相同放大倍数、自然透射光条件下的形态(图 1-D),与图 1-A和图 1-B中的荧光发光体形态一致。IFA实验结果佐证了间接ELISA特异性分析结果的准确性。

|
| 图 1 荧光显微镜观察结果 A:ATCC15947+单抗20D3;B:2CDM001+单抗20D3;C:2CDM001+SP2/0上清;D:2CDM001 |
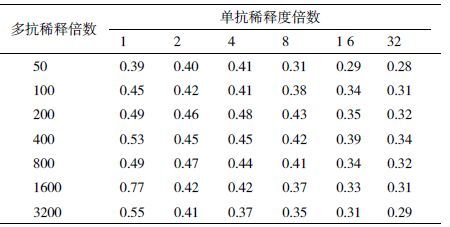
多抗最适包被浓度和单抗最适工作浓度如表 2所示。通过尽可能提高多抗包被量以增加对抗原的捕捉能力,参照ELISA方法中抗原包被浓度的筛选办法[11],当产生的OD405值接近1.0时的抗原浓度作为最佳包被浓度,经试验测定多抗的最佳包被浓度为1∶1600倍稀释,单克隆抗体最佳稀释度为原液。
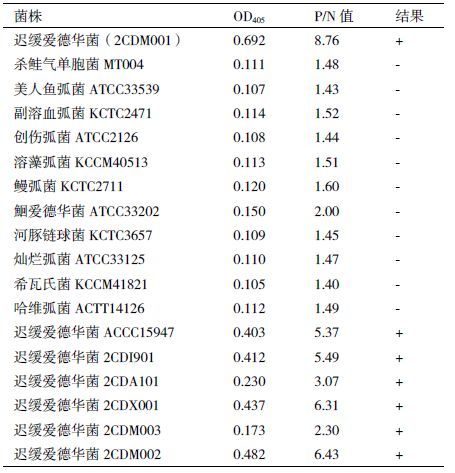
应用迟缓爱德华菌2CDM001双抗夹心ELISA检测技术对多种菌株的检测发现(表 3),该方法可以特异性检测实验中用到的所有迟缓爱德华菌菌株(1株参考菌株,6株分离菌株),与杀鲑气单胞菌Aeromonas salmonicida(MT004)、美人鱼弧菌Vibrio damsela(ATCC33539)、副溶血弧菌 Vibrio parahaem-olyticus(KCTC2471)、创伤弧菌Vibrio vulnificus(ATCC2126)、溶藻弧菌Vibrio alginolyticus(KCCM-40513)、鳗弧菌Vibrio anguillarum(KCTC2711)、鮰爱德华菌Edwardsiella ictaluri(ATCC33202)、海豚链球菌Streptococcus iniae(KCTC3657)、灿烂弧菌 Vibrio splendidus(ATCC33125)、希瓦氏菌Shewanella oneidensis(KCCM41821)、哈维弧菌Vibrio harveyi(ACTT14126)11株参考菌株均无交叉反应。
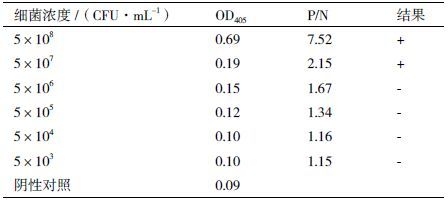
双抗体夹心ELISA检测迟缓爱德华菌2CDM001敏感性试验结果见表 4。以PBS作为菌悬液介质,可检测的最低菌液浓度为5×107CFU/mL。
为了能够快速检测迟缓爱德华菌,有效的预防和控制爱德华菌病,对该病早期快速诊断是非常重要的。江云等[18]筛选出了检测致病性迟缓爱德华菌的毒力基因,建立了致病性迟缓爱德华菌PCR检测体系。兰建新[5]、白方方等[19]用迟缓爱德华菌多克隆抗体建立了迟缓爱德华菌的间接ELISA检测方法。朱壮春等[20]建立了Dot-IGS快速检测迟缓爱德华菌的方法。但这些方法都需要一定的检测技术、设备以及较长的检测时间。
对于快速便捷地检测迟缓爱德华菌,较为理想的方法是利用双抗夹心法研制出一种免疫学诊断试纸条。单克隆抗体的制备是研发试纸条过程中必不可少的前期工作[21],迟缓爱德华菌单克隆抗体的制备在国内已有报道,但与本实验的方法略有不同。吴斌[22]和金晓航[23]在免疫Balb /c小鼠时,直接注射灭活的菌悬液,未用任何佐剂;本实验在免疫小鼠时,初次免疫用到了弗氏完全佐剂,后3次加强免疫用了弗氏不完全佐剂。到本试验通过大量筛选,获得了一株具有很强特异性的杂交瘤细胞株20D3。该单抗与试验中的所有迟缓爱德华菌株均产生阳性反应,与实验中其他菌株均不结合,具有良好的特异性。本实验中单抗特异性的检测使用的均为纯化的菌株,对于混合菌株的检测效果后续实验会进行评估。
双抗体夹心ELISA法是研制迟缓爱德华菌胶体金试纸条的技术核心,该方法的特异性和灵敏度关系到试纸条研发的成败。在特异性的检测中,本实验建立的双抗夹心ELISA方法对实验中所有迟缓爱德华菌株都产生阳性反应,而对试验所用的其它参考菌株均无交叉反应。在灵敏度的检测中,该双抗夹心法检测下限只有5×107CFU/mL。而吴秋仙等[17]以黄海希瓦氏菌AP629为抗原、兔源多抗以及鼠源单抗建立了黄海希瓦氏菌AP629双抗夹心ELISA检测方法,对于以PBS和海参体壁匀浆上清液为介质的菌悬液,该方法检出限分别为104CFU/mL和106CFU/mL。马卫静等[24]以阪崎杆菌LPS为抗原、单克隆抗体2A7为捕获抗体、1A11-HRP为检测抗体建立阪崎杆菌双抗体夹心ELISA检测方法,对纯培养液的检测限在103-105CFU/mL。刘红亮等[25]以E.coli O157∶H7为免疫原,采用改良过碘酸钠法制备的辣根过氧化物酶(HRP)酶标抗体,建立检测E.coli O157∶H7的双抗夹心ELSA方法,该方法对纯培养菌液的检出下限为3×104CFU/mL。相比之下,本研究建立的双抗夹心ELISA方法灵敏度偏低,这可能与杂交瘤细胞分泌抗体的能力以及上清液中抗体的浓度有关,下一步我们将通过小鼠腹腔注射杂交瘤的办法,避免外界环境对杂交瘤的干扰,进一步提高杂交瘤分泌抗体的能力。
4 结论本研究以灭活菌株2CDM001为抗原,利用杂交瘤技术及间接ELISA、IFA等筛选方法,获得一株能与实验中所有迟缓爱德华菌发生反应,而不与实验中其它参考菌株发生反应的单抗20D3。以单抗20D3和兔源多抗建立迟缓爱德华菌2CDM001的双抗夹心ELISA检测方法,该方法可以检测实验中所有的迟缓爱德华菌,与实验中其它参考菌株不发生交叉反应,对以PBS为介质的2CDM001菌悬液的检测灵敏度达到5×107CFU/mL。
| [1] | Hoshina T. On a new bacterium,Paracolobactrum anguillimortiferum n. sp[J]. Nsugaf, 1962, 28(2) : 162–164. |
| [2] | Austin B, Austin DA. Springer Science & Business Media[M]. 2007. |
| [3] | 李晓琴. 迟钝爱德华菌研究进展综述[J]. 湖北民族学院学报:医学版, 2013, 30(3) : 71–74. |
| [4] | Lan J, Zhang XH, Wang Y, et al. Isolation of an unusual strain of Edwardsiella tarda from turbot and establish a PCR detection technique with the gyrB gene[J]. Journal of Applied Microbiol, 2008, 105(3) : 644–651. |
| [5] | 兰建新. 养殖大菱鲆病原菌迟缓爱德华氏菌的分离鉴定及快速检测技术的建立[D]. 青岛:中国海洋大学,2008. |
| [6] | Swain P, Mukherjee SC, et al. Dot-enzyme-linked immunosorbent assay Dot-ELISA for the diagnosis of Edwardsiella tarda infection in fish[J]. Asian Fisheries Science, 2001, 14(1) : 89–93. |
| [7] | Swain P, Nayak SK. Comparative sensitivity of different serological tests for seromonitoring and surveillance of Edwardsiella tarda infection of Indian major carps[J]. Fish & Shellfish Immunology, 2003, 15(4) : 333–340. |
| [8] | Acevedo B, Perera Y, Ruiz M, et al. Development and validation of a quantitative ELISA for the measurement of PSA concentration[J]. Clinica Chimica Acta, 2002, 317(s1-2) : 55–63. |
| [9] | Pál J, Pálinkás L, Nyárády Z, et al. Sandwich type ELISA and a fluorescent cytometricmicrobead assay for quantitative determination of hepatitis B virus X antigen level in humansera[J]. Journal of Immunological Methods, 2005, 306(1-2) : 183–192. |
| [10] | Benito A, Carmena D. Double-antibody sandwich ELISA using biotinylated antibodies for the detection of Echinococcus granulosus coproantigens in dogs[J]. Acta Tropica, 2005, 95 : 9–15. |
| [11] | Zhang M, Yang JX, Lin XM, et al. A double antibody sandwich enzyme-linked immunosorbent assay for detection of soft-shelled turtle iridovirus antigens[J]. Journal of Virological Methods, 2010, 167 : 193–198. |
| [12] | 刘鹿山. 对虾白斑综合征病毒(WSSV)双抗体夹心ELISA定量检测方法的建立与应用[D]. 青岛:中国海洋大学,2013. |
| [13] | 吴大成, 孙洋, 袁洁, 等. 双抗夹心ELISA检测肠出血性大肠杆菌O157方法的建立[J]. 中国兽医学报, 2011, 12 : 1745–1748. |
| [14] | 李强, 黄华, 张显昱, 等. 鮰爱德华菌单克隆抗体的制备及其在黄颡鱼“红头病"研究中的应用[J]. 大连海洋大学学报, 2014, 29(4) : 323–328. |
| [15] | 景宏丽, 李强, 吴秋仙, 等. 黄海希瓦氏菌单抗介导间接ELISA快速检测技术的建立[J]. 大连海洋大学学报, 2010, 25(6) : 547–550. |
| [16] | 李强, 齐楠, 杨丽文, 等. 黄海希瓦氏菌多克隆抗体部分特性的分析[J]. 大连海洋大学学报, 2011, 26(4) : 376–380. |
| [17] | 吴秋仙, 李强, 李华, 等. 应用双抗体夹心酶联免疫方法检测仿刺身病原菌-黄海希瓦氏菌AP-629[J]. 中国农业科技导报, 2011, 13(1) : 117–121. |
| [18] | 江云, 李寿崧, 王寿昆, 等. 致病性迟钝爱德华氏菌毒力基因的PCR检测[J]. 中国食品学报, 2008, 04 : 123–129. |
| [19] | 白方方, 兰建新, 王燕, 等. 迟缓爱德华氏菌间接快速检测法[J]. 中国水产科学, 2009, 16(4) : 619–625. |
| [20] | 朱壮春, 白云, 等. 应用Dot-IGS快速检测牙鲆腹水病病原的研究[J]. 安徽农业科学, 2009, 37(22) : 10539–10541. |
| [21] | 方莹. 免疫胶体金技术及其在微生物检测中的应用[J]. 中国卫生检验杂志, 2006, 16(11) : 1399–1401. |
| [22] | 吴斌. 抗迟缓爱德华氏菌单克隆抗体制备及初步鉴定[J]. 福州大学学报, 2011, 39(1) : 148–151. |
| [23] | 金晓航, 黄威权, 夏永娟, 等. 抗迟缓爱德华菌单克隆抗体的应用[J]. 水产学报, 2000, 6 : 554–559. |
| [24] | 马卫静. 抗阪崎肠杆菌LPS单克隆抗体的制备及双抗夹心ELISA方法的建立[D]. 兰州:甘肃农业大学,2012. |
| [25] | 刘红亮, 李克生, 陈学忠, 等. 大肠杆菌O157 LPS单克隆抗体的制备及ELISA检测方法的建立[J]. 中国兽医科学, 2011, 12 : 1260–1265. |