2. 遵义医学院附属医院检验科,遵义 563000
2. Clinical Laboratory Department of Zunyi Medical University Affiliated Hospital,Zunyi 563000
肺炎链球菌(Streptococcus pneumonia,S.pn)又称为肺炎(双)球菌,主要引起儿童和成年人肺炎、败血症、脑膜炎等疾病,也是导致流行性中耳炎的唯一病原体[1, 2]。由于青霉素等抗生素的大量使用,s.pn的耐药性逐年走高。临床上广泛出现了多重耐药的s.pn菌株,甚至耐万古霉素的S.pn菌株[3]。因此,通过研发免疫原性强、保守性高、价格低廉的S.pn蛋白质疫苗,是解决S.pn耐药问题的关键[4, 5]。
双组分系统(two-component systems,TCSs)是革兰阳性菌特有的信号转导系统,是s.pn通过感受外界环境变化、生长繁殖和维持自身存活的重要感应系统[6, 7]。组氨酸蛋白激酶(Histidine kinase,HK/WalK)及其受体(Response regulator,RR/WalR)是s.pn TCS中的一对调节蛋白,其在细胞的能量信号转导上起着至关重要的作用[8]。WalR主要通过磷酸化和去磷酸化使信号逐级放大,从而引起细胞能量代谢反应。研究证实,这些信号的传递往往与细菌的耐药性和致病性密切相关,也与其生物膜的形成存在一定的关系[9]。因此,以WalR为蛋白质疫苗作用靶点的相关研究可能具有重要价值。本研究拟通过蛋白重组技术获得高纯度的WalR目的蛋白以观察其保护效应,并探讨其在不同血清型s.pn中的保守性,以期为后续蛋白疫苗的研发提供依据。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒肺炎链球菌NCTC7466(D39)标准菌株。大肠杆菌DH5α和BL21(DE3)菌株,原核表达质粒PET28a为本课题组保存。
1.1.2 试剂基因组DNA提取试剂盒(北京天根公司),DNA片段纯化试剂盒(TaKaRa),质粒提取试剂盒(美国Omega公司),限制性内切酶 BamHⅠ、XholⅠ(TaKaRa),PrimerStar高保真DNA聚合酶、DNA marker、T4DNA连接酶(TaKaRa),异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、LB培养基(上海生工)。
1.2 方法 1.2.1 高保真PCR获取目的基因用基因组提取试剂盒对过夜培养后的s.pn菌株D39进行基因组DNA提取,在NCBI基因库中查找WalR目的基因(705 bp)并且用Primer premier5.0引物设计软件设计引物,引物如下:
上游引物:CGGGATCC ATGAAAAAAATACTA-ATTGTAG,
下游引物:CCGCTCGAG TCAAGCATTATTTCTC-ATGT。
PCR扩增体系:反应体系为50 μL:ddH2O 32 μL、5×PS Buffer 10 μL、dNTP Mixture 4 μL、肺炎链球菌模板DNA 1.5 μL、上游引物F和下游引物R各1 μL、Prime Star酶0.5 μL。反应条件98℃ 20 s,54℃ 15 s,72℃ 43 s,30 cycles,72℃延伸5 min。 PCR产物经过1%琼脂糖凝胶电泳鉴定后,用DNA纯化试剂盒纯化后测得浓度储存于-20℃备用。
1.2.2 PET28a-WalR重组质粒的构建、筛选将PET28a质粒和目的基因同时用BamHⅠ、XholⅠ双酶切,酶切后纯化并且用T4DNA连接酶连接。连接后转化到大肠杆菌DH5α感受态中,并且接种于LB培养基平板(含50 μg/mL卡那霉素)。过夜后挑取单个菌落增菌进行菌液PCR,对PCR阳性的菌液增菌提取重组质粒行双酶切鉴定。
1.2.3 重组WalR蛋白的表达将上一步筛选得到的重组质粒PET28a-WalR转化至大肠杆菌BL21(DE3)感受态细胞中,挑取单个菌落增菌并且进行阳性鉴定,将阳性菌接种到LB培养基中(含50 μg/mL卡那霉素)培养,37℃监测光密度A600=0.4-0.6时,加入终浓度为0.2 mmol/L的IPTG,12℃诱导12 h后9 000×g离心3 min收集细菌,重悬细菌后用超声破菌仪破菌,12 000×g离心30 min后行SDS-PAGE检测目的蛋白的表达形式。
1.2.4 B细胞抗原表位预测用DNASTAR Lasergene v7.1软件结合ameson-Wolf法、Emini法、Kyte-Doolittle法、Karplus-Schulz法,分别对WalR蛋白抗原指数、表面可能性、亲水性、可塑性进行分析来分析WalR蛋白B细胞抗原表位。
1.2.5 保守性分析从NCBI GenBank数据库中获取不同型别肺炎链球菌的WalR蛋白氨基酸序列,用 ClustalX 2.1软件分析对WalR蛋白的序列保守性。
2 结果 2.1 WalR基因扩增肺炎链球菌D39全基因组DNA为模板扩增目的片段,经1% 琼脂糖凝胶电泳分析(图 1-A),可见大小约为705 bp的目的条带,与预期值相符。

|
| 图 1 目的基因的扩增(A),重组质粒菌液PCR(B)与重组质粒双酶切鉴定(C) M:Marker;1:WalR基因扩增产物;2,3:阳性克隆菌的菌液PCR产物;4,5:重组质粒PET28a-WalR双酶切鉴定阳性 |
将扩增的目的基因片段与表达载体PET-28a连接,转化入大肠杆菌DH5α,菌液PCR鉴定如图 1-B所示。对阳性菌提取重组质粒双酶切鉴定如图1-C所示。
2.3 重组蛋白的诱导表达重组质粒转化入大肠杆菌BL21(DE3)后挑取菌落诱导表达,在经过诱导的菌中看到一条明显的条带,分子量约为32 kD大小,即等于26 kD大小的WalR蛋白与6 kD大小的PET28a标签蛋白的分子量之和,与预期相符。WalR蛋白主要集中在破菌液离心后的沉淀中(图 2),即蛋白主要是以包涵体形式存在。

|
| 图 2 WalR重组蛋白表达SDS-PAGE鉴定图 M:maker;1:PET28a空载诱导;2:PET28a-WalR-BL21未诱导;3:PET28a-WalR-BL21破菌液;4:PET28a-WalR-BL21上清;5:PET28a-WalR-BL21沉淀 |
从NCBI蛋白数据库中获得不同型别肺炎链球菌WalR蛋白氨基酸序列:SP SMRU1009(登录号:COO32846.1)、SP S-019(登录号:CMX77473.1)、SP 208_80(登录号:CKH25805.1)、SP 0311(登录号:CKI97140.1)、SP 14(登录号:CRH98180.1)、SP 28F(登录号:CRH96017.1),对以上氨基酸序列进行比对分析,结果(图 3)显示WalR蛋白在不同型别菌株间保守性达99.4%。

|
| 图 3 不同型别肺炎链球菌WalR蛋白保守性分析 |
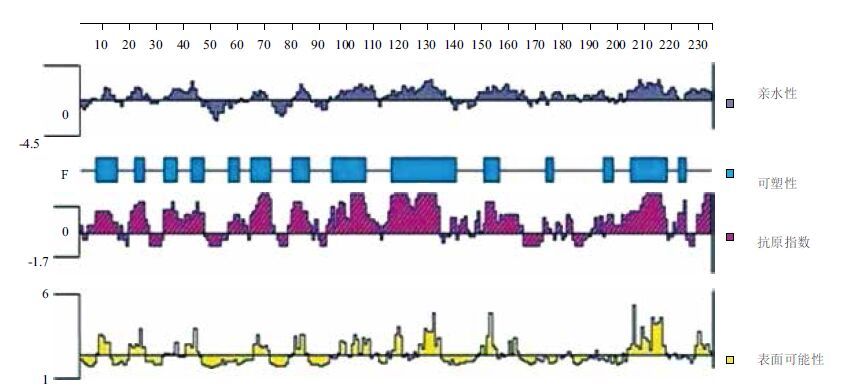
从图 4可看出,以亲水性、可塑性、抗原指数以及表面可能性4种方法预测的WalR蛋白B细胞抗原表位位置比较接近,综合得到的结果显示其较可能成为B细胞抗原表位的氨基酸区段为9-16、35-42、95-111、113-135、150-161、200-218。
|
| 图 4 WalR蛋白B细胞抗原表位分析 |
肺炎链球菌疫苗的研发对于减缓肺炎链球菌的耐药具有不可或缺的作用,其发展共经历了3代[10],第1代为23价多糖疫苗,第2代为7价结合疫苗,第 3代为蛋白质疫苗。蛋白疫苗的研发已经取得重要进展,研究证实,对鸭疫里默氏杆菌(Riemerella anatipestifer)重组外膜蛋白(OmpA)对家禽具有显著的保护效果[11]。肺炎链球菌谷氨酰胺tRNA合成酶(glutamyl tRNA syn-thetase,Gts)作为肺炎链球菌疫苗候选蛋白质,其保护效果也在BALB /c 小鼠体内得到了验证[12]。有关肺炎链球菌蛋白疫苗Audouy[13]等已在人体中用单一重组PspA变体进行Ⅰ期临床试验,结果证实此疫苗能诱导针对异源PspA分子的广谱交叉反应抗体,产生的抗体可以保护小鼠抵抗腹腔注射s.pn的攻击。Intercell公司的S.Pn三联蛋白疫苗已进入了Ⅱ期临床试验,目前还没有上市的s.pn蛋白疫苗。
双组分系统(TCSs)中蛋白调节对WalK/R在低GC含量的革兰氏阳性细菌中具有维持细胞壁及表面稳态的双重作用[14, 15]。研究证实,在金黄色葡萄球菌(Staphylococcus aureus)RN4220血清型中通过基因沉默低表达WalR蛋白质后发现细胞对于外界水解抵抗能力降低[16]。低表达WalR蛋白使得细菌产生侵袭性酶的量减少,细菌的自我保护机制减弱,从而就容易被杀灭。WalR蛋白在细胞生长代谢中的重要地位为其成为肺炎链球菌候选疫苗提供了保障和支持。
实验通过ClustalX 2.1软件对WalR的保守性进行了分析,从它的保守性来看在不同的型别的肺炎链球菌中WalR的保守程度高达99.4%,这一点为后期的WalR蛋白疫苗制备奠定了基础,使得WalR蛋白疫苗可以产生广泛的保护效果(针对更多的肺炎链球菌血清型)。对其B细胞抗原表位分析显示在氨基酸序列 9-16、35-42、95-111、113-135、150-16 1、200-218可能成为抗原表位。这些抗原表位为后期抗原表位鉴定提供了依据。实验首先构建重组表达载体并且在大肠杆菌中表达出WalR蛋白,受翻译速率、折叠速率等因素影响蛋白大部分以包涵体的形式存在,上清中蛋白量很少,课题组通过摸索不同温度、转速及IPTG浓度(如诱导温度设置为12℃、18℃、25℃等;转速为60 r/min、80 r/min、100 r/min等;IPTG浓度为0.1 mmol/L、0.2 mmol/L、0.5 mmol/L、1.0 mmol/L等)诱导条件,但遗憾的是仍然未获得呈上清表达的目的蛋白。可溶性蛋白的获取还需要进一步的摸索诱导表达条件[17]。包涵体中的蛋白量很大,并且包涵体的致密结构可以使蛋白质的空间结构得以保留。可以采取进一步的包涵体溶解和复性获取可溶性蛋白[18, 19]。在后续的研究中,本课题组拟通过蛋白质复性、重新构建质粒等手段,以期获得上清表达的重组目的蛋白。
4 结论通过基因重组对WalR蛋白质进行了原核表达得到大量包涵体形式的蛋白质,ClustalX 2.1软件分析得出其在不同血清型肺炎链球菌中具有高保守性,利用DNASTAR Lasergene v7.1软件对B细胞抗原表位分析显示在氨基酸序列 9-16、35-42、95-111、113-135、150-161、200-218可能成为抗原表位。
| [1] | Sugita G, Hotomi M, Sugita R, et al. Genetic characteristics of Haemophilus influenzae and Streptococcus pneumoniae isolated from children with conjunctivitis-otitis media syndrome[J]. Journal of Infection and Chemotherapy:Official Journal of the Japan Society of Chemotherapy, 2014, 20(8) : 493–497. |
| [2] | Reijtman V, Gagetti P, Faccone D, et al. Macrolide resistance in Streptococcus pneumoniae isolated from Argentinian pediatric patients suffering from acute otitis media[J]. Revista Argentina Demicrobiología, 2013, 45(4) : 262–266. |
| [3] | Altinkanat GG, Soysal A, Kuzdan C, et al. Serotype distribution and antibiotic susceptibilities of Streptococcus pneumoniae causing acute exacerbations and pneumonia in children with chronic respiratory diseases[J]. Mikrobiyoloji Bülteni, 2013, 47(4) : 684–692. |
| [4] | Min X, Zhang X, Wang H, et al. Protection against pneumococcal infection elicited by immunization with glutamyl tRNA synthetase,polyamine transport protein D and sortase A[J]. Vaccine, 2012, 30(24) : 3624–3633. |
| [5] | DosSSR, Passadore LF, Takagi EH, et al. Serotype distribution of Streptococcus pneumoniae isolated from patients with invasive pneumococcal disease in Brazil before and after ten-pneumococcal conjugate vaccine implementation[J]. Vaccine, 2013, 31(51) : 6150–6154. |
| [6] | Huang WZ, Wang JJ, Chen HJ, et al. The heat-inducible essential response regulator WalR positively regulates transcription of sigI,mreBH and lytE in Bacillus subtilis under heat stress[J]. Research in Microbiology, 2013, 164(10) : 998–1008. |
| [7] | Liu P, Chen X, Huang Q, et al. The Role of CzcRS Two-component systems in the heavy metal resistance of Pseudomonas putida X4[J]. International Journal of Molecular Sciences, 2015, 16(8) : 17005–17017. |
| [8] | Dhiman A, Bhatnagar S, Kulshreshtha P, et al. Functional characterization of WalRK:A two-component signal transduction system from Bacillus anthracis[J]. FEBS Open Bio, 2014, 4 : 65–76. |
| [9] | Gotoh Y, Doi A, Furuta E, et al. Novel antibacterial compounds specifically targeting the essential WalR response regulator[J]. The Journal of Antibiotics, 2010, 63(3) : 127–134. |
| [10] | 朱学喆, 赵志强, 谢贵林. 肺炎链球菌疫苗研制进展[J]. 微生物学免疫学进展, 2013, 41(1) : 58–64. |
| [11] | Chu CY, Liu CH, et al. Development of a subunit vaccine containing recombinant Riemerella anatipestifer outer membrane protein A and CpG ODN adjuvant[J]. Vaccine, 2015, 33(1) : 92–99. |
| [12] | 闵迅, 黄美容, 黄健, 等. 肺炎链球菌疫苗候选蛋白质谷氨酰胺tRNA合成酶的保守性与抗原性分析[J]. 临床检验杂志, 2012, 30(6) : 442–446. |
| [13] | Audouy SA, van Selm S, van Roosmalen ML, et al. Development of lactococcal GEM-based pneumococcal vaccines[J]. Vaccine, 2007, 25(13) : 2497–2506. |
| [14] | Moraes JJ, Stipp RN, Harth-Chu EN, et al. Two-component system VicRK regulates functions associated with establishment of Streptococcus sanguinis in biofilms[J]. Infection and Immunity, 2014, 82(12) : 4941–4951. |
| [15] | Wayne KJ, Li S, Kazmierczak KM, et al. Involvement of WalK(VicK)phosphatase activity in setting WalR(VicR)response regulator phosphorylation level and limiting cross-talk in Streptococcus pneumoniae D39 cells[J]. Molecular Microbiology, 2012, 86(3) : 645–660. |
| [16] | Zheng L, Yan M, Fan F, et al. The essential walK histidine kinase and walR regulator differentially mediate autolysis of RN4220[J]. Journal of Nature and Science, 2015, 1(6) : e111. |
| [17] | Sun L, Andika IB, Shen J, et al. The P2 of Wheat yellow mosaic virus rearranges the endoplasmic reticulum and recruits other viral proteins into replication-associated inclusion bodies[J]. Molecular Plant Pathology, 2014, 15(5) : 466–478. |
| [18] | Yamaguchi H, Miyazaki M. Refolding techniques for recovering biologically active recombinant proteins from inclusion bodies[J]. Biomolecules, 2014, 4(1) : 235–251. |
| [19] | Pereira LM, Silva LR, Alves JF, et al. A simple strategy for the purification of native recombinant full-length human RPL10 protein from inclusion bodies[J]. Protein Expression and Purification, 2014, 101 : 115–120. |




