2. 天津科技大学生物工程学院,天津 300457
2. College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457
脂肪酶(lipase,EC3.1.1.3),是一类广泛存在于微生物及动植细胞中的特殊酯键水解酶,可以催化水解甘油三酯生成甘油二酯、单甘酯、甘油及游离脂肪酸[1]。根据现有文献资料初步统计,细菌有28个属,放线菌有4个属,酵母菌有10个属,其他真菌有23个属,共计达65个属的微生物能产生脂肪酶[2]。由于微生物脂肪酶具有较大的商业潜在的需求,微生物脂肪酶的相关研究也逐渐增加[3]。
目前碱性脂肪酶主要用于洗涤剂行业,洗涤剂中添加适量的碱性脂肪酶不仅可以明显提高洗涤剂的洗涤性能,而且对衣物保养,抗再污染等方面有显著效果,加脂肪酶洗涤剂可以代替传统化学制剂应用可以降低自然承受能力,减少环境污染,因此筛选出高产高洗涤能力的脂肪酶菌株,是现如今迫切的需求。从微生物资源中筛选一株高洗涤活性脂肪酶的产生菌株是研究高洗涤活性脂肪酶的前提条件,对其生长特性和酶学特性进行研究,拓宽高洗涤活性脂肪酶的应用领域,对其工业化开发具有重要的意义。而细菌发酵生产脂肪酶受多种条件影响,这些条件能够促进或抑制脂肪酶的产量。为了达到最大脂肪酶产量,除pH、温度、接种时间、接种量、转速等多种物理因素外[4, 5],各个生化因素也必须优化。而洗涤剂中酶的洗涤性能也取决于各种因素,如洗涤剂pH值、离子强度、清洗温度、洗涤剂组成、洗涤程序和洗涤水硬度等[6]。
本实验对施氏假单胞菌产脂肪酶发酵培养基进行单因子优化,选择出最佳的碳氮源。选用N=20的Plackett-Burman设计,考察各个因素的主效应和交互作用。根据Box-Behnken的中心组合设计原理,由Plackett-Burman设计确定的3个主要影响因素各取三水平,设计三因素三水平共17个试验点的响应面分析,最终确定最佳培养基配方,并对施氏假单胞菌PS59脂肪酶的洗涤性能进行评估,确定加酶量、洗涤时间、洗涤温度、洗涤pH和表面活性剂添加量等影响因素的最佳值,旨在为该菌株产脂肪酶的大规模培养及应用提供依据。
1 材料与方法 1.1 材料 1.1.1 菌种实验室自筛菌种,经鉴定为施氏假单胞菌(Pseudomonas stutzeri),编号PS59。
1.1.2 培养基初始发酵培养基(g/L):蛋白胨 20,蔗糖 10,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,无水CaCl2,0.05,大豆油 5,pH 8.5。
优化发酵培养基(g/L):大豆蛋白胨 22.39,蔗糖 10,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,无水CaCl2,0.05,橄榄油 8.1,pH8.1。
1.1.3 主要试剂葡萄糖、糊精、K2HPO4、Tween-80购于天津市北方化玻购销中心;玉米淀粉、可溶性淀粉、麦芽糖、大豆蛋白胨尿素购于天津北方天医化学制剂厂;蔗糖、大豆饼粉、干酪素、CaCl2购于天津市天大化工实验厂;蛋白胨购于天津科瑞思化学试剂公司;酵母浸出粉、MgSO4·7H2O购于天津市化学试剂一厂;(NH4)2SO4购于北京光复精细化工有限公司;橄榄油购于西班牙Moreno公司;乙酸钠,购于国药集团化学试剂;大豆油购于天津市中英保健食品有限公司。所用试剂均为分析纯。
1.1.4 仪器设备酶标仪(美国Thermo公司);HH-B11-420型电热恒温培养箱(天津市实验仪器厂);GL20A型高速冷冻离心机(湖南湘仪);TGL-16C台式离心机(上海安亭科技仪器厂);HS-1300-V型超净工作台(苏州安泰空气技术有限公司);AB204-S型分析天平(梅特勒-托利多仪器上海公司);CHB型普通光学显微镜、显微镜(日本OLYMPUS公司);pH计(梅特勒-托利多仪器上海公司);UV-Vis分光光度计(天德科技有限公司);SP-2012UV型紫外可见分光光度计(上海光谱仪器有限公司);HYG-Ⅱ型回转式恒温调速摇瓶柜(上海欣蕊自动化设备有限公司)。
1.2 方法 1.2.1 施氏假单胞菌菌种制备无菌条件下从斜面接一环施氏假单胞菌菌体至含30 mL种子培养基的250 mL三角瓶中,30℃条件下,置于180 r/min的恒温摇床上培养6 h,作为液体种子备用。
1.2.2 施氏假单胞菌产脂肪酶培养基优化试验 1.2.2.1 最佳碳氮源选择根据初始培养基选择不同的碳氮源进行单因子优化,选择出最佳的碳氮源,碳源如蔗糖、葡萄糖、可溶性淀粉、麦芽糖、糊精、玉米淀粉、乙酸钠,氮源如大豆蛋白胨、黄豆饼粉、干酪素、酵母浸出粉、尿素、硫酸铵、蛋白胨,利用这些碳氮源代替初始培养基中的碳氮源进行发酵培养,测定酶活选择最佳碳氮源。
1.2.2.2 Plackett-Burman(PB)设计根据前期实验及相关文献报道,选取影响发酵培养的可能因素,包括大豆蛋白胨、蔗糖、MgSO4、K2HPO4、CaCl2、橄榄油等10个因素进行全面考察,选用N=20的Plackett-Burman设计,考察各个因素的主效应和交互作用,确定重要影响因素。
1.2.2.3 响应面分析根据Box-Behnken的中心组合设计原理,由Plackett-Burman设计确定的3个主要影响因素各取三水平,设计三因素三水平共17个试验点的响应面分析。
1.2.3 分光光度法测脂肪酶活力A液:浓度为3 mg/mL棕榈酸对硝基酚酯的异丙醇溶液。B液:1% TritonX-100的磷酸缓冲液(100 mmol/L,pH8.0)。
底物溶液(1.9 mL)由A液和B液按1∶9比例混合,并于30℃预处理5 min后加入0.1 mL稀释到一定浓度的酶液反应15 min,于-20℃终止7 min。之后取200 μL反应液加至96孔板中,利用酶标仪在400 nm下测定溶液吸光度(以加失活酶的溶液作为对照)。该法单位酶活定义为每分钟释放1 μmol/min对硝基酚所需酶量。
1.2.4 洗涤试验方法准备10 × 5白色棉布若干,经过沸腾氯仿处理4 h确定所有脂质去除。在棉布两面各加入0.5 mL橄榄油丙酮溶液(100 mg/mL)放置15 min晾干。将棉布放入放入装入100 mL洗涤液的250 mL三角瓶中,30℃,180 r/min保温1 h。
去污力计算公式:去污率%=(Wb-Wa)/(Wb-Wc)×100% ,其中,Wa和Wb分别代表棉布滴油前后重量,Wc代表油布洗涤完后重量。
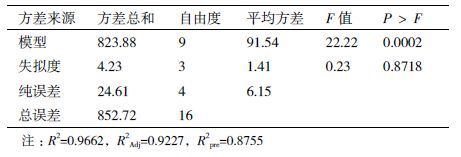
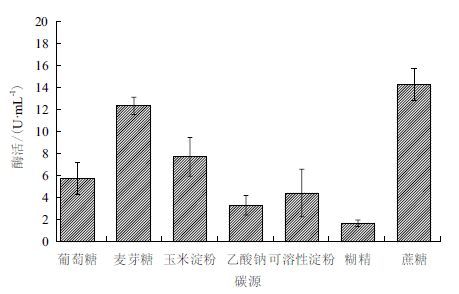
2 结果 2.1 不同碳氮源对产酶的影响在碳氮源单因子实验中,不同类型的碳氮源对脂肪酶产量的影响不同。从图 1中可知,有机碳源对脂肪酶产量的影响要明显高于无机碳源,而有机碳源蔗糖在培养基中的添加,脂肪酶达到最大产量为14.3 U/mL,其次添加麦芽糖时,脂肪酶产量达12.4 U/mL。图 2可见,有机氮源大豆蛋白胨能够显著的刺激脂肪酶达到最大酶活为18.7 U/mL。最后,最佳碳氮源选择分别为蔗糖和大豆蛋白胨。
|
| 图 1 不同碳源(10 g/L)对脂肪酶产量的影响 |

|
| 图 2 不同氮源(20 g/L)对脂肪酶产量的影响 |
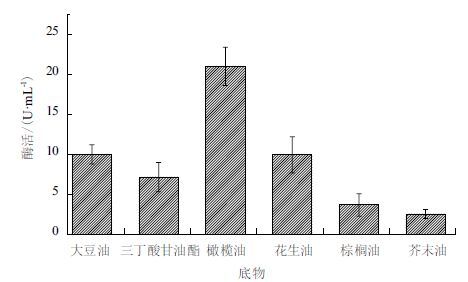
在起始培养基中以不同的油脂替代起始培养基中的大豆油并进行发酵培养。利用分光光度法测定酶活,结果(图 3)显示,橄榄油作为诱导剂的培养基时的酶活达到最佳酶活为21 U/mL。
|
| 图 3 不同底物(5 mL/L)对脂肪酶产量的影响 |
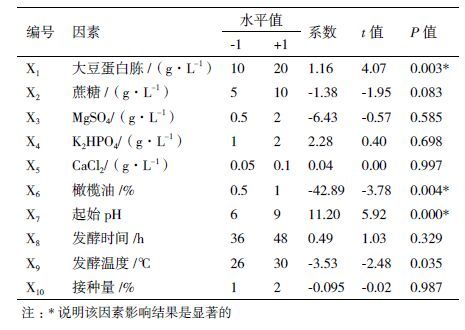
选用实验次数N=20的PB实验设计,对各种培养基组成和培养条件(表 1)进行评估。根据PB实验设计,各个因素设置两个水平:-1为低水平,+1为高水平。表 1详细描述了各影响因素以及其水平值,响应值为各实验所得脂肪酶酶活。
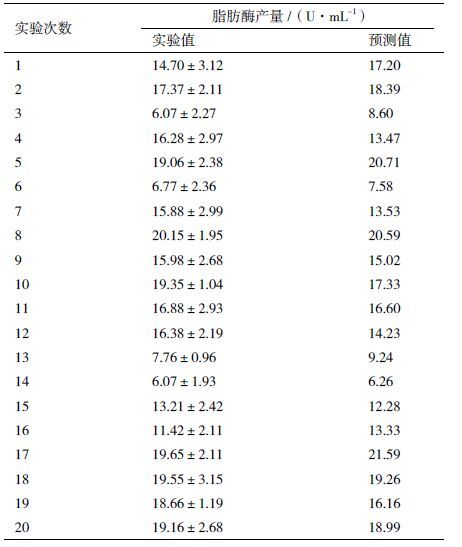
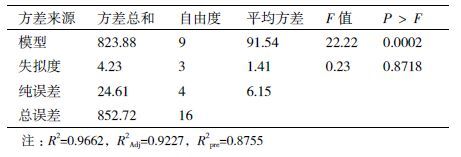
采用回归分析法去检测各个因素对脂肪酶产量影响的显著性(P<0.05),实验结果(表 2)显示,在20次实验中,脂肪酶产量有较大的变化(6.07-19.65 U/mL)。该变化说明了培养基优化获得较高脂肪酶产量的重要性。由表 1中的t值和P值分析可知大豆蛋白胨、橄榄油和起始pH值对脂肪酶产量具有最显著性的影响。
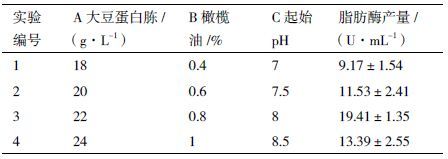
为了能够快速的达到各因素的最佳水平,表 3描述了一种最陡上升法,使主要影响因素同时向响应值增大的方向去接近最大脂肪酶产量区域。针对PB实验筛选出的3种影响最显著因素进行最陡上升实验,结果(表 3)显示,1、2、3号实验时,脂肪酶产量逐渐增加并达到最大值,而4号实验脂肪酶产量降低。因此2号实验中3因素实验值接近最大脂肪酶产量区域。
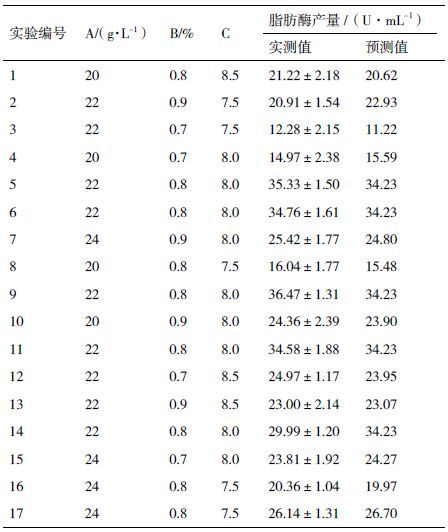
根据上述PB实验和最陡上升实验确定了对脂肪酶产量影响显著因素即大豆蛋白胨(A)、橄榄油(B)、起始pH(C)及其相应的相对较优水平值。然后利用Box-Behnken设计的响应面分析法去测定影响脂肪酶产量的这些因素的最优值。利用Desigh-Expert7.0数理统计软件产生共17组实验。所有变量中间水平值编码为0,最高水平和最低水平值分别被编码为+1和-1,全部实验计划及其实际值见表 2-表 4。每组实验的响应值为3组平行试验值的平均值。
采用Box-Behnken法设计,设计了3因素3水平17个试验点(在中间点上包括5个重复实验)用于拟合二次响应面,表 4详细描述了设计模型和相应的实验数据。通过Design-Expert数理统计软件对实验结果将进行数据方差分析并建立二次响应面回归模型,二次回归方程如下:
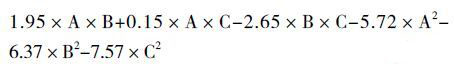 (公式式1)
(公式式1)
式中,Y:脂肪酶产量(U/mL),A:大豆蛋白胨(g/L),B:橄榄油(%),C:起始pH。
利用Design-Expert设计软件进行F检验和方差分析进而对二次响应面回归方程的统计学显著性进行评估。由表 5可知,模型F值为22.22,失拟度F值为0.23。高F值和不显著的失拟度证明该预测模型拟合度较好。并且模型(0.0002)和失拟度(0.8718)的P值也证明了所获得实验结果与模型预测也有较好的一致性。该模型的拟合效果也通过决定系数(R2)来测定。该方程决定系数R2=0.9662,说明约有4.38%不满足该模型对脂肪酶产量的预测。该值说明了二次响应面回归模型具有较好的精度和预测能力。校正决定系数RAdj2=0.9227和预测决定系数RPre2=0.8755也满足于确保该模型的显著性的条件。因此利用该模型分析响应趋势被认为是合理的。
每个变量由回归分析计算所得模型相关系数见表 6。该表详细描述了所有单项、平方项和交互项的回归系数。显著水平设置为5%。
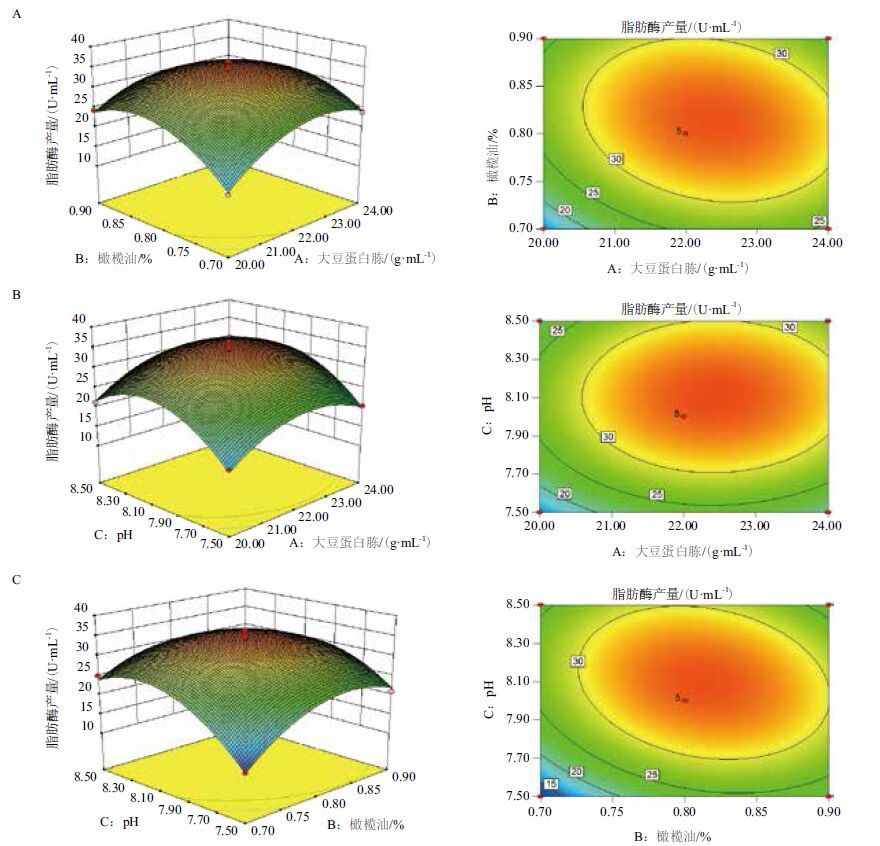
为了更加形象的描述回归模型中响应值和各个变量不同水平,图 4展示出了脂肪酶产量的响应面三维立体图及其响应的等高线图。每个图呈现出两个因素(其他因素保持在0水平)对响应值的影响。正如响应面三维立体图所示,每对变量都具有较好的交互作用。
根据典型相关分析,由该模型预测结果显示,在起始pH、大豆蛋白胨和橄榄油分别设定为8.1、22.39 g/L和0.81%时获得最大脂肪酶产量。脂肪酶产量最大预测值为34.89 U/mL。
|
| 图 4 大豆蛋白胨含量、橄榄油含量和初始pH值及其交互作用对脂肪酶产量影响的响应面曲线和等高线图 |
为了确定优化结果,利用优化后的培养基及培养条件进行发酵平行3次。获得平均脂肪酶产量为36.12±1.32 U/mL,与该模型的计算值基本相符,因而该模型预测该菌株发酵生产脂肪酶是较精确和合理的。并且相对于起始培养基和培养条件所获得的酶活15.65±4.81 U/mL,产量提高了1.3倍。
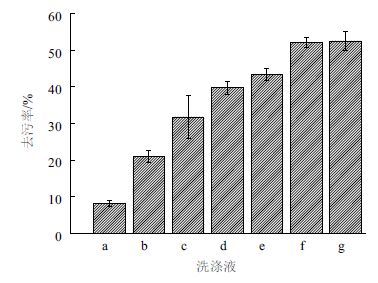
2.6 脂肪酶洗涤性能优化 2.6.1 加酶量对去污率的影响通过改变脂肪酶酶量的添加,来测定去污率的变化。结果(图 5)表明,当脂肪酶添加量大于100 U时,其去污率几乎保持不变,而加酶量在25-100之间,去污率稳定的增加。起始除油速率增加原因在于疏水甘油酯与脂肪酶的水溶液的不断增加的界面面积。由于滴加在棉布上的定量橄榄油表面积可以认为是不变的,因此当脂肪酶增加到一定的浓度时其受限于油水界面而去油率保持不变。因此确定100 U为100 mL洗涤液的最佳添加量。
|
| 图 5 脂肪酶添加量对去污率的影响 a=B;b=B+D;c=B+D+L(25 U);d=B+D+L(50 U);e=B+D+L(75 U);f=B+D+L(100 U);g=B+D+L(125 U)。其中B:磷酸缓冲液;D:1%SDS溶液;L:脂肪酶;其余补水 |
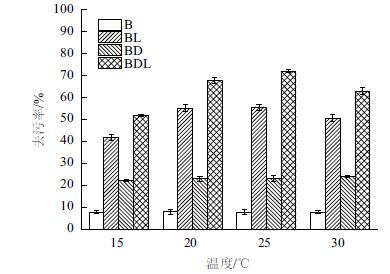
洗涤温度对加酶洗涤剂去污率的影响很大。从洗涤温度与去污力的关系图中(图 6)得知,只含脂肪酶的BL洗涤液最佳洗涤温度为20℃,其与该脂肪酶水解反应最适温度一致。而加酶和洗涤剂的BDL洗涤液的去污率在一定的温度范围内随温度的增加而增加。并于25℃去污率达到最大值。因此确定最佳洗涤温度为25℃。
|
| 图 6 温度对4种不同的洗涤液的洗涤效果影响 B:磷酸缓冲液;BL:磷酸缓冲液+脂肪酶(100 U);BD:磷酸缓冲液+1%SDS溶液;BDL:磷酸缓冲液+1%SDS溶液+脂肪酶(100 U) |
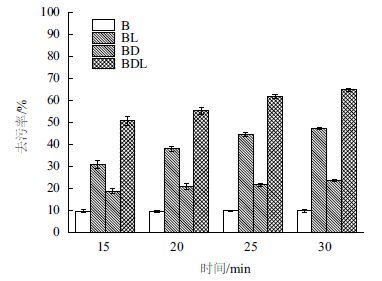
利用4种洗涤液对污布分别处理15、20、25和30 min。根据去污率公式计算出污率,并根据去污率与时间关系绘制柱形图。由图 7可知,除了仅含缓冲液的B洗涤液,其他3种洗涤液去污率都会随时间的增长而稳定的增加,而洗涤时间的长短对B洗涤液的去污率几乎没有影响。并且,同时加酶和洗涤剂的洗涤液的去污率在所有时间都高于其他3种洗涤液。洗涤时间超过25 min后,去污率没有明显的提高,确定最佳洗涤时间为25 min。
|
| 图 7 不同的洗涤时间对洗涤液洗涤效果的影响 B :磷酸缓冲液;BL :磷酸缓冲液+ 脂肪酶(100 U);BD :磷酸缓冲液+1%SDS 溶液;BDL :磷酸缓冲液+1%SDS 溶液+ 脂肪酶(100 U) |
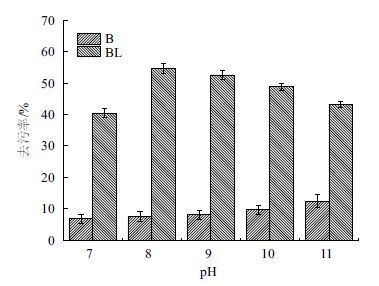
根据不同洗涤液去污率随pH的变化绘制柱形图,结果(图 8)显示,只含缓冲液的B洗涤液的去污率随着pH的升高而稳定增加。BL洗涤液去污率在pH7-9呈递增趋势而又在pH9-11呈递减趋势,并且在pH9时达到最大去污率。其去污效果与pH对脂肪酶活性影响一致。其在pH7-9之间去污率的增长原因在于脂肪酶活性的增加,而随着pH超过9脂肪酶活性降低从而导致去污率的降低。
|
| 图 8 不同pH对洗涤效果的影响 B:磷酸缓冲液;BL:磷酸缓冲液+脂肪酶(100 U) |
SDS及非离子型表面活性剂对去污效率影响试验的结果表明,在SDS浓度为0.5%时达到最大去污率64.05%,洗涤浓度超过0.5%其去污效果逐渐降低。加酶后的洗涤液随着TritonX-100浓度的增加在一定浓度范围内去污率逐渐增加,当TritonX-100浓度达到0.5%以上后,其去污率基本不变。
3 讨论优化产脂肪酶菌株的发酵培养条件,得到更适于菌体产酶的生长条件,拓宽高洗涤活性脂肪酶的应用领域,对其工业化开发具有重要的意义。施氏假单胞菌可利用多种碳源和氮源,其实验室培养产脂肪酶的最佳碳氮源分别为蔗糖和大豆蛋白胨。有机碳源蔗糖使脂肪酶达到最大产量为14.3 U/mL,有机氮源大豆蛋白胨能够显著的刺激脂肪酶达到最大酶活为18.7 U/mL。橄榄油为最佳诱导剂,使酶活达到21 U/mL。以橄榄油为诱导物诱导产脂肪酶菌株生产脂肪酶与许多相关报道一致[5, 7]。通过Plackett-Burman(PB)设计和响应面分析确定最佳培养条件,使脂肪酶产量显著提高。
在各种来源的微生物脂肪酶中,以细菌脂肪酶催化反应的类型最多、活性最高、稳定性最好,其中又以假单胞菌属(Pseudomonas)脂肪酶的性能最为优越[8]。大多数细菌脂肪酶最适作用温度和pH范围分别为35-45℃和8.0-9.0[9],而低温碱性脂肪酶在pH8.0-10.5,温度 10-35℃的范围内有高催化活性[10]。例如,产自Yarrowia lipolytica NCIM 3639的脂肪酶最适温度为25℃;Acinetobacter sp. strain no 6脂肪酶最适温度为20℃;Areomonas sp. LPB 4脂肪酶最适温度为10℃。本研究报道的Pseudomonas stutzeri PS59脂肪酶在低温20℃或更低的温度下能够保持较高酶活,在25℃具最佳洗涤性能,并且pH对其洗涤效果影响不大,说明该酶具有较宽的pH稳定性。此外,该脂肪酶在一定时间内可以稳定存在于多种离子型和非离子型表面活性剂溶液中,具备了工业用酶的条件。
4 结论施氏假单胞菌PS59摇瓶发酵最优培养基组成(g/mL)及条件如下:大豆蛋白胨22.39,蔗糖10,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,CaCl2 0.05,橄榄油8.1,初始pH8.1,培养温度30℃,培养时间36 h,接种量为2%。优化后脂肪酶产量为36.12 U/mL,相对于起始培养基和培养条件下,产量提高了1.3倍。经洗涤性能评估,确定最佳加酶量为100 U,最佳洗涤温度为25℃,最佳洗涤时间为25 min,洗涤pH对该脂肪酶洗涤效果影响不大,SDS浓度为0.5%时达到最大去污率64.05%,TritonX-100浓度达到0.5%以上后,其去污率基本不变。在最佳洗涤条件下,加酶洗涤液的洗涤效率可以提高30%-40%。
| [1] | 季青春, 曹艳, 任伟, 等. 假单胞菌脂肪酶手性拆分研究进展[J]. 化工进展, 2010, 29(4) : 722–727. |
| [2] | Hemachander C, Bose N, PuvanakrishnanR. Whole cell immobiliz-ation of Ralstonia pickettii for lipase production[J]. Process Biochemistry, 2001, 36(7) : 629–633. |
| [3] | M S Silva WOB, Schrank A, et al. production and extration of an extracellular lipase from the entomopathogenic fungus Metarhizium anisopliae[J]. Process Biochemistry, 2005, 40 : 321–326. |
| [4] | 戚薇, 邵静, 王晨. 产低温碱性脂肪酶菌株Acinetobacter johnsonii LP28的鉴定及发酵条件优化[J]. 天津科技大学学报, 2009(6) : 9–12. |
| [5] | Liu R, Jiang X, Mou H, et al. A novel low-temperature resistant alkaline lipase from a soda lake fungus strain Fusarium solani N4-2 for detergent formulation[J]. Biochemical Engineering Journal, 2009, 46(3) : 265–270. |
| [6] | Li XL, Zhang WH, Wang YD, et al. A high-detergent-performance,cold-adapted lipase from Pseudomonas stutzeri PS59 suitable for detergent Formulation[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 102 : 16–24. |
| [7] | Cao Y, Zhuang Y, Yao CJ, et al. Purification and characterization of an organic solvent-stable lipase from Pseudomonas stutzeri LC2-8 and its application for efficient resolution of(R,S)-1-phenylethanol[J]. Biochemical Engineering Journal, 2012, 64 : 55–60. |
| [8] | Panizza P, Syfantou N, Pastor FI, et al. Acidic lipase Li PI. 3from a Pseudomonas fluorescens-like strain displays unusual properties and shows activity on secondary alcohols[J]. Journal of Applied Microbiology, 2013, 114(3) : 722–732. |
| [9] | 黄璜, 李宗军, 王远亮. 各类微生物脂肪酶酶学性质及应用的研究进展[J]. 粮油食品科技, 2014, 22(1) : 109–118. |
| [10] | 刘瑞娟, 王海宽, 路福平. 低温碱性脂肪酶产生菌的筛选及产酶培养基的优化[J]. 天津科技大学学报, 2009, 24(1) : 6–10. |