2. 清华大学核能与新能源技术研究院,北京 100084
2. Institute of Nuclear and New Energy Technology, Tsinghua University,Beijing 100084
全球能源危机和环境恶化引起了对可再生生物能源的研究热潮,生物丁醇具有热值高、蒸汽压力低、与汽油配伍性好、腐蚀性较小,可以直接应用于发动机而无需对发动机进行改造等优点,不仅是理想的可再生生物能源,而且是优良的有机溶剂、重要的化工原料,被广泛应用于化工、塑料、有机合成、油漆等工业[1-3]。传统丁醇发酵以粮食作物如玉米作为主要原料,存在“与人争粮”的问题,采用糖蜜、木薯作为生产原料可以避免上述问题,但是其来源有限,同时还受季节的限制,这些都严重影响了丁醇工业化规模生产。
木质纤维素生物质原料来源丰富,成本低廉,它主要包括纤维素、半纤维素和木质素[4, 5]。纤维素是D-葡萄糖基以β-糖苷键联结而成的链状高分子化合物,半纤维素是无定型的生物高聚物,它们含有六碳糖与五碳糖等不同糖基[6],通过氢键与纤维素的微纤丝结合,形成细胞壁骨架的网络结构[7, 8]。纤维素和半纤维素经过酸水解处理可降解为能发酵的戊糖和己糖,但同时又会产生乙酸、糠醛,5-羟甲基糠醛等抑制物[9, 10],这些抑制物的存在对微生物发酵丁醇有抑制作用,所以必须对其进行脱毒处理[11-14],但同时这又会增加成本。单独抑制物的存在,如糠醛类物质在丙酮丁醇发酵中对菌体生长并不一定起到抑制作用[15, 16]。但是,单独的一种抑制物并不能代表水解液,在水解液的应用中,也很难把各种抑制物分开。因此,本研究以自行筛选获得的产丁醇共生体系TSH06(包括丙酮丁醇梭菌Clostridium acetobutylicum TSH1,芽孢杆菌Bacillus sp.TSH1)[17]为丁醇发酵菌株,利用酸水解处理的玉米芯半纤维素水解液为底物,探讨水解液中抑制物对丁醇发酵的抑制作用,旨在为利用半纤维素水解液发酵丁醇提供理论依据。
1 材料与方法 1.1 材料 1.1.1 玉米芯半纤维素水解液的制备粉碎的玉米芯与稀酸溶液,其中混合酸:0.5%(M/V)H2SO4,1.5%(M/V)H3PO4)以1∶3(M/V)的比例进行混合,高温高压(130℃)处理1 h,对所有固形物进行挤压抽滤,抽滤的同时加入稀酸溶液两倍体积的去离子水即得半纤维素水解液。水解液中糖浓度为:葡萄糖5 g/L,木糖30 g/L。
1.1.2 菌种与培养基菌种:产丁醇共生体系TSH06,由本室分离并保存。种子培养基:玉米醪(6%)煮沸15 min,115℃灭菌15 min。P2培养基:按照水解液中糖的成分配制;葡萄糖 5.6 g/L,木糖 30.1 g/L,酵母粉 1 g/L。115℃灭菌15 min。发酵培养基:将玉米芯半纤维素水解液与糖含量相同的P2培养基以不同比例混合,使其总糖达到35 g/L,pH调至7.0,115℃灭菌15 min。营养液1:MgSO4 20 g/L,MnSO4 1 g/L,FeSO4 1 g/L,NaCl 1 g/L,对氨基苯甲酸 0.1 g/L,硫胺素 0.1 g/L,生物素 0.001 g/L。营养液2:KH2PO4 50 g/L,K2HPO4 50 g/L,CH3COONH4 220 g/L。
1.2 方法 1.2.1 玉米芯半纤维素水解液的稀释对上述水解液按照表 1所示比例进行不同程度的稀释,水解液的含量分别为35%-60%。
用氨水或NaOH溶液调节pH至7.0,装入100 mL摇瓶,装液量为60 mL,115℃灭菌15 min。对每一稀释度的水解液做3个平行实验。
1.2.3 培养方法种子复苏:甘油冻存的菌株TSH06接种于玉米培养基,37℃培养箱静置培养至气泡产出。种子培养:将种子液以7%的接种量接种于100 mL三角瓶(装液量60 mL)的P2培养基中,并添加装液量1%的溶液1与溶液2,37℃静置培养至产生均匀气泡。发酵玉米芯半纤维素水解液:将TSH06种子液以7%的接种量接种于100 mL三角瓶(装液量60 mL)的玉米芯半纤维素水解液与P2培养基对照组中,并添加1%的溶液1与溶液2,37℃静置培养。
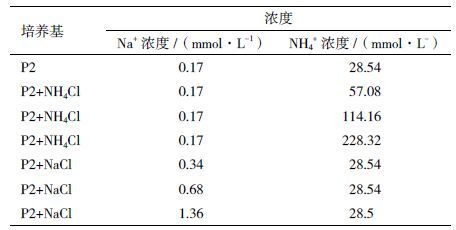
1.2.4 培养基中Na+与NH4+的添加P2培养基中已加入装液量1%的溶液1与溶液2,故培养基中含有0.17 mmol/L的NaCl以及28.54 mmol/L CH3COONH4,以普通P2培养基为对照,向已加入1%的溶液1与溶液2的P2培养基中分别添加NaCl以及NH4Cl至如下浓度(表 2)。
分别提取TSH06接种P2培养基和50%水解液培养基24 h后的菌体总RNA(Kit名称,OMEGA),电泳检测样品完整性,并测定样品浓度,RNA反转录生成 cDNA补充反转录体系。采用 SYBR Premix Ex Taq(TaKaRa)进行real time PCR,反应体系为20 μL,包括:2×SYBR Premix Ex Taq Ⅱ 10 μL;引物×2(10 μmol/L)0.8 μL;cDNA模板(<100 ng);无菌蒸馏水补齐至20 μL。采用三步法进行反应:95℃预变性1 min;95℃变性10 s,50℃退火20 s,72℃延伸20 s,40个循环。每个样品做3个平行。荧光定量PCR采用相对定量方法中的2-△△Ct,其中△△Ct=(待测组目的基因平均Ct值 - 待测组管家基因平均Ct值)-(对照组目的基因平均Ct值 - 对照组管家基因平均Ct值),以16S RNA基因作为内参,计算mRNA的转录水平。
1.2.6 分析方法溶剂(乙醇、丙酮、丁醇)测定方法:采用气相色谱仪(GC,岛津公司2010)进样检测。根据气相色面积信息对溶剂进行定性和定量分析。糖类、有机酸及抑制物的测定方法:采用高效液相色谱法(HPLC,岛津公司LC-20A)测定,根据液相色谱保留时间和峰面积信息对糖类、有机酸及抑制物进行定性和定量分析[18]。生物量测定方法:生物量测定采用比浊法[19],采用分光光度计在600 nm 处测定其OD600值。
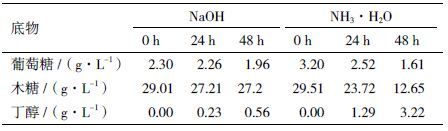
2 结果 2.1 不同pH调节物质对TSH06在玉米芯半纤维素水解液生长的影响酸处理的玉米芯半纤维素水解液中葡萄糖浓度为5.6 g/L,木糖浓度30.1 g/L,根据这一比例配制P2培养基,并以此P2培养基对水解液进行稀释,对50%稀释度的水解液分别利用NaOH和氨水进行pH的调节,接种TSH06。结果(表 4)表明,利用NaOH进行pH调节的水解液在发酵过程中并未出现菌体生长和发酵产气的现象,葡萄糖和木糖没有消耗。利用氨水进行pH调节的水解液中,出现了发酵液大量产气的现象,葡萄糖与木糖都有一定程度的消耗,发酵产生了丁醇。
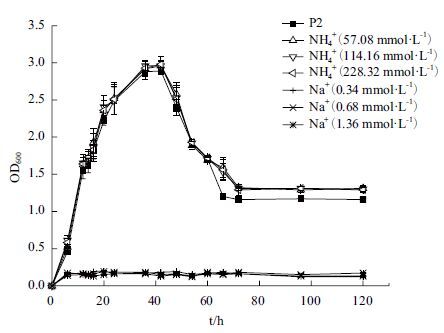
为探究培养基中Na+与NH4+浓度对TSH06生长的影响,在向已加入1%的溶液1与溶液2的P2培养基中分别添加NaCl 以及NH4Cl。TSH06生长情况,如图 1所示。
以半合成培养基P2作为对照,在整个培养过程中,添加有NaCl的P2培养基中OD600值变化很小,也没有出现产气的现象,证明两倍于普通P2培养基中Na+浓度,即浓度达到0.34 mmol/L已经对TSH06的生长产生了抑制作用。而添加有NH4Cl的P2培养基中,虽然对数生长期TSH06的生长情况相对于普通P2培养基中差异不大,但当菌株生长达到稳定期以及衰亡期时,其生物量都大于普通P2培养基中的生物量,证明NH4+的加入对TSH06的生长在一定程度上起到了一定促进作用。
|
| 图 1 P2培养基中Na+与NH4+浓度对TSH06生长情况的影响 |
为探究TSH06对水解液中抑制物的耐受浓度,将水解液与相同糖浓度P2培养基以稀释比分别为10∶0、6∶4、5∶5进行混合稀释,得到100%、60%、50%的水解液培养基。初始玉米芯半纤维素水解液中糖类与抑制物浓度如表 5所示。在100%与60%的水解液中,接种后48 h都没有出现菌体生长且产气的现象,也没有糖的消耗与丁醇等溶剂的产生,而在50%及以下的水解液中,菌株能够生长发酵丁醇。
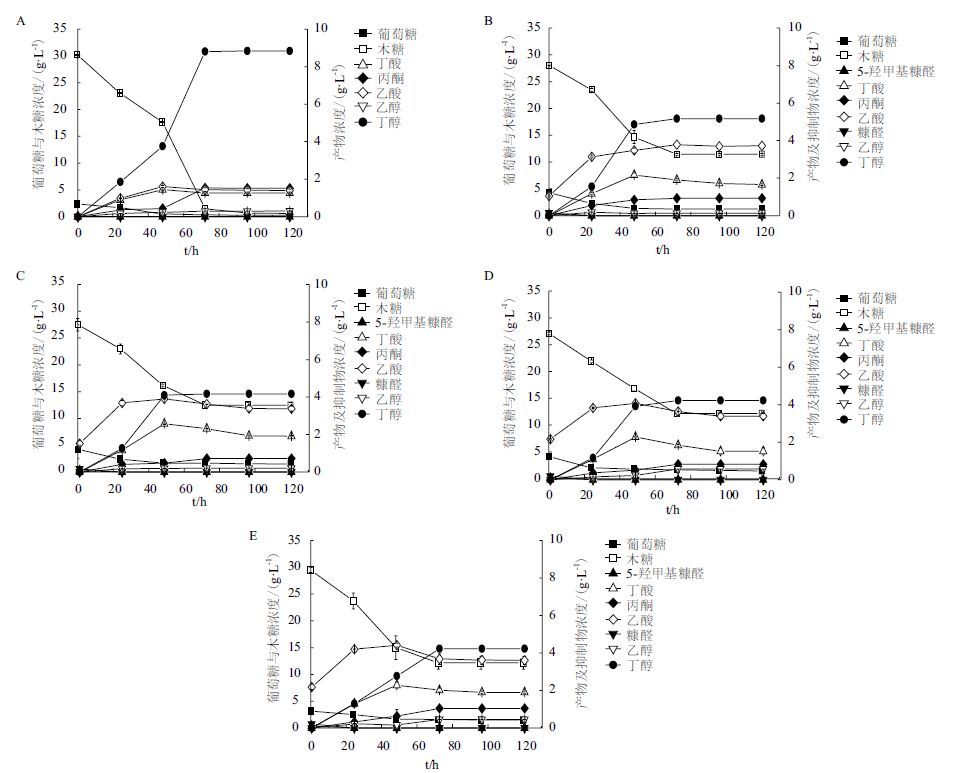
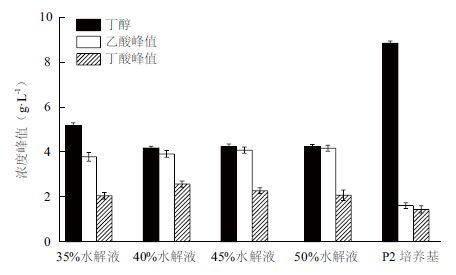
由于抑制物的毒性,使得产丁醇菌株不能直接利用半纤维素水解液,脱毒处理去除抑制物后可以进行丁醇发酵,但会增加脱毒成本。因此,本实验利用相同糖浓度的P2培养基与水解液按一定比例混合,得到35%-50%的水解液培养基,探讨以部分水解液作为底物的可行性。通过氨水调节pH,以P2培养基作对照,接种TSH06进行发酵,发酵结束后测得各种产物的浓度及丁醇得率(表 6),TSH06在P2培养基和各种稀释水解液中,均能生长发酵,并产生乙醇、丙酮、丁醇(图 2)。在相同糖浓度的P2发酵液中,糖几乎完全被消耗,丁醇浓度达8.84 g/L,在35%-50%稀释水解液中,糖均有10 g以上的剩余,丁醇产量有不同程度降低。在35%的水解液中(图 2-B),丁醇浓度为5.17 g/L,在40%-50%的水解液中,丁醇浓度为4.2 g/L左右(图 2-C,2-D,2-E),而水解液中乙醇与丙酮产量与P2培养基对照中的差别不大。到48 h,P2发酵液中丁醇达4 g/L左右,之后在72 h达到最大(图 2-A)。而在35%-45%的稀释水解液中,48 h丁醇浓度也达4 g/L,之后略有升高,但变化不大;在50%的稀释水解液中,48 h丁醇浓度为2.74 g/L,之后继续升高,在72 h达到最大值4.22 g/L。
|
| 图 2 P2培养基及35%-50%水解液发酵生产丁醇 A:P2培养基发酵生产丁醇;B:35%水解液发酵生产丁醇;C:40%水解液发酵生产丁醇;D:45%水解液发酵生产丁醇;E:50%水解液发酵生产丁醇 |
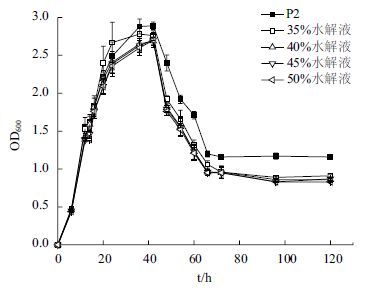
在P2发酵液中,乙酸和丁酸的浓度在发酵开始后升高,48 h达到最高,乙酸、丁酸分别为1.61 g/L、1.44 g/L;到发酵结束,略有下降,乙酸、丁酸分别为1.40 g/L,1.26 g/L(图 2-A)。从生长曲线看(图 3),在对数生长期,P2培养基与稀释水解液中TSH06的生长情况差异不大,在24 h的稀释水解液培养中没有检测糠醛和5-羟甲基糠醛(图 2),说明稀释后水解液中的少量糠醛和5-羟甲基并未抑制菌体本身的生长。得到稀释水解液TSH06生长过程中所达到的最大的生物量均低于P2培养基中的水平,在菌株生长进入衰亡期后,水解液中TSH06的衰亡速率明显快于P2培养基,至发酵结束,最终生物量也低于P2培养基中的水平。
稀释水解液中,乙酸起始浓度在1-2 g/L之间,之后随着产酸期的进行,乙酸浓度继续升高,达 4 g/L左右,远高于P2中乙酸的浓度(图 4)。在35%-45%的稀释水解液中,48 h乙酸以及丁酸浓度几乎达最大,之后略有波动,变化不大。在50%的稀释水解液中,48 h乙酸浓度为4.16 g/L,丁醇浓度2.45 g/L,之后乙酸浓度下降,丁醇浓度上升,到72 h,乙酸、丁醇浓度分别为3.86 g/L、4.22 g/L。发酵结束时,各稀释水解液中乙酸浓度相似,为P2中乙酸浓度的2.34-2.58倍(图 4,图 5)。在稀释水解液中,丁酸浓度在48 h达最大,之后略有降低,至发酵结束,仍较P2发酵液高42%-78%(图 5)。
|
| 图 3 P2培养基及35%-50%水解液中TSH06生长曲线 |

|
| 图 4 不同培养基中乙酸浓度 |
|
| 图 5 发酵结束时不同培养基中丁醇浓度以及发酵过程中乙酸与丁酸浓度峰值 |
为了探讨抑制物对关键酶基因表达的影响,通过real time PCR,检测发酵代谢通路中,乙酸生成的关键酶磷酸乙酰转移酶基因(pta)和乙酸激酶基因(ack)、丁酸生成的关键酶基因磷酸丁酰转移酶基因(ptb)和丁酸激酶基因(buk)、酸返耗的关键酶CoA转移酶基因(ctf)和3个丁醇生成的关键酶醇脱氢酶基因(adhE、bdhA和bdhB)的mRNA表达水平。选取以稀释度最高的50%的稀释水解液为研究对象,以P2培养基为对照,取24 h发酵液,进行分析。结果(图 6)表明,丁酸生成途径的关键酶基因buk和ptb的mRNA在水解液中水平分别为P2培养基的1.12和1.45倍;而在乙酸生成途径中,pta和ack mRNA在水解液中为P2培养基的1.75和7.45倍;同时水解液中,丁酸、乙酸向丁酰辅酶A以及乙酰辅酶A转化的关键基因ctf mRNA只有P2培养基的0.21倍。而TSH06乙醇、丁醇生成途径的adhE、bhdA、bdhB的mRNA水平分别是在P2培养基中的0.09、0.83及0.44倍。这些结果表明乙酸、丁酸合成途径关键酶表达水平上升,而返耗途径关键酶表达受到抑制,这种变化导致了乙酸、丁酸的积累。丁醇和乙醇生成途径关键酶基因表达水平的下降,导致丁醇合成受阻,使得最终水解液中丁醇产量降低。

|
| 图 6 50%水解液以及P2培养基中TSH06关键基因转录水平的对比 |
本研究通过用用氨水或NaOH溶液调节培养基pH发现,培养基中添加Na+会抑制TSH06的生长,而用氨水调节pH可为菌株的生长提供氮源,有利于菌株的生长。
TSH06在体积比等于或低于50%的酸水解液,抑制物糠醛与5-羟甲基糠醛在接种24 h后可被TSH06代谢,菌株生长并发酵产丁醇,最终丁醇产量只有P2培养基的一半左右,而乙酸浓度明显高于P2发酵液。张杰[20]在以木质纤维素为原料发酵生产丙酮丁醇的过程以及科学机理研究中说明,丁醇的发酵分为产酸期和产溶剂期。产酸期主要产物是乙酸和丁酸,随着酸的累积,pH下降,细胞代谢向产溶剂期转化,产酸期形成的乙酸和丁酸在CoA转移酶的作用下,分别生成乙酰CoA和丁酰CoA,又进入代谢通路,参与溶剂的生成,因此,乙酸和丁酸有一个先升高再降低的过程。48 h之前,在P2发酵液和稀释水解液中,乙酸都逐渐升高。P2发酵液的乙酸浓度维持在2 g/L以下;而在稀释水解液中,乙酸的起始浓度为1.5-2 g/L,在此浓度下,TSH06可以生长进行丁醇发酵,但乙酸、丁酸的浓度也随着升高,到48 h时,乙酸达最大为3.78-4.16 g/L以上,大于同类发酵中乙酸浓度的最高值。Lu等[21]的研究表明,拜氏梭菌在稀释水解液发酵过程中乙酸初始浓度在2 g/L以上,最高浓度未超过2.9 g/L。而在48 h时,在35%-45%的水解液中,丁醇浓度也达最大,此时,尽管糖还有15 g/L左右,但也只产生少量或不再产丁醇,糖也只有少量消耗,发酵结束,糖浓度还有12 g/L以上。在水解液中,糠醛,5-羟甲基糠醛在24 h内已经被代谢消耗完全,不会抑制菌体生长。Qureshi[22]研究发现,拜氏梭菌在未脱毒水解液发酵,乙酸初始浓度达到6.5 g/L,发酵过程中乙酸最高浓度13.3 g/L,菌体丙酮乙醇丁醇总量只有1.7 g/L,几乎不发酵,说明高的有机酸浓度,尤其是乙酸浓度可能使菌体受到抑制,发酵停止。
由发酵结果可知,在50%稀释水解液中,有机酸尤其是乙酸浓度较P2发酵液显著提高,而丁醇产量明显降低(图 3),故通过Real-time PCR,根据Lütke-Eversloh等[23]的研究表明,检测发酵代谢通路中,乙酸生成的关键酶磷酸乙酰转移酶基因(pta)和乙酸激酶基因(ack)、丁酸生成的关键酶基因磷酸丁酰转移酶基因(ptb)和丁酸激酶基因(buk)、酸返耗的关键酶CoA转移酶基因(ctf)和3个丁醇生成的关键酶醇脱氢酶基因(adhE、bdhA、bdhB)的mRNA表达水平。选取以稀释度最高的50%的稀释水解液为研究对象,以P2培养基为对照,取24 h发酵液,进行分析。结果显示,生成乙酸与丁酸途径的关键基因转录水平的提高,而返耗途径的ctf基因转录水平的降低,是造成乙酸和丁酸的大量积累的原因。在水解液中,醇生成的关键酶基因表达受到影响,进而会影响丁醇的产量。这些结果为TSH06在水解液发酵中大量产酸,阻滞丁醇发酵以及菌体生长提供了分子生物学依据。
4 结论利用含糖培养基对半纤维素水解液进行稀释,研究了抑制物对产丁醇共生体系TSH06生长发酵的抑制作用,发现产 TSH06在60%及以上稀释度的水解液中不能生长进行丁醇发酵,合适的稀释浓度为50%及以下。利用NaOH或氨水调节稀释水解液的pH值,菌体的生长存在差异,用NaOH调节pH值会抑制菌体的生长,而利用氨水调节pH值有利于菌体生长,且发酵丁醇。稀释水解液中的糠醛和5-羟甲基糠醛不会对TSH06产生抑制作用。但是在水解液中生长的产丁醇菌株TSH06相对于P2培养基有机酸生成途径关键基因的转录水平明显提高,有机酸返耗途径以及丁醇生成途径关键基因的转录水平明显下降,而有机酸尤其是乙酸浓度对TSH06丁醇发酵有明显的抑制作用。
| [1] | Ezeji TC, Qureshi N, Blaschek HP, et al. Production of acetone,butanol and ethanol by Clostridium beijerinckii BA101 and in situ recovery by gas stripping[J]. World Journal of Microbiology and Biotechnology, 2003, 19(6) : 596–603. |
| [2] | 彭建林. 世界丁辛醇生产技术与市场分析[J]. 化学科技市场, 2005, 4 : 1–8. |
| [3] | 沈佩芝, 任诚. 丁醇、辛醇生产技术与市场需求预测[J]. 化工进展, 2005, 24(2) : 216–220. |
| [4] | Kumar S, Kothari U, Kong LZ, et al. Hydrothermal pretreatment of switch grass and corn stover for production of ethanol and carbon microspheres[J]. Biomass Bioenergy, 2011, 35 : 956–968. |
| [5] | T achibana R,Shimizu S,Kobayshi S,et al. Electronic watermarking method and system:US,6915001[P]. 2002-04-25. |
| [6] | Lin ZX, Huang H, Zhang HM, et al. Ball milling pretreatment of corn stove for enhancing the efficiency of enzymatic hydrolysis[J]. Appl Biochem Biotechnol, 2010, 162 : 1872–1880. |
| [7] | 孙万里, 陶文沂. 木质素与半纤维素对稻草秸秆酶解的影响[J]. 食品与生物技术学报, 2010, 29(1) : 18–22. |
| [8] | 罗鹏, 刘忠. 木质生物资源的水解[J]. 林产化学与工业, 2006, 26(2) : 99–104. |
| [9] | 张继泉, 王瑞明, 孙玉英. 利用木质纤维素生产燃料酒精的研究进展[J]. 酿酒科技, 2003, 115(1) : 39–42. |
| [10] | Guo T, He AY, Du TF, et al. Butanol production from hemicellulosic hydrolysate of corn fiber by a Clostridium beijerinckii mutant with high inhibitor-tolerance[J]. Bioresour Technol, 2013, 135 : 379–385. |
| [11] | Guo T, Tang Y, Zhang QY, et al. Clostridium beijerinckii mutant with high inhibitor tolerance obtained by low-energy ion implantation[J]. Microbiol Biotechnol, 2012, 39(3) : 401–407. |
| [12] | Qureshi N, Li XL, Hughes S, et al. Butanol production from corn fiber xylan using Clostridium acetobutylicum[J]. Biotechnol Progr, 2006, 22(3) : 673–680. |
| [13] | Pradip BD, Bin W, Hao F. Detoxification of corn stover hydrolysate using surfactant-based aqueous two phase system[J]. Journal of Chemical Technology and Biotechnology, 2013, 88(9) : 1744–1749. |
| [14] | Qureshi N, Saha BC, Hector R E, et al. Production of butanol(a biofuel)from agricultural residues:part Ⅱ-use of corn stove and switch grass hydrolysates[J]. Biomass Bioenergy, 2010, 34 : 566–571. |
| [15] | Qureshi N, Saha BC, Hector RE, et al. Butanol production from wheat straw by simultaneous saccharification and fermentation using Clostridium beijerinckii:Part Ⅰ-batch fermentation[J]. Biomass Bioenergy, 2008, 32 : 168–175. |
| [16] | Zhang Y, Han B, Ezeji TC. Biotransformation of furfural and 5-hydroxymethyl furfural(HMF)by Clostridium acetobutylicum ATCC 824 during butanol fermentation[J]. New Biotechnology, 2012, 29(3) : 345–351. |
| [17] | Wang G, Wu PF, Liu Y, et al. Isolation and characterization of non-anaerobic butanol-producing symbiotic system TSH06[J]. Applied Microbiology and Biotechnology, 2015, 99(20) : 8803–8813. |
| [18] | 段晓瑞, 王根宇, 刘宏娟, 等. 兼性厌氧芽胞杆菌TSH06丁醇代谢途径中关键酶的检测[J]. 生物工程学报, 2013, 29(5) : 620–629. |
| [19] | 陈坚, 堵国成, 李寅. 发酵工程实验技术[M]. 北京: 化学工业出版社, 2003 : 142-148. |
| [20] | 张杰. 以木质纤维素为原料发酵生产丙酮丁醇的过程以及科学机理研究[D]. 济南:山东大学,2012. |
| [21] | Lu CC, Dong J, Yang ST. Butanol production from wood pulping hydrolysate in an integrated fermentation-gas stripping process[J]. Bioresource Technology, 2013, 143(9) : 467–475. |
| [22] | Qureshi N, Ezeji TC, Ebener J, et al. Butanol production by Clostridium beijerinckii. Part Ⅰ:use of acid and enzyme hydrolyzed corn fiber[J]. Bioresource Technology, 2008, 99 : 5915–5922. |
| [23] | Lütke-Eversloh T, Bahl H. Metabolic engineering of Clostridium acetobutylicum:recent advances to improve butanol production[J]. Current Opinion in Biotechnology, 2011, 22(5) : 634–647. |